
第五章酸碱滴定法 acid-base titration 本章主要内容: 1、酸碱质子理论; 2、酸碱平衡体系中各型体的分布: 3、酸碱平衡体系pH值的计算: 4、酸碱缓冲溶液; 5、酸碱指示剂; 6、酸碱滴定基本原理; 7、终点误差计算; 8、酸碱滴定法的应用
1 第五章 酸碱滴定法 (acid-base titration) 本章主要内容: 1、酸碱质子理论; 2、酸碱平衡体系中各型体的分布; 3、酸碱平衡体系pH值的计算; 4、酸碱缓冲溶液; 5、酸碱指示剂; 6、酸碱滴定基本原理; 7、终点误差计算; 8、酸碱滴定法的应用

概述 酸碱滴定法是基于酸碱反应的滴定分析方法 其理论基础为酸碱平衡理论 §5.1溶液中的酸碱反应与平衡 一、活度与浓度 活度:在化学反应中表现出来的有效浓度,通常用α 表示 ai=yi ci 活度系数y:表达实际溶 溶液无限稀时:y=1 液和理想溶液之间的差 中性分子:y=1 异大小 溶剂活度:=1
2 概述 酸碱滴定法是基于酸碱反应的滴定分析方法 其理论基础为酸碱平衡理论 §5.1 溶液中的酸碱反应与平衡 一、 活度与浓度 活度:在化学反应中表现出来的有效浓度,通常用a 表示 ai = gi ci 溶液无限稀时: g =1 中性分子: g =1 溶剂活度: a =1 活度系数γi表达实际溶 液和理想溶液之间的差 异大小
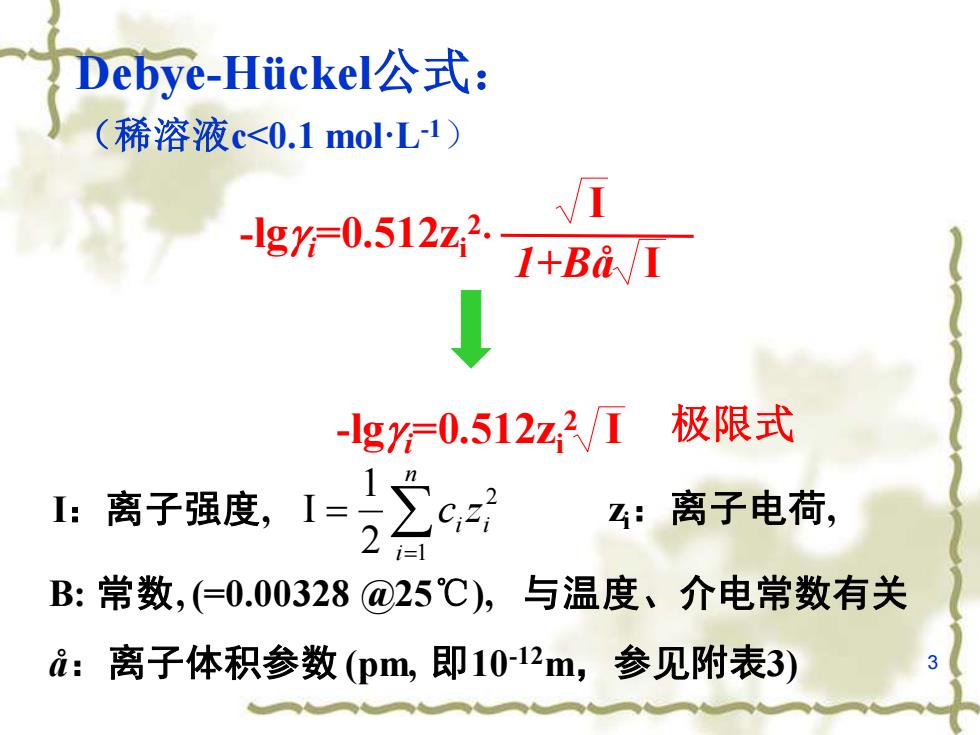
Debye-Huickel公式: (稀溶液c<0.1moL1) -lg0.512z2. 1+Ba/I lg=0.512z2/T 极限式 1:离子强度,1-2之c对 :离子电荷, B:常数,(=0.00328@25℃),与温度、介电常数有关 i:离子体积参数(pm,即10-12m,参见附表3)
3 Debye-Hückel公式: (稀溶液c<0.1 mol·L-1) -lgg i=0.512zi 2 I 1+Bå I -lgg i=0.512zi 2 I 极限式 I:离子强度, 2 2 1 1 I i n i i c z = = zi:离子电荷, B: 常数, (=0.00328 @25℃), 与温度、介电常数有关 å:离子体积参数 (pm, 即10-12m,参见附表3)
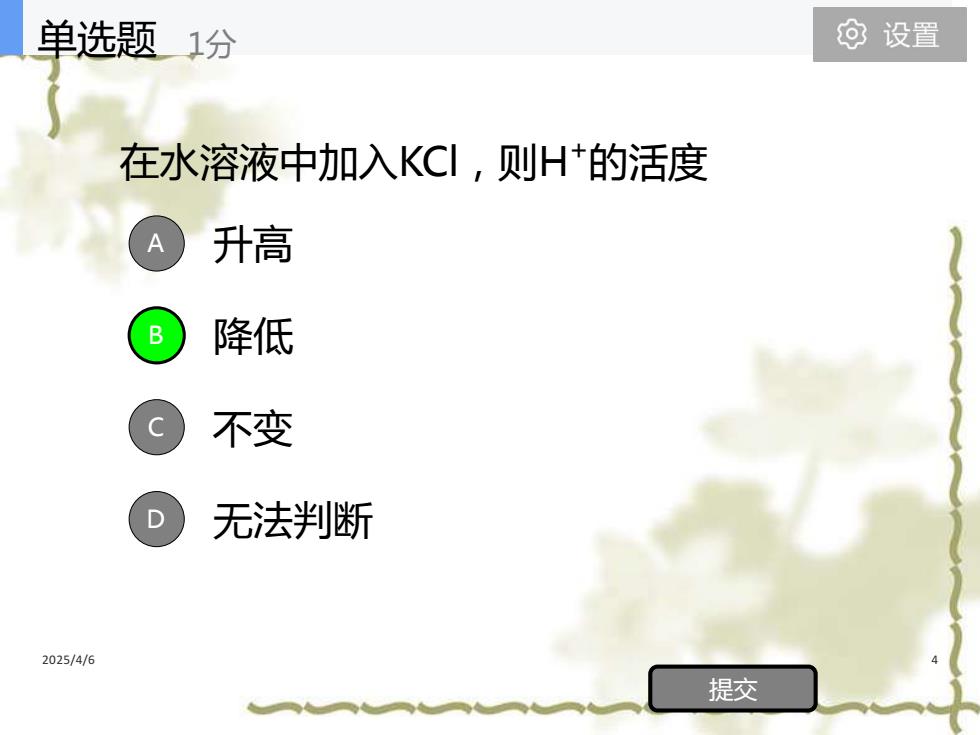
单选题1分 ⊙设置 在水溶液中加入KC!,则H+的活度 升高 B 降低 不变 无法判断 2025/4/6 提交
2025/4/6 4 在水溶液中加入KCl,则H +的活度 升高 降低 不变 无法判断 A B C D 提交 单选题 1分
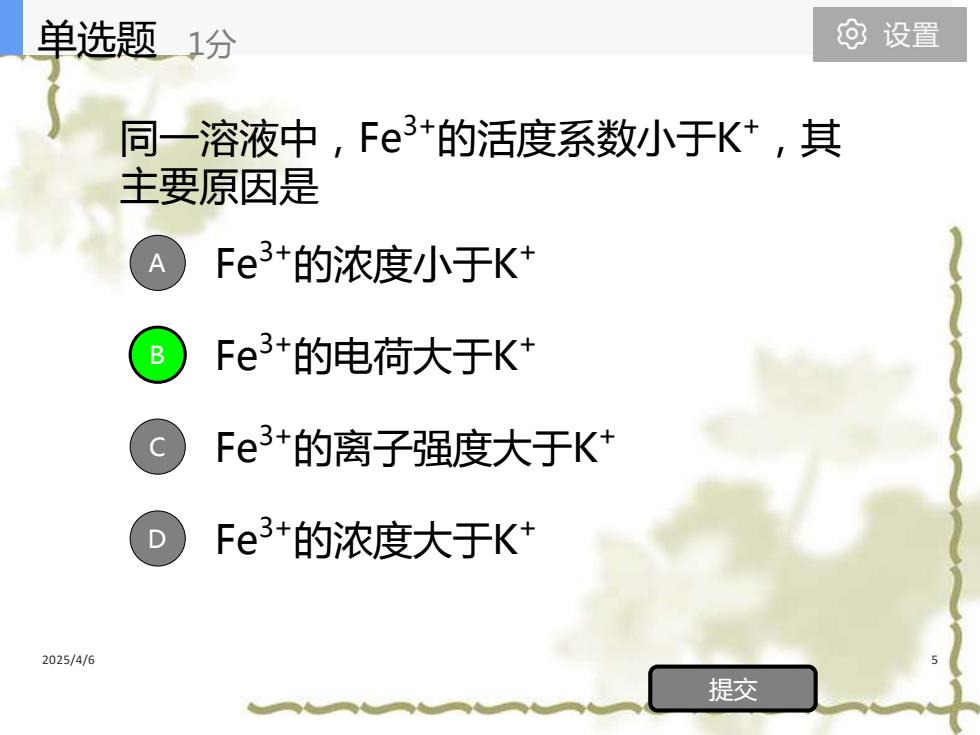
单选题1分 可设置 同一溶液中,Fe3+的活度系数小于K+,其 主要原因是 A Fe3+的浓度小于K+ B Fe3+的电荷大于K Fe3+的离子强度大于K+ Fe3+的浓度大于K 2025/4/6 提交
2025/4/6 5 同一溶液中,Fe3+的活度系数小于K +,其 主要原因是 Fe3+的浓度小于K + Fe3+的电荷大于K + Fe3+的离子强度大于K + Fe3+的浓度大于K + A B C D 提交 单选题 1分