
第五章酸碱平衡与酸碱滴定法 acid-base equilibrium and titration 5.1溶液中的酸碱反应与平衡 5.2酸碱组分平衡浓度与分布分数 5.3溶液中的H+浓度计算 5.4对数图解法 5.5酸碱缓冲溶液 5.6 酸碱指示剂 5.7酸碱滴定原理 5.8终点误差 5.9酸碱滴定法的应用 5.10非水溶液酸碱滴定简介
1 5.1 溶液中的酸碱反应与平衡 5.2 酸碱组分平衡浓度与分布分数 5.3 溶液中的H+浓度计算 5.4 对数图解法 5.5 酸碱缓冲溶液 5.6 酸碱指示剂 5.7 酸碱滴定原理 5.8 终点误差 5.9 酸碱滴定法的应用 5.10 非水溶液酸碱滴定简介 第五章 酸碱平衡与酸碱滴定法 (acid-base equilibrium and titration)
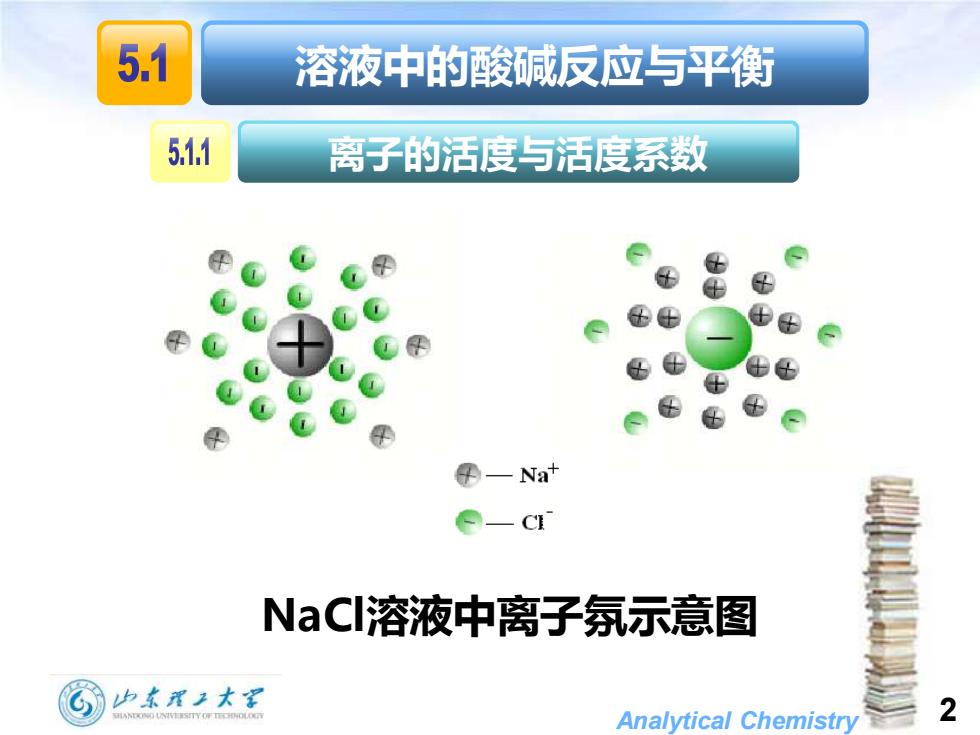
5.1 溶液中的酸碱反应与平衡 511 离子的活度与活度系数 ⊕ 配 ⊕ 配 母—Nat Q一C NaCI溶液中离子氛示意图 加东理2大深 Analytical Chemistry 2
Analytical Chemistry 2 溶液中的酸碱反应与平衡 NaCl溶液中离子氛示意图 离子的活度与活度系数

强电解质的离解: 1、表观电离度 由于离子间的相互作用,电离度小于100%。 0.01mol/LKC1(25℃) 86% 2、活度activity (有效浓度) c::某一离子的平衡浓度 0;=hC 片:某一离子的活度系数 一般,%<1:<c: 溶液无限稀时:=1 中性分子:y=1 山东理工大军 Analytical Chemistry 3
Analytical Chemistry 3 一、强电解质的离解: 1、表观电离度 0.01 mol/L KCl (25℃) 86% 由于离子间的相互作用,电离度小于100% 。 2、活度activity (有效浓度) ci:某一离子的平衡浓度 i:某一离子的活度系数 一般, i<1 ai <c i ai = i ci 溶液无限稀时: i =1 中性分子: i=1

3、活度系数: 德拜-休克尔(Debye-Huickel)公式(稀溶液c<0.1mol/L) -lg=0.512z2. i 1+Ba√I I:离子强度,=1/2∑cZ, 2:离子电荷; B:常数,(=0.0032825℃),与温度、介电常数有关; i:离子体积参数(pm),约为水化半径。 山东理子大军 Analytical Chemistry 4
Analytical Chemistry 4 3、活度系数: 德拜-休克尔(Debye-Hückel)公式(稀溶液 c<0.1 mol/L) -lgi=0.512zi 2 I 1+Bå I I:离子强度, I=1/2∑ciZi 2 , zi:离子电荷; B: 常数, (=0.00328 25℃), 与温度、介电常数有关; å:离子体积参数(pm),约为水化半径
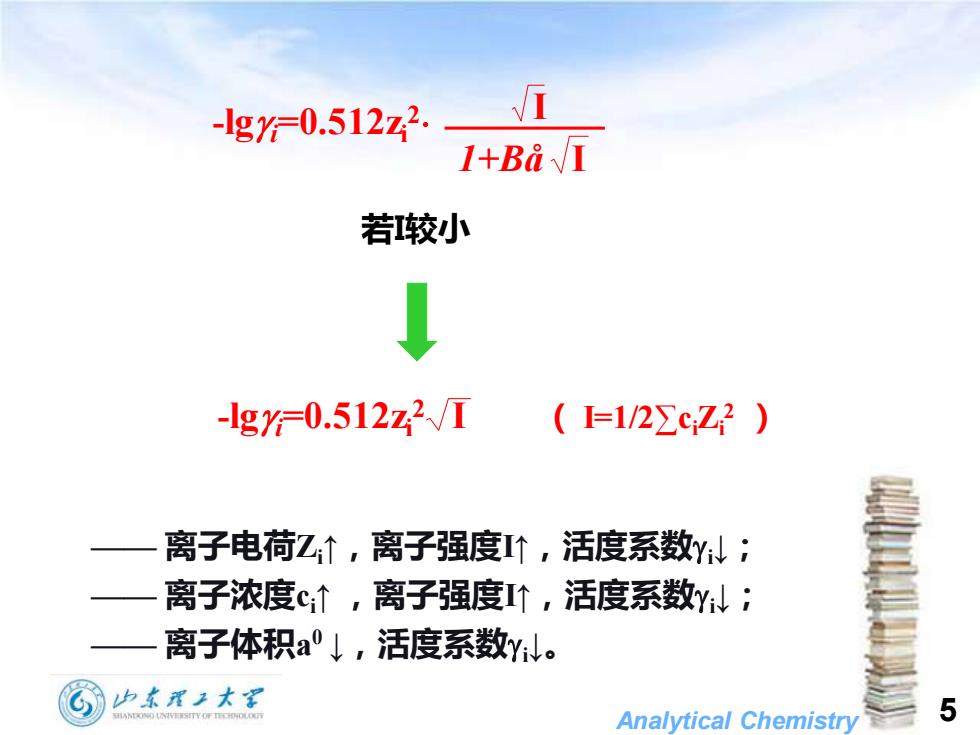
-lgy=0.512z2. 1+BaI 若较小 ↓ -lg=0.512z2/I (=1/2∑cZ2) 离子电荷乙↑,离子强度个,活度系数YN: 离子浓度c↑,离子强度个,活度系数Y: 离子体积a°↓,活度系数y小。 山东理2大军 Analytical Chemistry 5
Analytical Chemistry 5 —— 离子电荷Zi↑,离子强度I↑,活度系数i↓; —— 离子浓度ci↑ ,离子强度I↑,活度系数i↓; —— 离子体积a 0 ↓,活度系数i↓。 若I较小 -lgi=0.512zi 2 I 1+Bå I -lgi=0.512zi 2 I ( I=1/2∑ciZi 2 )