
§1.6滴定分析法(titrimetry) 概述 一、 滴定分析法及其方法分类 1、滴定分析法几个基本概念 1)滴定分析法:将一种已知准 确浓度的试剂溶液(标准溶液) 滴加到待测物质的溶液中,直到 所滴加的试剂与待测物质按化学 计量关系定量反应为止,然后根 据试剂的浓度和体积,通过定量 关系计算待测物质含量的方法
1 §1.6 滴定分析法(titrimetry)概述 一、滴定分析法及其方法分类 1、滴定分析法几个基本概念 1)滴定分析法:将一种已知准 确浓度的试剂溶液(标准溶液) 滴加到待测物质的溶液中,直到 所滴加的试剂与待测物质按化学 计量关系定量反应为止,然后根 据试剂的浓度和体积,通过定量 关系计算待测物质含量的方法

2)标准溶液: 已知准确浓度的试剂溶液。 3)滴定剂: 盛装于滴定管中用于滴定分析的标准溶液。 4)滴定(titration) g 将滴定剂通过滴管滴入待测溶液中的操作过程。 滴定分析法因此而得名。 5)化学计量点(stoichiometric point,sp) 滴定剂与待测溶液按化学计量关系反应完全的 那一点(理论点)。可简称计量点(sp)
2 2)标准溶液: 已知准确浓度的试剂溶液。 3)滴定剂: 盛装于滴定管中用于滴定分析的标准溶液。 4)滴定(titration): 将滴定剂通过滴管滴入待测溶液中的操作过程。 滴定分析法因此而得名。 5)化学计量点(stoichiometric point,sp): 滴定剂与待测溶液按化学计量关系反应完全的 那一点(理论点)。可简称 计量点(sp)

6)指示剂(indicator,ln): 滴定分析中能发生颜色改变而指示终点的试剂。 7)滴定终点(end point,.ep): 滴定分析中指示剂发生颜色改变而停止滴定 的那一点(实际点)—指示剂变色点 8)滴定误差(titration error,TE) 滴定终点与化学计量点不一致造成的误差。 3
3 6)指示剂(indicator,In): 滴定分析中能发生颜色改变而指示终点的试剂。 7)滴定终点(end point,ep): 滴定分析中指示剂发生颜色改变而停止滴定 的那一点(实际点)——指示剂变色点 8)滴定误差(titration error,TE) 滴定终点与化学计量点不一致造成的误差
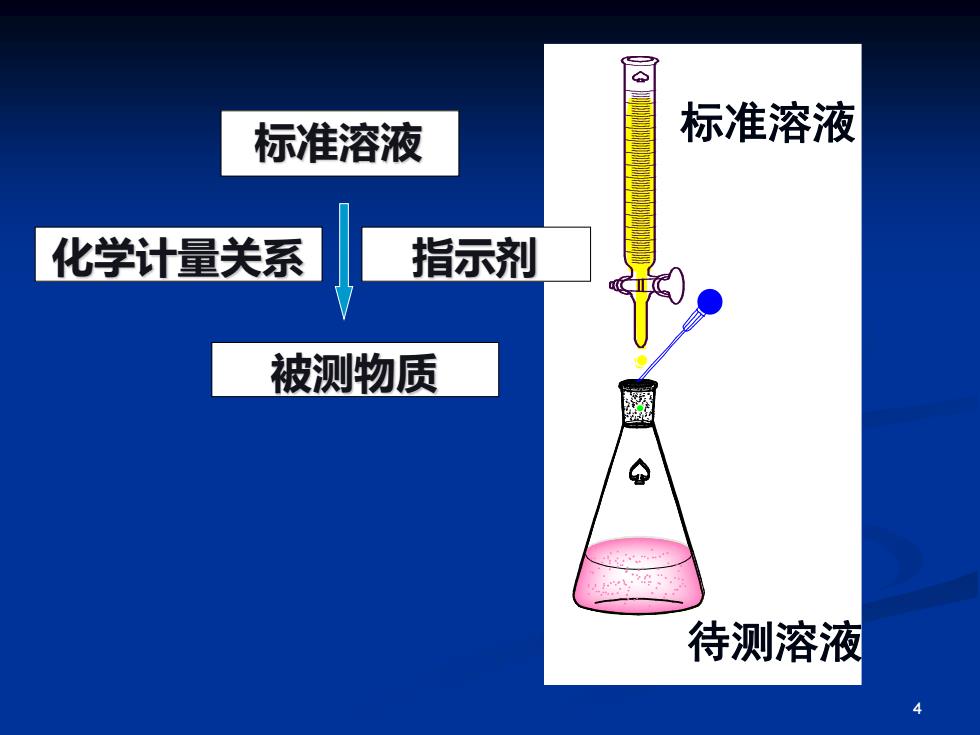
标准溶液 标准溶液 化学计量关系 指示剂 被测物质 金 待测溶液 4
4 标准溶液 化学计量关系 指示剂 被测物质 标准溶液 待测溶液

2、滴定分析法分类 1)酸碱滴定法: 以酸碱平衡为基础的滴定方法。 NaOH+HCI NaCH+H2O 2)络合滴定法:以络合平衡为基础的滴定方法。 Y4-+Ca 2+=CaY2- 3)氧化还原滴定法:以氧化还原平衡为基础的滴定方法 MnO+5Fe2++8H+=Mn2++5Fe3++8H2O 4)沉淀滴定法:利用沉淀反应进行滴定的方法。 AgNO3+NaCl=AgCI +NaNO3 5
5 2、滴定分析法分类 1)酸碱滴定法:以酸碱平衡为基础的滴定方法。 NaOH+HCl = NaCl+H2O 2)络合滴定法:以络合平衡为基础的滴定方法。 Y4-+Ca 2+ = CaY2- 3)氧化还原滴定法:以氧化还原平衡为基础的滴定方法。 MnO4 -+5Fe2++8H+ =Mn2+ +5Fe3++8H2O 4)沉淀滴定法:利用沉淀反应进行滴定的方法。 AgNO3+NaCl=AgCl ↓+NaNO3