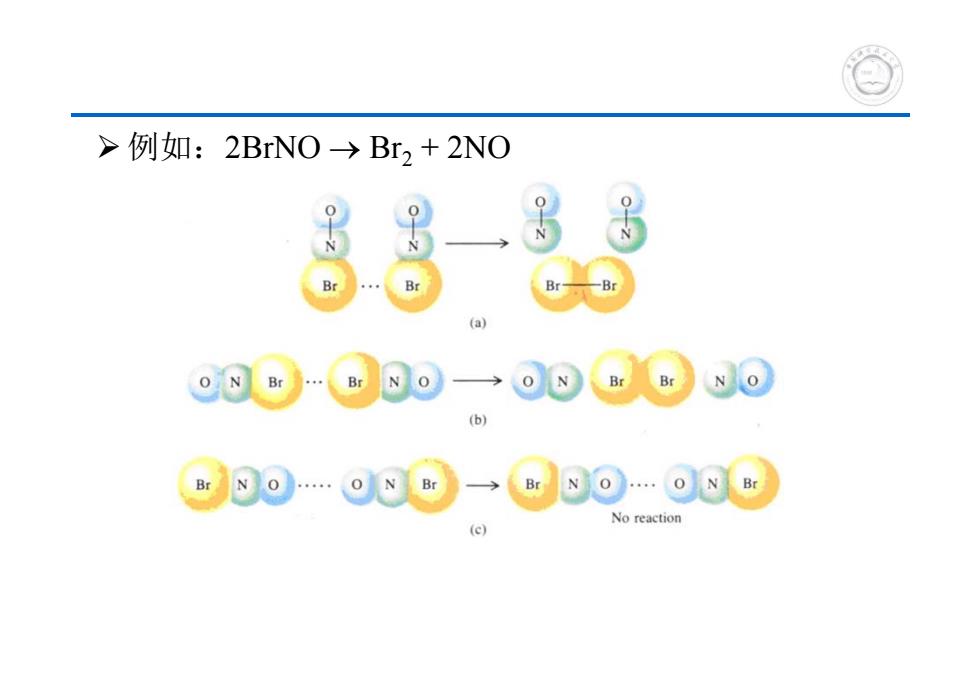
>例如:2BNO→Br2+2NO Br 8o→⊙8rN⊙ (b) 9o.o8@→e@8o.o8 No reaction (c)
例如:2BrNO Br2 + 2NO

(2)活化能(activation energy)Ea:活化分子所具有的能量 √Arrhenius,.由非活化分子转变为活化分子所需的能量 √Lewis,完成化学反应最小的、必须的能量 √Tolman,活化分子的平均能量与全部反应物分子平均 能量之差 √一般化学反应的E,值:40~400 kJ-mol-1 >化学反应速率与活化能: √降低反应活化能可显著提高反应速率 >化学反应速率与活化分子: √增大活化分子分数可提高反应速率 >影响反应速率的因素:温度,浓度或压力,催化剂
(2) 活化能 (activation energy) Ea :活化分子所具有的能量 Arrhenius,由非活化分子转变为活化分子所需的能量 Lewis,完成化学反应最小的、必须的能量 Tolman,活化分子的平均能量与全部反应物分子平均 能量之差 一般化学反应的Ea值:40~400 kJmol1 化学反应速率与活化能: 降低反应活化能可显著提高反应速率 化学反应速率与活化分子: 增大活化分子分数可提高反应速率 影响反应速率的因素:温度,浓度或压力,催化剂

(3)过渡态理论((transition state theory) 反应物台活化络合物→产物 >活化络合物(activated complex):反应进行时,反应物 分子首先形成一种中间过渡状态的物质 例:A+B-C[A.B.C]→A-B+C ·活化络合物中,反应物分子中旧键B.C已经松弛, 产物分子中新键A.B初步形成 ·活化络合物分子是不稳定的 ·活化络合物分子的位能高于反应物分子及产物分子 >活化能:活化络合物平均能量与反应物平均能量之差
(3) 过渡态理论 (transition state theory) 活化络合物 (activated complex):反应进行时,反应物 分子首先形成一种中间过渡状态的物质 例:A + BC [A.B.C] AB + C • 活化络合物中,反应物分子中旧键B.C已经松弛, 产物分子中新键A.B初步形成 • 活化络合物分子是不稳定的 • 活化络合物分子的位能高于反应物分子及产物分子 活化能:活化络合物平均能量与反应物平均能量之差 反应物 活化络合物 →产物