
《发酵工程及设备》 实验指导书 (适用专业:生物工程) 2005 年 4 月 目 录 实验一 土壤中产醋酸菌种的分离筛选.1 实验二 紫外线的诱变育种.2 实验三 摇床培养确定酵母菌体培养和营养条件.3 实验四 细菌增殖曲线的测定.4 实验五 木霉 T6 淀粉酶的固态发酵实验.6 实验六 小型连续发酵实验.9 实验七 啤酒麦芽汁制备实验.11 实验八 啤酒的酿造.14
《发酵工程及设备》 实验指导书 (适用专业:生物工程) 2005 年 4 月 目 录 实验一 土壤中产醋酸菌种的分离筛选.1 实验二 紫外线的诱变育种.2 实验三 摇床培养确定酵母菌体培养和营养条件.3 实验四 细菌增殖曲线的测定.4 实验五 木霉 T6 淀粉酶的固态发酵实验.6 实验六 小型连续发酵实验.9 实验七 啤酒麦芽汁制备实验.11 实验八 啤酒的酿造.14

实验九 啤酒风味保鲜期的测定.15 实验十 反应器的安装与拆卸.16 实验十一 pH 电极的校正.17 实验十二 氧电极的校正.19 实验十三 体积溶氧传递系数的测定.21 实验十四 反应器培养液的灭菌与接种培养.23 实验十五 气升式生化反应器的使用.24 实验十六 中试发酵设备的使用方法.25 实验十七 补料分批发酵动力学研究.27 实验一 土壤中产醋酸菌种的分离筛选 一.实验目的: 1.根据一定的生产目的如抗生素或酶类的生产,建立不同的筛选模型,并从特定的样 品如土壤中筛选出高产适宜的菌株。 2.加深对发酵工程上游技术中菌种选育的认识;学会常规选种和育种的方法,树立科 学认真仔细的态度,培养科研协作精神。 二.基本原理: 分离上样中的大部分细菌的分离程序中无需进行富集,但对某些少数细菌则要求特殊的 富集或选择技术才能很好地被分离培养。运用细菌的酶诱导性,在分离培养基中添加若干抗 生素、复杂底物及生长因子的前体物质来激活细菌某一特殊基因组,可以建立若干富集技术。 同样,富集可以促进抗性的产生并维持下来。 三.培养基与仪器 1.培养基: 牛肉膏蛋白胨培养基 2.仪器:全自动高压灭菌锅,培养箱,酸式滴定管 四.实验步骤 1. 确定方案:首先查阅资料,了解所需菌种的生长培养特性。 2. 采样:选取离地面 5~15 cm 处的土,用小铲子取样,将采集到的土样盛入聚乙烯袋 或玻璃瓶中。 3. 增殖:称取 0.5g 土样(湿重),加到含 10ml 25%无菌土样浸出汁的试管中,于 26℃、 150rpm 条件下振荡培养 25min,以适宜的样本稀释液系列稀释培养液。然后取 0.1 m1 涂布 于已添加及未添加富集底物的土浸出汁平板。26℃下皿底朝上培养 4—10 天,将长出的菌落
实验九 啤酒风味保鲜期的测定.15 实验十 反应器的安装与拆卸.16 实验十一 pH 电极的校正.17 实验十二 氧电极的校正.19 实验十三 体积溶氧传递系数的测定.21 实验十四 反应器培养液的灭菌与接种培养.23 实验十五 气升式生化反应器的使用.24 实验十六 中试发酵设备的使用方法.25 实验十七 补料分批发酵动力学研究.27 实验一 土壤中产醋酸菌种的分离筛选 一.实验目的: 1.根据一定的生产目的如抗生素或酶类的生产,建立不同的筛选模型,并从特定的样 品如土壤中筛选出高产适宜的菌株。 2.加深对发酵工程上游技术中菌种选育的认识;学会常规选种和育种的方法,树立科 学认真仔细的态度,培养科研协作精神。 二.基本原理: 分离上样中的大部分细菌的分离程序中无需进行富集,但对某些少数细菌则要求特殊的 富集或选择技术才能很好地被分离培养。运用细菌的酶诱导性,在分离培养基中添加若干抗 生素、复杂底物及生长因子的前体物质来激活细菌某一特殊基因组,可以建立若干富集技术。 同样,富集可以促进抗性的产生并维持下来。 三.培养基与仪器 1.培养基: 牛肉膏蛋白胨培养基 2.仪器:全自动高压灭菌锅,培养箱,酸式滴定管 四.实验步骤 1. 确定方案:首先查阅资料,了解所需菌种的生长培养特性。 2. 采样:选取离地面 5~15 cm 处的土,用小铲子取样,将采集到的土样盛入聚乙烯袋 或玻璃瓶中。 3. 增殖:称取 0.5g 土样(湿重),加到含 10ml 25%无菌土样浸出汁的试管中,于 26℃、 150rpm 条件下振荡培养 25min,以适宜的样本稀释液系列稀释培养液。然后取 0.1 m1 涂布 于已添加及未添加富集底物的土浸出汁平板。26℃下皿底朝上培养 4—10 天,将长出的菌落
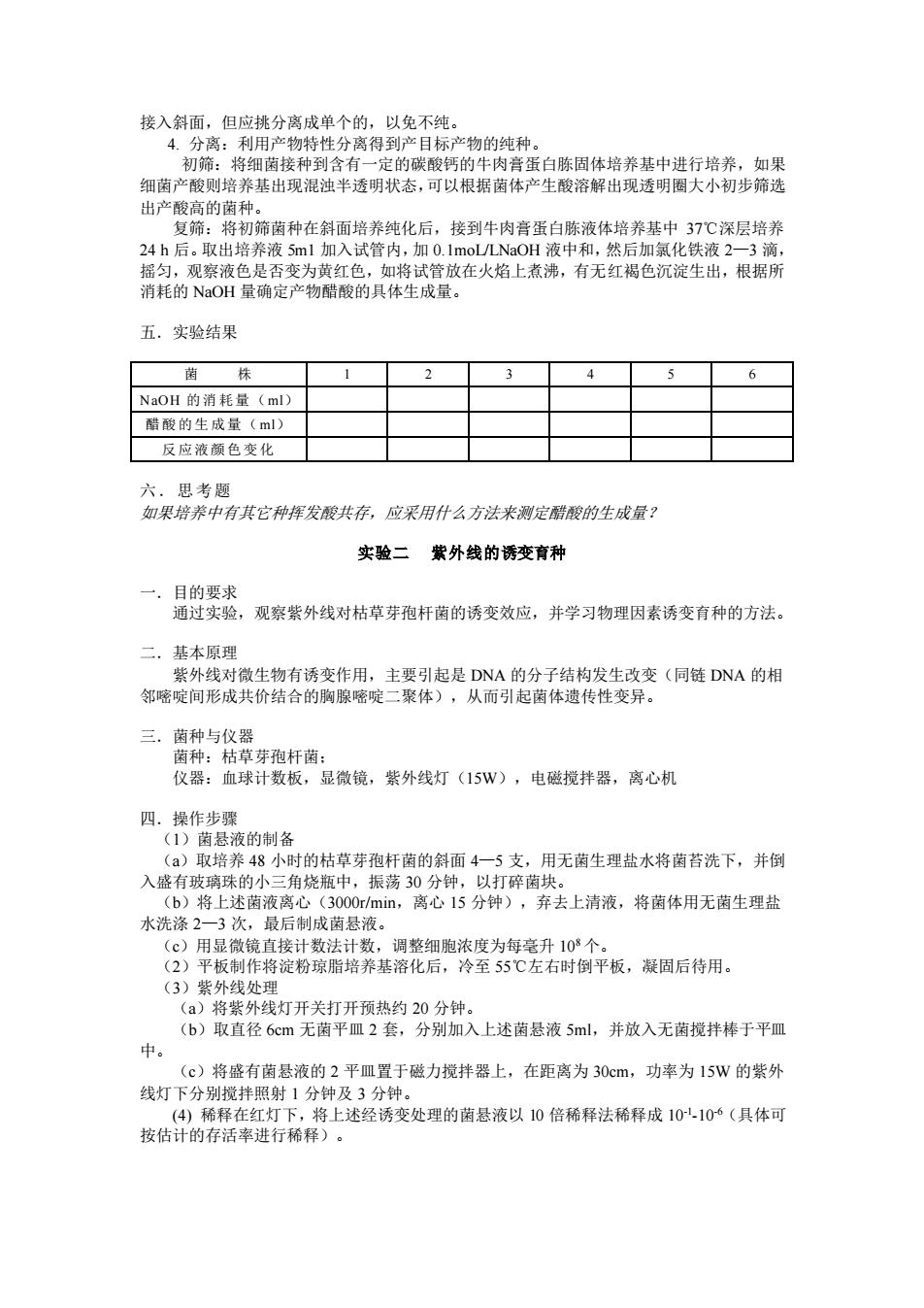
接入斜面,但应挑分离成单个的,以免不纯。 4. 分离:利用产物特性分离得到产目标产物的纯种。 初筛:将细菌接种到含有一定的碳酸钙的牛肉膏蛋白胨固体培养基中进行培养,如果 细菌产酸则培养基出现混浊半透明状态,可以根据菌体产生酸溶解出现透明圈大小初步筛选 出产酸高的菌种。 复筛:将初筛菌种在斜面培养纯化后,接到牛肉膏蛋白胨液体培养基中 37℃深层培养 24 h 后。取出培养液 5m1 加入试管内,加 0.1moL/LNaOH 液中和,然后加氯化铁液 2—3 滴, 摇匀,观察液色是否变为黄红色,如将试管放在火焰上煮沸,有无红褐色沉淀生出,根据所 消耗的 NaOH 量确定产物醋酸的具体生成量。 五.实验结果 菌 株 1 2 3 4 5 6 NaOH 的消耗量(ml) 醋酸的生成量(ml) 反应液颜色变化 六.思考题 如果培养中有其它种挥发酸共存,应采用什么方法来测定醋酸的生成量? 实验二 紫外线的诱变育种 一.目的要求 通过实验,观察紫外线对枯草芽孢杆菌的诱变效应,并学习物理因素诱变育种的方法。 二.基本原理 紫外线对微生物有诱变作用,主要引起是 DNA 的分子结构发生改变(同链 DNA 的相 邻嘧啶间形成共价结合的胸腺嘧啶二聚体),从而引起菌体遗传性变异。 三.菌种与仪器 菌种:枯草芽孢杆菌; 仪器:血球计数板,显微镜,紫外线灯(15W),电磁搅拌器,离心机 四.操作步骤 (1)菌悬液的制备 (a)取培养 48 小时的枯草芽孢杆菌的斜面 4—5 支,用无菌生理盐水将菌苔洗下,并倒 入盛有玻璃珠的小三角烧瓶中,振荡 30 分钟,以打碎菌块。 (b)将上述菌液离心(3000r/min,离心 15 分钟),弃去上清液,将菌体用无菌生理盐 水洗涤 2—3 次,最后制成菌悬液。 (c)用显微镜直接计数法计数,调整细胞浓度为每毫升 108 个。 (2)平板制作将淀粉琼脂培养基溶化后,冷至 55℃左右时倒平板,凝固后待用。 (3)紫外线处理 (a)将紫外线灯开关打开预热约 20 分钟。 (b)取直径 6cm 无菌平皿 2 套,分别加入上述菌悬液 5ml,并放入无菌搅拌棒于平皿 中。 (c)将盛有菌悬液的 2 平皿置于磁力搅拌器上,在距离为 30cm,功率为 15W 的紫外 线灯下分别搅拌照射 1 分钟及 3 分钟。 (4) 稀释在红灯下,将上述经诱变处理的菌悬液以 10 倍稀释法稀释成 10-1 -10-6(具体可 按估计的存活率进行稀释)
接入斜面,但应挑分离成单个的,以免不纯。 4. 分离:利用产物特性分离得到产目标产物的纯种。 初筛:将细菌接种到含有一定的碳酸钙的牛肉膏蛋白胨固体培养基中进行培养,如果 细菌产酸则培养基出现混浊半透明状态,可以根据菌体产生酸溶解出现透明圈大小初步筛选 出产酸高的菌种。 复筛:将初筛菌种在斜面培养纯化后,接到牛肉膏蛋白胨液体培养基中 37℃深层培养 24 h 后。取出培养液 5m1 加入试管内,加 0.1moL/LNaOH 液中和,然后加氯化铁液 2—3 滴, 摇匀,观察液色是否变为黄红色,如将试管放在火焰上煮沸,有无红褐色沉淀生出,根据所 消耗的 NaOH 量确定产物醋酸的具体生成量。 五.实验结果 菌 株 1 2 3 4 5 6 NaOH 的消耗量(ml) 醋酸的生成量(ml) 反应液颜色变化 六.思考题 如果培养中有其它种挥发酸共存,应采用什么方法来测定醋酸的生成量? 实验二 紫外线的诱变育种 一.目的要求 通过实验,观察紫外线对枯草芽孢杆菌的诱变效应,并学习物理因素诱变育种的方法。 二.基本原理 紫外线对微生物有诱变作用,主要引起是 DNA 的分子结构发生改变(同链 DNA 的相 邻嘧啶间形成共价结合的胸腺嘧啶二聚体),从而引起菌体遗传性变异。 三.菌种与仪器 菌种:枯草芽孢杆菌; 仪器:血球计数板,显微镜,紫外线灯(15W),电磁搅拌器,离心机 四.操作步骤 (1)菌悬液的制备 (a)取培养 48 小时的枯草芽孢杆菌的斜面 4—5 支,用无菌生理盐水将菌苔洗下,并倒 入盛有玻璃珠的小三角烧瓶中,振荡 30 分钟,以打碎菌块。 (b)将上述菌液离心(3000r/min,离心 15 分钟),弃去上清液,将菌体用无菌生理盐 水洗涤 2—3 次,最后制成菌悬液。 (c)用显微镜直接计数法计数,调整细胞浓度为每毫升 108 个。 (2)平板制作将淀粉琼脂培养基溶化后,冷至 55℃左右时倒平板,凝固后待用。 (3)紫外线处理 (a)将紫外线灯开关打开预热约 20 分钟。 (b)取直径 6cm 无菌平皿 2 套,分别加入上述菌悬液 5ml,并放入无菌搅拌棒于平皿 中。 (c)将盛有菌悬液的 2 平皿置于磁力搅拌器上,在距离为 30cm,功率为 15W 的紫外 线灯下分别搅拌照射 1 分钟及 3 分钟。 (4) 稀释在红灯下,将上述经诱变处理的菌悬液以 10 倍稀释法稀释成 10-1 -10-6(具体可 按估计的存活率进行稀释)
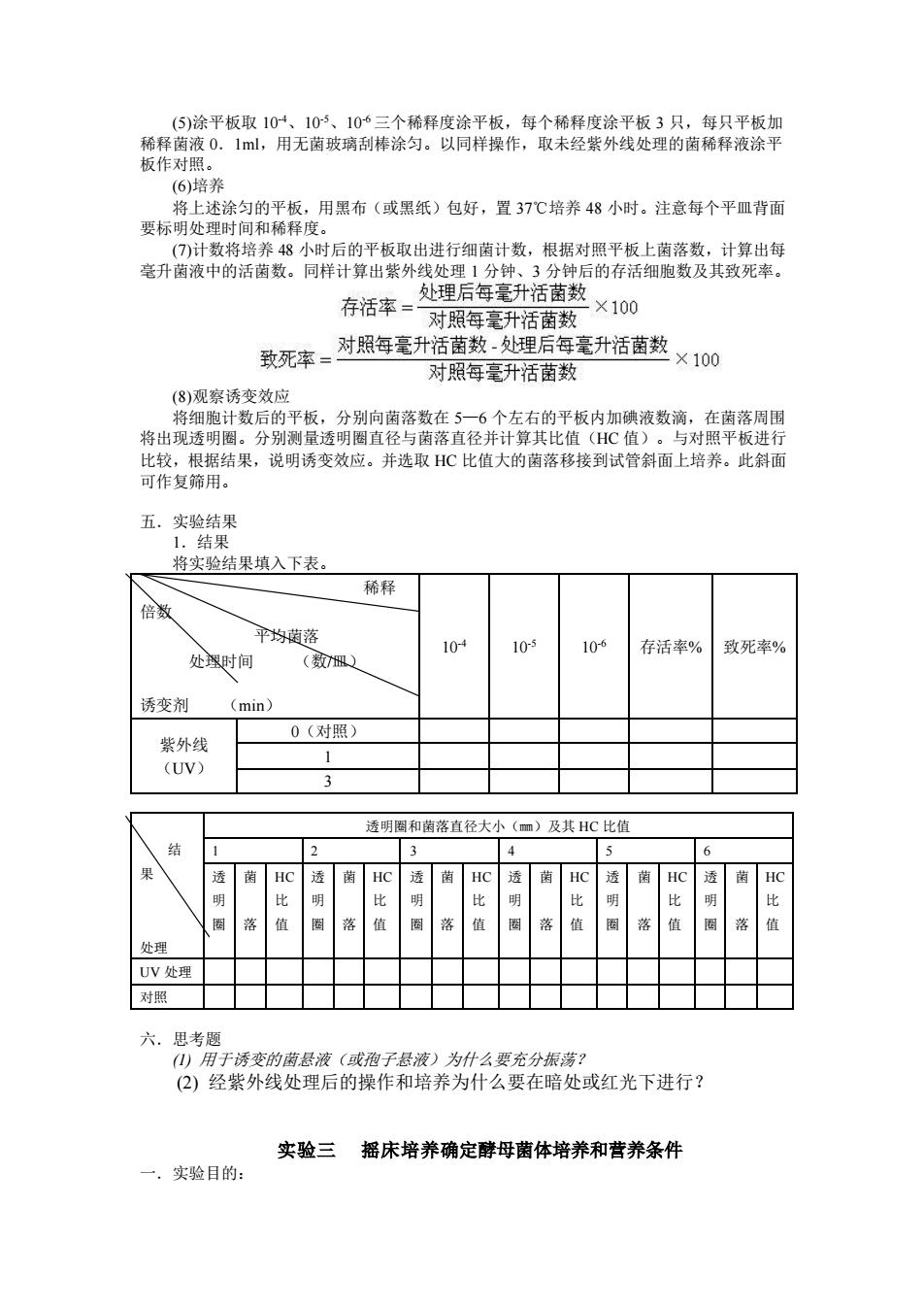
(5)涂平板取 10-4、10-5、10-6 三个稀释度涂平板,每个稀释度涂平板 3 只,每只平板加 稀释菌液 0.1ml,用无菌玻璃刮棒涂匀。以同样操作,取未经紫外线处理的菌稀释液涂平 板作对照。 (6)培养 将上述涂匀的平板,用黑布(或黑纸)包好,置 37℃培养 48 小时。注意每个平皿背面 要标明处理时间和稀释度。 (7)计数将培养 48 小时后的平板取出进行细菌计数,根据对照平板上菌落数,计算出每 毫升菌液中的活菌数。同样计算出紫外线处理 1 分钟、3 分钟后的存活细胞数及其致死率。 (8)观察诱变效应 将细胞计数后的平板,分别向菌落数在 5—6 个左右的平板内加碘液数滴,在菌落周围 将出现透明圈。分别测量透明圈直径与菌落直径并计算其比值(HC 值)。与对照平板进行 比较,根据结果,说明诱变效应。并选取 HC 比值大的菌落移接到试管斜面上培养。此斜面 可作复筛用。 五.实验结果 1.结果 将实验结果填入下表。 稀释 倍数 平均菌落 处理时间 (数/皿) 诱变剂 (min) 10-4 10-5 10-6 存活率% 致死率% 紫外线 (UV) 0(对照) 1 3 结 果 处理 透明圈和菌落直径大小(㎜)及其 HC 比值 1 2 3 4 5 6 透 明 圈 菌 落 HC 比 值 透 明 圈 菌 落 HC 比 值 透 明 圈 菌 落 HC 比 值 透 明 圈 菌 落 HC 比 值 透 明 圈 菌 落 HC 比 值 透 明 圈 菌 落 HC 比 值 UV 处理 对照 六.思考题 (1) 用于诱变的菌悬液(或孢子悬液)为什么要充分振荡? (2) 经紫外线处理后的操作和培养为什么要在暗处或红光下进行? 实验三 摇床培养确定酵母菌体培养和营养条件 一.实验目的:
(5)涂平板取 10-4、10-5、10-6 三个稀释度涂平板,每个稀释度涂平板 3 只,每只平板加 稀释菌液 0.1ml,用无菌玻璃刮棒涂匀。以同样操作,取未经紫外线处理的菌稀释液涂平 板作对照。 (6)培养 将上述涂匀的平板,用黑布(或黑纸)包好,置 37℃培养 48 小时。注意每个平皿背面 要标明处理时间和稀释度。 (7)计数将培养 48 小时后的平板取出进行细菌计数,根据对照平板上菌落数,计算出每 毫升菌液中的活菌数。同样计算出紫外线处理 1 分钟、3 分钟后的存活细胞数及其致死率。 (8)观察诱变效应 将细胞计数后的平板,分别向菌落数在 5—6 个左右的平板内加碘液数滴,在菌落周围 将出现透明圈。分别测量透明圈直径与菌落直径并计算其比值(HC 值)。与对照平板进行 比较,根据结果,说明诱变效应。并选取 HC 比值大的菌落移接到试管斜面上培养。此斜面 可作复筛用。 五.实验结果 1.结果 将实验结果填入下表。 稀释 倍数 平均菌落 处理时间 (数/皿) 诱变剂 (min) 10-4 10-5 10-6 存活率% 致死率% 紫外线 (UV) 0(对照) 1 3 结 果 处理 透明圈和菌落直径大小(㎜)及其 HC 比值 1 2 3 4 5 6 透 明 圈 菌 落 HC 比 值 透 明 圈 菌 落 HC 比 值 透 明 圈 菌 落 HC 比 值 透 明 圈 菌 落 HC 比 值 透 明 圈 菌 落 HC 比 值 透 明 圈 菌 落 HC 比 值 UV 处理 对照 六.思考题 (1) 用于诱变的菌悬液(或孢子悬液)为什么要充分振荡? (2) 经紫外线处理后的操作和培养为什么要在暗处或红光下进行? 实验三 摇床培养确定酵母菌体培养和营养条件 一.实验目的:
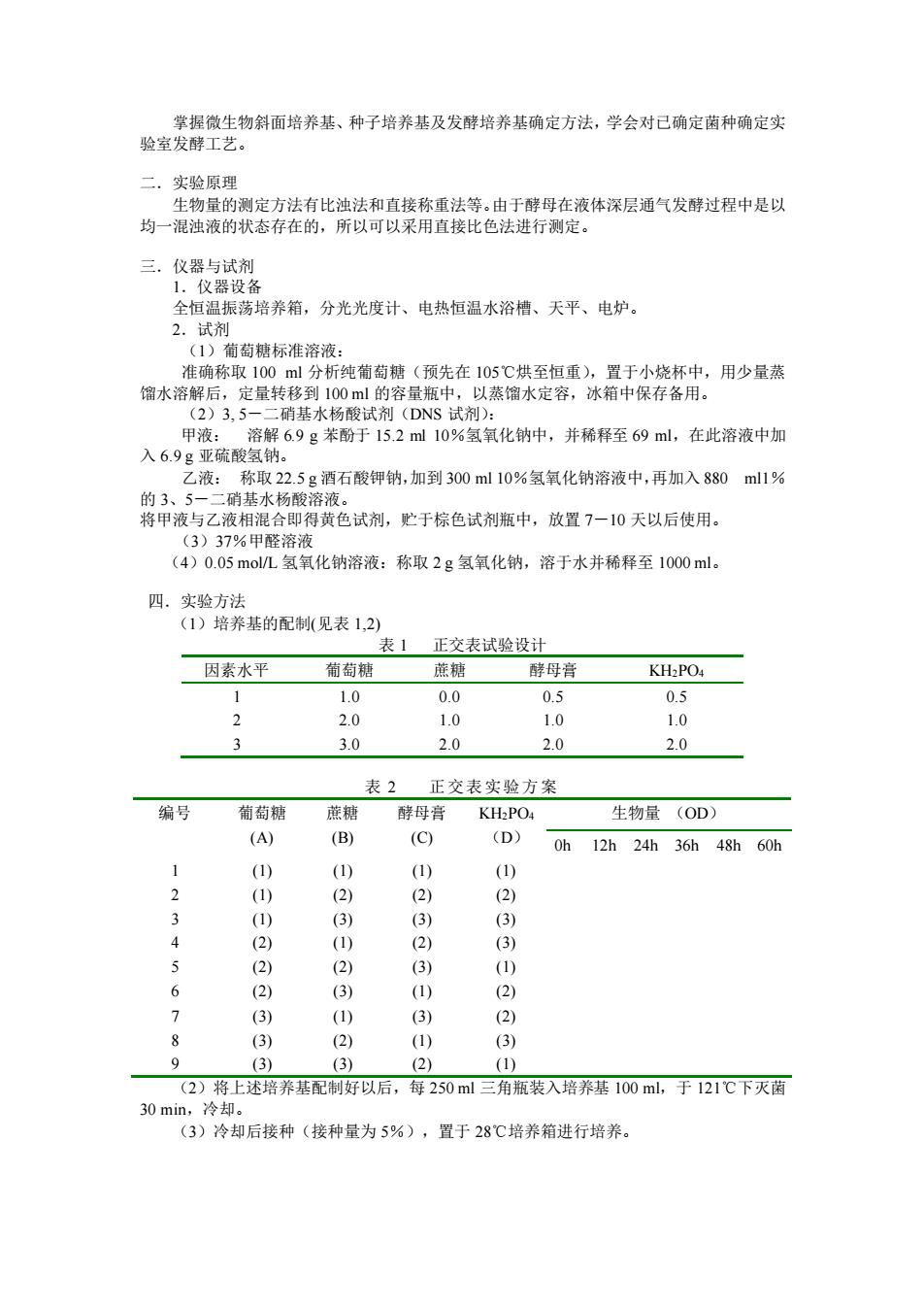
掌握微生物斜面培养基、种子培养基及发酵培养基确定方法,学会对已确定菌种确定实 验室发酵工艺。 二.实验原理 生物量的测定方法有比浊法和直接称重法等。由于酵母在液体深层通气发酵过程中是以 均一混浊液的状态存在的,所以可以采用直接比色法进行测定。 三.仪器与试剂 1.仪器设备 全恒温振荡培养箱,分光光度计、电热恒温水浴槽、天平、电炉。 2.试剂 (1)葡萄糖标准溶液: 准确称取 100 ml 分析纯葡萄糖(预先在 105℃烘至恒重),置于小烧杯中,用少量蒸 馏水溶解后,定量转移到 100 ml 的容量瓶中,以蒸馏水定容,冰箱中保存备用。 (2)3, 5-二硝基水杨酸试剂(DNS 试剂): 甲液: 溶解 6.9 g 苯酚于 15.2 ml 10%氢氧化钠中,并稀释至 69 ml,在此溶液中加 入 6.9 g 亚硫酸氢钠。 乙液: 称取 22.5 g 酒石酸钾钠,加到 300 ml 10%氢氧化钠溶液中,再加入 880 ml1% 的 3、5-二硝基水杨酸溶液。 将甲液与乙液相混合即得黄色试剂,贮于棕色试剂瓶中,放置 7-10 天以后使用。 (3)37%甲醛溶液 (4)0.05 mol/L 氢氧化钠溶液:称取 2 g 氢氧化钠,溶于水并稀释至 1000 ml。 四.实验方法 (1)培养基的配制(见表 1,2) 表 1 正交表试验设计 因素水平 葡萄糖 蔗糖 酵母膏 KH2PO4 1 1.0 0.0 0.5 0.5 2 2.0 1.0 1.0 1.0 3 3.0 2.0 2.0 2.0 表 2 正交表实验方案 编号 葡萄糖 (A) 蔗糖 (B) 酵母膏 (C) KH2PO4 (D) 生物量 (OD) 0h 12h 24h 36h 48h 60h 1 (1) (1) (1) (1) 2 (1) (2) (2) (2) 3 (1) (3) (3) (3) 4 (2) (1) (2) (3) 5 (2) (2) (3) (1) 6 (2) (3) (1) (2) 7 (3) (1) (3) (2) 8 (3) (2) (1) (3) 9 (3) (3) (2) (1) (2)将上述培养基配制好以后,每 250 ml 三角瓶装入培养基 100 ml,于 121℃下灭菌 30 min,冷却。 (3)冷却后接种(接种量为 5%),置于 28℃培养箱进行培养
掌握微生物斜面培养基、种子培养基及发酵培养基确定方法,学会对已确定菌种确定实 验室发酵工艺。 二.实验原理 生物量的测定方法有比浊法和直接称重法等。由于酵母在液体深层通气发酵过程中是以 均一混浊液的状态存在的,所以可以采用直接比色法进行测定。 三.仪器与试剂 1.仪器设备 全恒温振荡培养箱,分光光度计、电热恒温水浴槽、天平、电炉。 2.试剂 (1)葡萄糖标准溶液: 准确称取 100 ml 分析纯葡萄糖(预先在 105℃烘至恒重),置于小烧杯中,用少量蒸 馏水溶解后,定量转移到 100 ml 的容量瓶中,以蒸馏水定容,冰箱中保存备用。 (2)3, 5-二硝基水杨酸试剂(DNS 试剂): 甲液: 溶解 6.9 g 苯酚于 15.2 ml 10%氢氧化钠中,并稀释至 69 ml,在此溶液中加 入 6.9 g 亚硫酸氢钠。 乙液: 称取 22.5 g 酒石酸钾钠,加到 300 ml 10%氢氧化钠溶液中,再加入 880 ml1% 的 3、5-二硝基水杨酸溶液。 将甲液与乙液相混合即得黄色试剂,贮于棕色试剂瓶中,放置 7-10 天以后使用。 (3)37%甲醛溶液 (4)0.05 mol/L 氢氧化钠溶液:称取 2 g 氢氧化钠,溶于水并稀释至 1000 ml。 四.实验方法 (1)培养基的配制(见表 1,2) 表 1 正交表试验设计 因素水平 葡萄糖 蔗糖 酵母膏 KH2PO4 1 1.0 0.0 0.5 0.5 2 2.0 1.0 1.0 1.0 3 3.0 2.0 2.0 2.0 表 2 正交表实验方案 编号 葡萄糖 (A) 蔗糖 (B) 酵母膏 (C) KH2PO4 (D) 生物量 (OD) 0h 12h 24h 36h 48h 60h 1 (1) (1) (1) (1) 2 (1) (2) (2) (2) 3 (1) (3) (3) (3) 4 (2) (1) (2) (3) 5 (2) (2) (3) (1) 6 (2) (3) (1) (2) 7 (3) (1) (3) (2) 8 (3) (2) (1) (3) 9 (3) (3) (2) (1) (2)将上述培养基配制好以后,每 250 ml 三角瓶装入培养基 100 ml,于 121℃下灭菌 30 min,冷却。 (3)冷却后接种(接种量为 5%),置于 28℃培养箱进行培养