
第5章化学动力学基础 5.1二甲(CHh0分解为甲烷、氢和一氧化碳的反应的动力学实验数据如下 t/s 0 200 400 600 800 C[(CHh0 mol-dm-30.010000.009160.008390.007680.00703 1)600s和800s间的平均速率. 0.010 0.009 200 X=800时,y=0.00703,800s时的 r=0.00703=878×10-6mol·dn-3:s-1 答:60s和80s间的¥均速率是325x10-m0l·dn3.g (2)800s的瞬间速率为878×10-6mol·dm-3·s 52在970K下,反应2N,O(gN2(g+O(g)起始时N,0的压力为2.9310Pa,并测得反应过 程中系绕的总压变化如下表所示: s 30090020004000 p总)10Pa3.333.633.934.14 求最初300s与最后2000s的时间间隔内的平均速。 解:最初300s内的平均速率 A P -3332.93kPa =13.33Pa·s 300s 最后200s的时间间隔内 =-P-44383=105s 答:最初300内的平均速率是133P·s-,最后200s的时间间隔内平均速率是105P内·s-。 5.3在600K下反应2NO+O,=2NO
第 5 章化学动力学基础 5.1 二甲醚(CH3)2O 分解为甲烷、氢和一氧化碳的反应的动力学实验数据如下: t/s 0 200 400 600 800 C[(CH3)2O]/mol∙ dm-3 0.01000 0.00916 0.00839 0.00768 0.00703 (1)600s 和 800s 间的平均速率。 X=800 时,y=0.00703,800s 时的 r= =8.78×10-6 mol·dm -3·s-1 答: (1)600s 和 800s 间的平均速率是 3.25×10-6 mol·dm -3·s-1 (2)800s 的瞬间速率为 8.78×10-6 mol·dm-3·s-1 5.2 在 970K 下,反应 2N2O(g)=N2(g)+O2(g).起始时 N2O 的压力为 2.93·10 4Pa ,并测得反应过 程中系统的总压变化如下表所示: t/s 300 900 2000 4000 p(总)/10 4Pa 3.33 3.63 3.93 4.14 求最初 300s 与最后 2000s 的时间间隔内的平均速率。 解:最初 300s 内的平均速率 r=- =- =13.33Pa·s-1 最后 200s 的时间间隔内 r=- =- =1.05Pa·s-1 答:最初 300s 内的平均速率是 13.33Pa·s-1,最后 2000s 的时间间隔内平均速率是 1.05 Pa·s-1。 5.3 在 600K 下反应 2NO + O2 = 2NO2 0.00703 800 Δp Δt (3.332.93)kPa 300s Δp Δt (4.14 3.93)kPa 2000s

初始浓度mol-dm-3 初速率mol-dm-3s coNO)co(O2) ro=-dc(NOYdt 0.010 0.010 2.510-3 0.010 0.020 5.010 0.030 0.020 4510-3 (仙)求该反应的表观速率方程 (2)计算速率常数. (3)预计cNO=0.015 mol-dm-3,c02=0.025 mol-dm-3的初速率. 解:(1)油实验数据可见,O2的浓度增加一倍,反应速率就增加一倍:NO的浓度增加3倍,反 应速率就增大为原来的9倍。可见该反应的速率与O,的浓度的一次方呈正比,与NO浓度 的平方呈正比。 故有,=kc2NO(O2) (2)由表中的数据可见,任取一组数据来计算速率常数k,计算结果不会有差别: k=- 0.25×10-3mol.dm3.s i(NO)co(O:) (0.0imol-dmmm5x1mdm (3)6=2.5x103cd(N0)c,(0,) =2.5x103mol2.dm6.s1×(0.015mol.dm3y×0.025 mol.dm3 =0.014mol-dm.s- 答:()该反应的表观速率方程是r ke(NO)o(O2 (2速率常数为2.5×103mo1r2.dm5.g (3)caN0=0.015 mol-dm-3,caO2户0.025 mol-dm-3的初速率时的初速率为0.014mol.dnm.stl 5.4N,0在金表面上分解的实验数据如下: U/min c(N2O)/mol-dm-3 0 0.100 20 0.080 0.060 6 100 0 求分解反应的反应级数 (2)制作该反应的动力学曲线。 (3)求速率常数 (4求N,0消耗一半时的反应速率 (5)该反应的半衰期与初始浓度呈什么关系? 解:()在相等的时间间隔内,N,0浓度的减少量相同,可见反应速率与N0的浓度无关。所以 该反应的反应级数为零
初始浓度/mol∙ dm -3 c0(NO) c0(O2) 初速率/mol∙ dm -3 ∙s-1 r0=-dc(NO)/dt 0.010 0.010 0.010 0.020 0.030 0.020 2.5∙10-3 5.0∙10-3 45∙10-3 (1)求该反应的表观速率方程. (2)计算速率常数. (3)预计 c0(NO)=0.015mol∙ dm -3,c0(O2)=0.025 mol∙ dm -3的初速率. 解:(1)由实验数据可见,O2 的浓度增加一倍,反应速率就增加一倍;NO 的浓度增加 3 倍,反 应速率就增大为原来的 9 倍.可见该反应的速率与 O2的浓度的一次方呈正比,与 NO 浓度 的平方呈正比。 故有,r=kc2(NO)c(O2) (2)由表中的数据可见,任取一组数据来计算速率常数 k,计算结果不会有差别: 3 3 1 3 2 6 1 2 3 3 0 0 2 0.25 10 dm 2.5 10 dm ( ) ( ) (0.01 dm )(0.01 dm ) r mol s k mol s c NO c O mol mol - - ¥ - - × × = = = ¥ × × × × (3) 3 2 0 0 0 2 r = 2.5¥10 c (NO)c (O ) 3 2 6 1 3 2 3 3 1 2.5 10 dm (0.015 dm ) 0.025 dm 0.014 dm mol s mol mol mol s - - - = ¥ × × ¥ × ¥ × = × × 答:(1)该反应的表观速率方程是 r=kc2(NO)c(O2); (2)速率常数为 3 2 6 1 2.5 10 mol dm s - - ¥ × × (3) c0(NO)=0.015mol∙ dm -3,c0(O2)=0.025 mol∙ dm -3 的初速率时的初速率为 3 1 0.014mol dm s - × × 1 5.4 N2O 在金表面上分解的实验数据如下: t/min c(N2O)/mol∙ dm -3 0 20 40 60 80 100 0.100 0.080 0.060 0.040 0.020 0 (l)求分解反应的反应级数。 (2)制作该反应的动力学曲线。 (3)求速率常数。 (4)求 N2O 消耗一半时的反应速率。 (5)该反应的半衰期与初始浓度呈什么关系? 解:(l)在相等的时间间隔内,N2O 浓度的减少量相同,可见反应速率与 N2O 的浓度无关。所以 该反应的反应级数为零
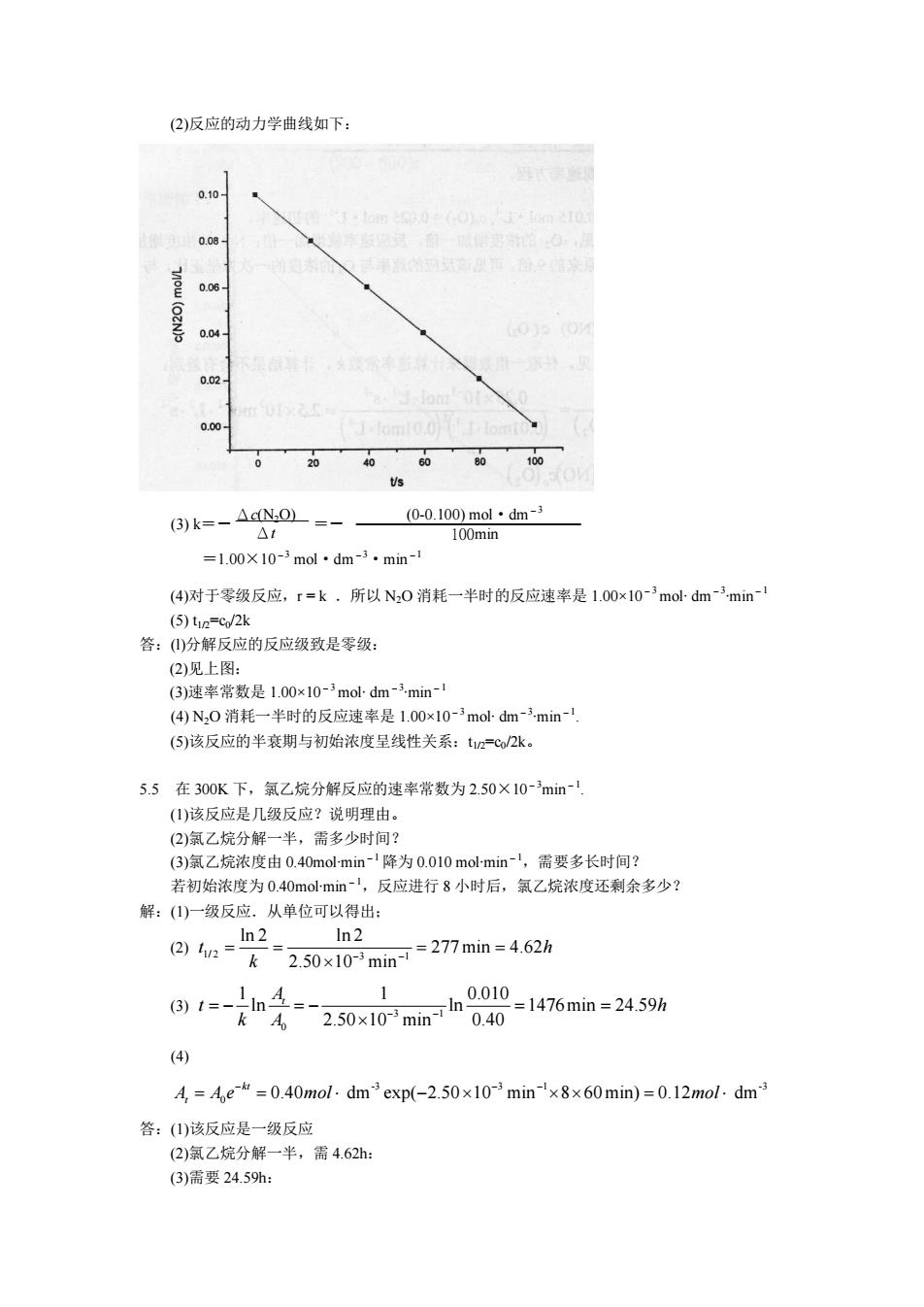
(2)反应的动力学曲线如下: 006 o4 002 0.00 0 (3)k=-△cN.0 0-0.100)mol·dm-3 100mn =1.00X 10-mol dm-3.min-1 (4)对于零级反应,r=k所以N,0消耗一半时的反应速率是1.00x10-mol-dm-min (5)t2c/2k 答:(分解反应的反应级致是零级: (2)见上图: (3)速率常数是100x10-3mo-dm-3min-1 (④N,0消耗一半时的反应速率是100x10-3modm-min (⑤)该反应的半衰期与初始浓度呈线性关系:t1=c/2k。 5.5在300K下,氯乙烷分解反应的速率常数为2.50×10-min- 1该反应是几级反应?说明理由」 (2)氣乙烷分解一半,需多少时间 (3)氯乙烷浓度由0.40m0l-min 降为0.010mol-min,需要多长时间 若初始浓度为0.40 mol-min-1,反应进行8小时后,氯乙烷浓度还剩余多少? 解:()一级反应.从单位可以得出: 2)a=ln2=250x10min=27min=4625 1 8,e_n年=产250x10rmin040=1476mn=2459% A 0.40 (4) =e=0.40mol.dm exp(-2.)=0.12mol.dm 答:(山)该反应是一级反应 (2)氯乙烷分解一半,需4.62h: (3)需要24.59h:
(2)反应的动力学曲线如下: (3) k=- =- =1.00×10-3 mol·dm-3·min-1 (4)对于零级反应,r = k .所以 N2O 消耗一半时的反应速率是 1.00×10-3mol∙ dm-3 ∙min-1 (5) t1/2=c0/2k 答:(l)分解反应的反应级致是零级: (2)见上图: (3)速率常数是 1.00×10-3mol∙ dm-3 ∙min-1 (4) N2O 消耗一半时的反应速率是 1.00×10-3mol∙ dm -3 ∙min-1 . (5)该反应的半衰期与初始浓度呈线性关系:t1/2=c0/2k。 5.5 在 300K 下,氯乙烷分解反应的速率常数为 2.50×10-3min-1 . (1)该反应是几级反应?说明理由。 (2)氯乙烷分解一半,需多少时间? (3)氯乙烷浓度由 0.40mol∙min-1 降为 0.010 mol∙min-1,需要多长时间? 若初始浓度为 0.40mol∙min-1,反应进行 8 小时后,氯乙烷浓度还剩余多少? 解:(1)一级反应.从单位可以得出; (2) 1/ 2 3 1 ln 2 ln 2 277min 4.62 2.50 10 min t h k - - = = = = ¥ (3) 3 1 0 1 1 0.010 ln ln 1476min 24.59 2.50 10 min 0.40 At t h k A - - = - = - = = ¥ (4) 3 3 1 3 0 0.40 dm exp( 2.50 10 min 8 60min) 0.12 dm kt At A e mol mol - - - = = × - ¥ ¥ ¥ = × 答:(1)该反应是一级反应 (2)氯乙烷分解一半,需 4.62h: (3)需要 24.59h: Δc(N2O) Δt (00.100) mol·dm -3 100min

(4氣乙烷浓度还剩余0.12modm-3。 5.6放射性”Co(半衰期t=5.26)发射的强y一辐射广泛用于治疗痛症(放射疗法)。放射性物质 的辐射强度以居里”为单位表示。某医院购买了一个含20居里的钻源,在10年后,辐射强 度还剩余多少? 解:k=n2。n2 25.26a 0.132a A,=A exp(-kt)=20Ciexp(-0.132a-x10a)=5.3Ci 答:在10年后.放射性活度还剩余5.3C1。 5.7碳一14半衰期为5720,今测得北京周口店山顶洞遗址出土的古斑鹿骨化石中的“℃/2℃比 值是当今活者的生物的0.109倍,估算该化石是距今多久?周口店北京猿人距今约50万年.若 有人提议用碳一4法测定它的生活年代,你认为是否可行? 解:=h2。n2 g37200=121x10-a 1 1 答:估算该化石是距今1万8千3百年:用碳一14测定北京猿人距今年代不可行,因年代过于久 远,利余的“℃放射性太弱,会淹没在背景辐射中,测不出来。 5.8实验测得硅烷分解为硅和氢的反应速率常数与温度的关系如下,求该反应的活化能和指前因 子。(1)作图法。(2)线性回归法。 ks-10.0482.349590 TK7738739731073 解:将表中数据处理成下表: (1/TyK-1.29×10-31.15×10-31.03×10-30.93×10-3 Ink -3.340.83 3.89 6.38 可得到nk一T曲线如图所示
(4)氯乙烷浓度还剩余 0.12 mol∙ dm -3。 5.6 放射性 60 27Co (半衰期 t1/2=5.26a)发射的强 γ-辐射广泛用于治疗痛症(放射疗法)。放射性物质 的辐射强度以“居里”为单位表示。某医院购买了一个含 20 居里的钻源,在 10 年后,辐射强 度还剩余多少? 解: 1 1/ 2 ln 2 ln 2 0.132 5.26 k a t a - = = = 1 0 exp( ) 20 exp( 0.132 10 ) 5.3 At A kt Ci a a Ci - = - = - ¥ = 答:在 10 年后.放射性活度还剩余 5.3Ci。 5.7 碳-14 半衰期为 5720a,今测得北京周口店山顶洞遗址出土的古斑鹿骨化石中的 14C/12C 比 值是当今活着的生物的 0.109倍, 估算该化石是距今多久?周口店北京猿人距今约 50 万年. 若 有人提议用碳-14 法测定它的生活年代,你认为是否可行? 解: 4 1 1/ 2 ln 2 ln 2 1.21 10 5720 k a t a - - = = = ¥ 4 4 1 0 1 1 0.0109 ln ln 1.83 10 1.21 10 1 At t a k A a - - = - = - = ¥ ¥ 答:估算该化石是距今 l 万 8 千 3 百年:用碳-14 测定北京猿人距今年代不可行,因年代过于久 远,剩余的 14C 放射性太弱,会淹没在背景辐射中,测不出来。 5.8 实验测得硅烷分解为硅和氢的反应速率常数与温度的关系如下,求该反应的活化能和指前因 子。(1)作图法。(2)线性回归法。 k/s-1 0.048 2.3 49 590 T/K 773 873 973 1073 解:将表中数据处理成下表: (1/T)/K -1 1.29×10-3 1.15×10-3 1.03×10-3 0.93×10-3 lnk -3.34 0.83 3.89 6.38 可得到 lnk-1/T 曲线如图所示:
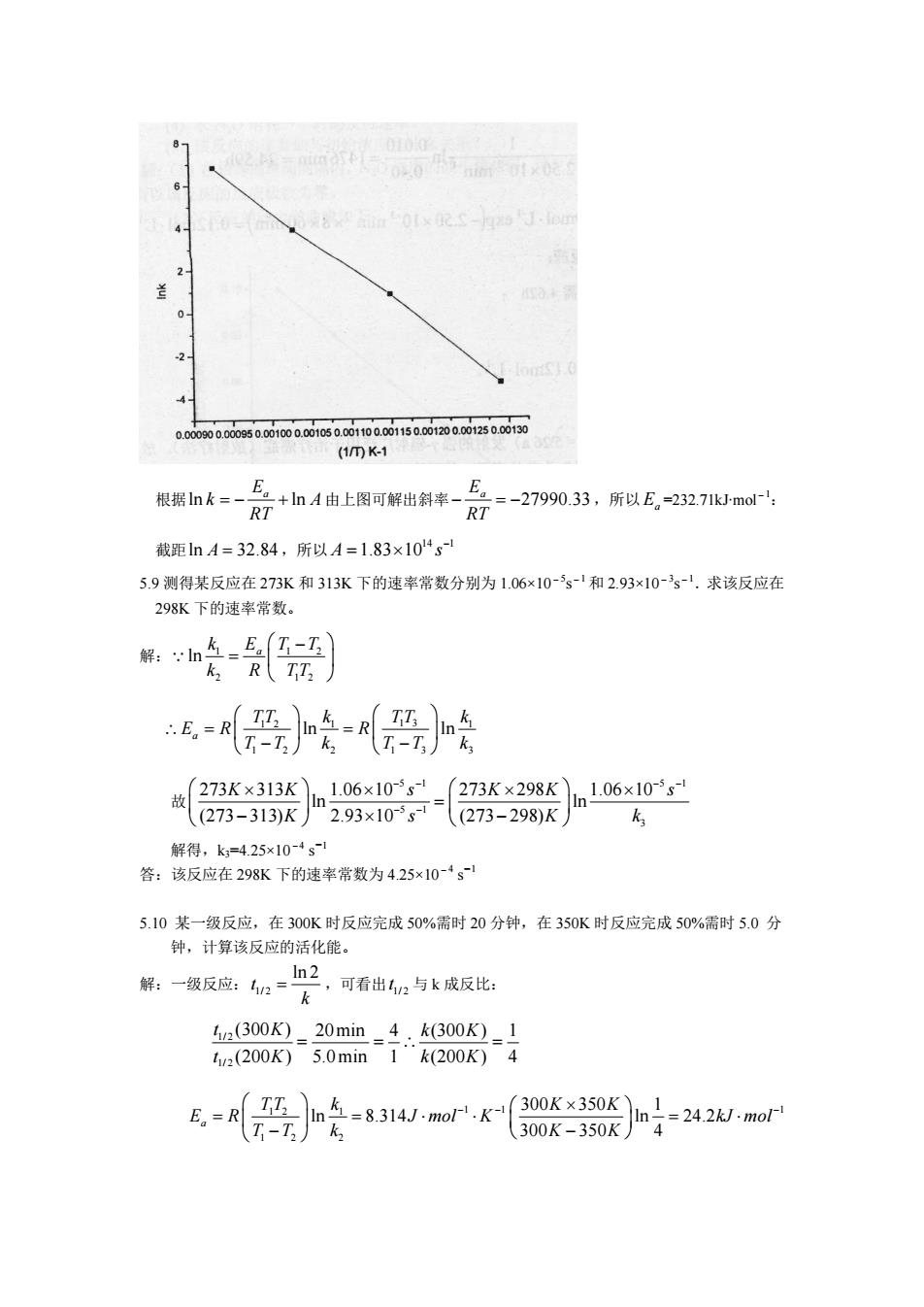
(1mK- 根据nk三-R7+山A由上图可解出斜来-片2三-27990,33,所以E,232,71mo RT 截距nA=32.84,所以A=1.83×104s 5.9测得某反应在273K和313K下的速率常数分别为1.06x10-s-和2.93×10-s-.求该反应在 298K下的速率常数。 解:n车-马(7-工)】 R TT: 恶}经恶 故273K×313Kn106x10s=273K×298Kln106x10-is ((273-313)K 2.93x10s(273-298)K k 解得,k=425x10-1 答:该反应在298K下的速率常数为425×10-·g 5.10某一级反应,在300K时反应完成50%需时20分钟,在350K时反应完成50%需时5.0分 钟,计算该反应的活化能。 解:一级反应:n=h2 ,可看出2与k成反比: (300K)-20min-4.k(300K)_1 12(200K)5.0min1“k200K)4
根据ln ln E a k A RT = - + 由上图可解出斜率 27990.33 E a RT - = - ,所以 Ea =232.71kJ∙mol-1: 截距ln A = 32.84,所以 14 1 A 1.83 10 s - = ¥ 5.9 测得某反应在 273K 和 313K 下的速率常数分别为 1.06×10-5s-1 和 2.93×10-3s-1.求该反应在 298K 下的速率常数。 解: 1 1 2 2 1 2 ln E a k T T k R TT Ê - ˆ = Á ˜ Ë ¯ Q 1 2 1 1 3 1 1 2 2 1 3 3 a ln ln TT k TT k E R R T T k T T k Ê ˆ Ê ˆ \ = = Á ˜ Á ˜ - - Ë ¯ Ë ¯ 故 5 1 5 1 5 1 3 273 313 1.06 10 273 298 1.06 10 ln ln (273 313) 2.93 10 (273 298) K K s K K s K s K k - - - - - - Ê ¥ ˆ ¥ Ê ¥ ˆ ¥ Á ˜ = Á ˜ Ë - ¯ ¥ Ë - ¯ 解得,k3=4.25×10-4 s-1 答:该反应在 298K 下的速率常数为 4.25×10-4 s-1 5.10 某一级反应,在 300K 时反应完成 50%需时 20 分钟,在 350K 时反应完成 50%需时 5.0 分 钟,计算该反应的活化能。 解:一级反应: 1/ 2 ln 2 t k = ,可看出 1/ 2 t 与 k 成反比: 1/ 2 1/ 2 (300 ) 20min 4 (300 ) 1 (200 ) 5.0min 1 (200 ) 4 t K k K t K k K = = \ = 1 2 1 1 1 1 1 2 2 300 350 1 ln 8.314 ln 24.2 300 350 4 a TT k K K E R J mol K kJ mol T T k K K - - - Ê ˆ Ê ¥ ˆ = = × × = × Á ˜ Á ˜ Ë - ¯ Ë - ¯