
第14章碳、硅、翻 8= ,键能相近。一般条件下,两种物质都是气体,很少溶于水:、沸点, 临界压力,临界温度等一些物理性质也相似。 但C0和N分子中三重键特点并不完全相同,N,分子中负电荷分布是对称的,而CO却是 不对称的。C原子略带负电荷,再加上C的电负性比N小,因此CO比N,较易给出电子对 向过渡金属原子(离子)配位,除形成。一配键外,还有π一反馈键形成,故生成的配合物 较稳定。而N,的E位能力远不如C0,分子氨配合物远不如羰基化合物稳定。所以C0的键 能虽比略大,但化学性质却比N要活泼,不象N那样“惰性”。 142概述C0的实验室制法及收集方法,写出C0与下列物质起反应的方程式并注明反应的条件: (1)Ni:(2)CuC:(3)NaOH:(4)H2:(5)PdCl, 解:C0的实验室制法: +H. 用排水集气法收集。 (1 NMi+4C0100-250am Ni(CO) 423-493K (2) 氨水溶液中 2CO 2CuCl +2H2O Cu2Cl(CO)2H2O (3) .01x103kP CO+NaOH HCOONa 473K (4) Cr03·Zn0 C0+2H623.673CH0H Fe、Co、Ni C0+3H2523K101kPa CH,+H2O (5) CO+PdCla+HO=Pd +COz+2HCI 14.3.某实验室备有CCL、干冰和泡沫灭火器(内为Al(SOh和NaHCO3),还有水源和砂。若 有下列失火情况,各宜用哪种方法灭火并说明理由: (1)金属镁着火:(2)金属钠若火: 17-1
17 1 第 14 章 碳、硅、硼 14.1. 对比等电子体 CO 与 N2 的分子结构及主要物理、化学性质。 解:CO 和 N2 是等电子体(14e),分子轨道能级图相似,分子中都有三重键:∶N≡N∶、 C O δ - δ + ∶ ∶ ,键能相近。一般条件下,两种物质都是气体,很少溶于水;熔、沸点, 临界压力,临界温度等一些物理性质也相似。 但 CO 和 N2 分子中三重键特点并不完全相同,N2分子中负电荷分布是对称的,而 CO 却是 不对称的。C 原子略带负电荷,再加上 C 的电负性比 N 小,因此 CO 比 N2 较易给出电子对 向过渡金属原子(离子)配位,除形成σ―配键外,还有π―反馈键形成,故生成的配合物 较稳定。而 N2的配位能力远不如 CO,分子氮配合物远不如羰基化合物稳定。所以 CO 的键 能虽比 N2略大,但化学性质却比 N2 要活泼,不象 N2 那样“惰性” 。 14.2 概述CO的实验室制法及收集方法, 写出CO与下列物质起反应的方程式并注明反应的条件: (1)Ni ;(2)CuCl ;(3)NaOH ;(4)H2 ;(5)PdCl2 解:CO 的实验室制法: HCOOH 浓H2SO 4 CO + H2O 用排水集气法收集。 (1) Ni + 4CO 100 250atm 423 493K Ni(CO)4 (2) (3) CO + NaOH HCOONa 1.01×10 3kPa 473K (4) CO + 3H2 CH4 + H2O Fe、Co、Ni 523K,101kPa (5) CO + PdCl2 + H2O === Pd↓ + CO2 + 2HCl 14.3. 某实验室备有 CCl4、干冰和泡沫灭火器(内为 Al2(SO4)3 和 NaHCO3),还有水源和砂。若 有下列失火情况,各宜用哪种方法灭火并说明理由: (1)金属镁着火; (2)金属钠着火;
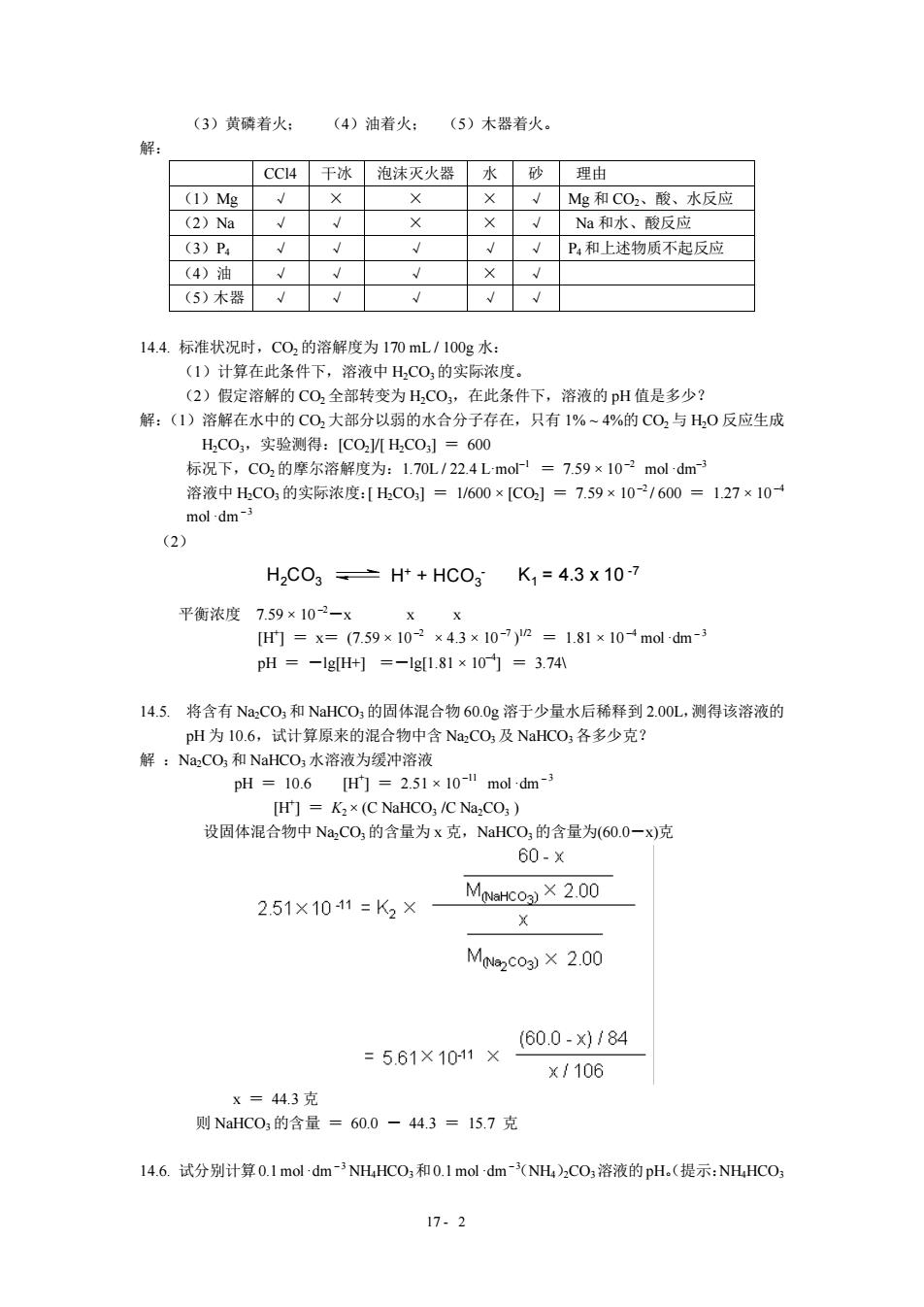
(3)黄磷着火: (4)油着火:(5)木器若火。 解: CC4干冰泡沫灭火器水砂 理由 (1)Mg Mg和COh、酸、水反应 (2)Na Na和水、酸反应 (3)P P,和上述物质不起反应 4)油 (5)木器√ √ √ 14.4.标准状况时,C02的溶解度为170mL1100g水: (1)计算在此条件下,溶液中H,CO,的实际浓度 (2)假定溶 的CO,全部转变为H,CO,在此条件下,溶液的pH值是多少? 解:(1)溶解在水中的C02大部分以弱的水合分子存在,只有1%~4%的C02与H,0反应生成 H,C0,实验测得:[COH,C0,]=600 标况下,C02的摩尔溶解度为:1.70L/22.4Lmo=7.59×10-2 mol dm3 中C0,的实际浓度:HC01=/600x1C0]=7.59x10/600=127x10 (2) H2C03=H+HC0gK,=4.3x10-7 平衡浓度7.59×102一X [=x=(759×102×43x10-7y=181x10m0ld-3 pH--lg[H+1=-lg[181×10=3.74 14.5.将含有NaC0,和NaHCO,的固体混合物60.0g溶于少量水后稀释到2.00L,测得该溶液的 H为10.6,试计算原来的混合物中含Na,CO:及NaHCO1各多少克? 解:Na,CO,和NaHCO水溶液为缓冲溶液 PH =10.6 Hr的=2.51×10-mol dm3 H]=K2x(C NaHCO;/C Na CO:) 设固体混合物中Na,CO,的含量为x克,NaHCO,的含量为(600一x)克 60.× )2.00 2.51×1011=K2× MN2co3)×2.00 =5.61×1011× (60.0-x0184 ×/106 X=443克 则NaHC0的含量=60.0-44.3=15.7克 14.6.试分别计算0.1moldm5 NH.HCO3和0.1 mol dm(NH)2CO3溶液的pH.(提示:NHHC0 17.2
17 2 (3)黄磷着火; (4)油着火; (5)木器着火。 解: CCl4 干冰 泡沫灭火器 水 砂 理由 (1)Mg √ × × × √ Mg 和 CO2、酸、水反应 (2)Na √ √ × × √ Na 和水、酸反应 (3)P4 √ √ √ √ √ P4 和上述物质不起反应 (4)油 √ √ √ × √ (5)木器 √ √ √ √ √ 14.4. 标准状况时,CO2 的溶解度为 170 mL / 100g 水: (1)计算在此条件下,溶液中 H2CO3的实际浓度。 (2)假定溶解的 CO2 全部转变为 H2CO3,在此条件下,溶液的 pH 值是多少? 解:(1)溶解在水中的 CO2 大部分以弱的水合分子存在,只有 1% ~ 4%的 CO2 与 H2O 反应生成 H2CO3,实验测得:[CO2]/[ H2CO3] = 600 标况下,CO2的摩尔溶解度为:1.70L / 22.4 L·mol–1 = 7.59 × 10 –2 mol ·dm–3 溶液中 H2CO3 的实际浓度:[ H2CO3] = 1/600 × [CO2] = 7.59 × 10 –2 / 600 = 1.27 × 10 –4 mol ·dm-3 (2) H2CO 3 H+ + HCO 3 K1 = 4.3 x 10 7 平衡浓度 7.59 × 10 –2-x x x [H+ ] = x= (7.59 × 10 –2 × 4.3 × 10 –7 ) 1/2 = 1.81 × 10 –4 mol ·dm -3 pH = -lg[H+] =-lg[1.81 × 10 –4] = 3.74\ 14.5. 将含有 Na2CO3 和 NaHCO3 的固体混合物 60.0g 溶于少量水后稀释到 2.00L, 测得该溶液的 pH 为 10.6,试计算原来的混合物中含 Na2CO3 及 NaHCO3 各多少克? 解 :Na2CO3 和 NaHCO3 水溶液为缓冲溶液 pH = 10.6 [H+ ] = 2.51 × 10 –11 mol ·dm -3 [H+ ] = K2 × (C NaHCO3 /C Na2CO3 ) 设固体混合物中 Na2CO3 的含量为 x 克,NaHCO3的含量为(60.0-x)克 x = 44.3 克 则 NaHCO3 的含量 = 60.0 - 44.3 = 15.7 克 14.6. 试分别计算0.1mol ·dm-3 NH4HCO3和0.1 mol ·dm-(3 NH4)2CO3溶液的pH。(提示:NH4HCO3

按弱酸弱碱盐水解计算。) (已知:NHH0K=1.77x105:C03K=43x10-7,=5.61x10-1) (1)O.1 mol dm-3 NHHCO,溶液pH值 NH+HC03+H20±NH3·H20+H2CO3 平衡浓度(mol-dm-3)0.1一X0.1一x =1.0x10-1“1(1.77×105×43x10-7=1.31×10-3 x/(0.1-x)=3.62x10- x=HC0]=3.49×10-3 Hc0,7=0.1-3.49x10-3-0.0996≈0.1 mol dm-3 H=KH,C01/HC07=(4.3×107×349×1010.1=15×10 lg1.5× 0 7.82 (2)0,.1 mol dm-3 NH)CO,溶液pH值: NH*+CO2+H2O=NH3*H20+HCO 平衡浓度(molL)02-x0.1-× KK NB-IBO K3 =1.0x10-111.77×105×5.61×10-=10.07 102-x0x0.1-=10.07x=0.092 [H7=KHC0]/IC02=(5.61×10-×0.0922)10.1-0.0922)=6.63×10- pH=-lg门=-lg[6.63x10-=9.18 14.7在0.2 moldm-3的C2*盐溶液中,加入等浓度、等体积的NaC0,溶液,将得到什么产物? 若以0.2m0ldm3的Cr2代替Ca*盐,产物是什么?再以0.2 mol dm-3的A盐代替C 盐,产物又是什么?试从溶度积计算说明。 解:已知CaC0Kp=4.96×10” CuC05Kp=14×10-0 Ca(OHd2Km=4.68×106Cu(OHD2Km=2.6×10- Al(OH)=13x105 溶液中Ca= [Cu]=[AI]=[CO]=0.1mol-dm- C0g2+H20 HCO3+OH [0H=(Kw/K2xCa盐)2=-[1.0x10-“15.61×10-)×0.1]n=422×10-3 (1)Ca2C0,7=102>468x10-6(K.CaC0) [Ca27Ior2=0.1×(422x10-3y=178x106<468×106(K.pCa(OH) 故有CaC0,沉淀析出 (2)[Cu2[C0,=102>14x10-0(KsCuCe0) [Cu27I0H=0.1×(4.22×10-y=1.78×106>2.6×10-19(KpCu(0Hh) 故有Cu(OHD,CO沉淀析出 (3)A(O的溶度积极小,A和C0,完全水解,故生成氢氧化物沉淀。 [A7OF=0.1×(422x10y=7.5×10>13×10-(KpA(OH) 14.8.比较下列各对碳酸盐热稳定性的大小 (1)NaCO:和BeCO: (2)NaHCO:和NaCO: 17.3
17 3 按弱酸弱碱盐水解计算。) (已知:NH3·H2O Kb = 1.77×10 –5 ;H2CO3 K1 = 4.3×10 –7 ,K2 = 5.61×10 –11 ) (1)0.1mol ·dm -3 NH4HCO3 溶液 pH 值: 平衡浓度(mol ·dm -3) 0.1-x 0.1-x x x K h = Kw / KNH3·H2O · K1H2CO3 = 1.0×10 –14 / (1.77×10 –5×4.3×10 –7)= 1.31×10 –3 [x / (0.1-x )] 2 = 1.31×10 –3 x / (0.1-x )=3.62 ×10 –2 x =[H2CO3] = 3.49 ×10 –3 [HCO3 –] = 0.1-3.49 ×10 –3 = 0.0996 ≈ 0.1mol ·dm -3 [H+ ] = K1·[H2CO3] / [HCO3 –] = (4.3×10 –7×3.49 ×10 –3) / 0.1 = 1.5×10 –8 pH = -lg[H+] = -lg[1.5 × 10 –8] = 7.82 (2)0.1mol ·dm-3 (NH4)2CO3 溶液 pH 值: 平衡浓度(mol ·L–1) 0.2-x 0.1-x x x K h= Kw / K NH3·H2O· K2 H2CO3 =1.0×10 –14 / (1.77×10 –5×5.61×10 –11) = 10.07 x 2 / (0.2-x)(0.1-x) = 10.07 x =0.0922 [H+ ] = K2·[HCO3 –] / [CO3 2–] = (5.61×10 –11×0.0922) / (0.1-0.0922) =6.63 ×10 –10 pH=-lg[H+ ] =-lg [6.63 ×10 –10] = 9.18 14.7 在 0.2mol ·dm -3 的 Ca2+ 盐溶液中, 加入等浓度、 等体积的 Na2CO3溶液, 将得到什么产物? 若以 0.2 mol ·dm-3 的 Cu 2+ 代替 Ca2+ 盐,产物是什么?再以 0.2 mol ·dm -3 的 Al3+ 盐代替 Ca2+ 盐,产物又是什么?试从溶度积计算说明。 解:已知 CaCO3 K sp = 4.96 ×10 –9 CuCO3 K sp = 1.4 ×10 –10 Ca(OH)2 K sp = 4.68 ×10 –6 Cu(OH)2 K sp = 2.6 ×10 –19 Al(OH)3 K sp =1.3 ×10 –33 溶液中[Ca 2+ ] = [Cu 2+ ] =[Al3+ ] = [CO3 2–] = 0.1mol ·dm-3 CO 3 2 + H2O HCO 3 + OH [OH –] = (Kw / K2 ×Ca 盐) 1/2= [(1.0×10 –14 / 5.61×10 –11 )×0.1] 1/2 = 4.22 ×10 –3 (1) [Ca 2+ ][CO3 2–] = 10 2 > 4.68 ×10 –6 (K sp CaCO3 ) [Ca2+ ][OH–] 2 = 0.1 × (4.22 ×10 –3) 2 = 1.78 ×10 –6 < 4.68 ×10 –6 (K sp Ca(OH)2 ) 故有 CaCO3 沉淀析出 (2) [Cu 2+ ][CO3 2–] =10 2 > 1.4 ×10 –10 (K sp CuCO3 ) [Cu 2+ ][OH–] 2 = 0.1 × (4.22 ×10 –3) 2 = 1.78 ×10 –6 > 2.6 ×10 –19 (K sp Cu(OH)2 ) 故有 Cu2(OH)2 CO3 沉淀析出 (3)Al(OH)3 的溶度积极小,Al3+ 和 CO3 2–完全水解,故生成氢氧化物沉淀。 [Al3+ ][OH–] 3 = 0.1 × (4.22 ×10 –3) 3 = 7.5 ×10 –4 > 1.3 ×10 –33 (K sp Al(OH)3 ) 14.8. 比较下列各对碳酸盐热稳定性的大小 (1)Na2CO3 和 BeCO3 (2)NaHCO3 和 Na2CO3

(3)MgCO,和BaCO (4)PbC0,和CaC0 解:含氧酸盐热稳定性和金属离子的极化力大小有关,离子势(Z)大、或18、18+2电子构 型的金属离子,对酸根的反极化作用大,酸根中R一O键易断,含氧酸盐变得不稳定 (1)Na,C0,>BCO,因为Be的离子势(Zh)比的大。对CO,的反极化作用强 (2)NaHCO<NCO,因为T是裸露质子,半径又很小,正电荷密度大,反极化作用特别 强。 (3)MgCO:<BaCO3,因为rM4<rB+,Mg2的Zr比Ba2+的大,极化能力比Ba强 (4)P%C0<CaCO,因为b2为18+2电子构型,极化能力比8电子构型的Ca2大。 14.9.如何鉴别下列各组物质: (I)NaCO、NazSiOg、NaB,O,·10HO (2)NaHCO5、NaCo- (3)Ch SiH 解:(1)分别 三种溶液中加酸,有气体(C0,)放出者为a,C0。,有白色沉淀析出者可能是 Na:SiO,或NB,O,·10H,0·再分别取二者溶液,加入浓H,SO,和甲醇,并点燃,有 绿色火焰产生者为NaB.O,·10H0。 (2)分别用pH试纸检验两溶液,pH≈11,溶液呈强碱性者为NaCO,pH在8左右为弱 碱性者为NaHCO,。也可以分别将两固体加热,容易分解产生CO,气体者为NaHCO3, 而Na.O.加执到接化也不分解 (3)分别将两种气体通入AgNO,溶液中,有黑色Ag析出者为SH 14.10.怎样净化下列两种气体: (1)含有少量C02、02和H,0等杂质的C0气体。 (2)含有少量H,0、C0、O2、N2及微量HS和S02杂质的C02气体。 解: (1)将含有杂质的C0气体, 首先通过连 亚硫酸钠的碱性溶液吸收0 2NazS20+O2+4NaOH 然后,再依次通过Ca(OH2溶液、浓HSO4以吸收CO2和HO。 (2)将含有杂质的CO2气体通过冷的、浓K,CO,溶液吸收CO2,C0、O2、N2不被吸收, H,S、SO,也同时被吸收,但产物不同: CO:+K:CO+Ho=2KHCO S02+K,C0-KS0+C021 H2S+K2CO3=K2S+H2O+CO2t 将吸收过CO2的KHCO,溶液耳加热,CO,即逸出。 2KHCO co+K CO+Ho 经浓HS0,干燥后即可得纯净、干燥的CO2。 14.11.试说明下列现象的原因: (1)制各纯硼或硅时,用氢气作还原剂比用活泼金屈或碳好 韩的木溶液是缓冲溶液 (3)装有水玻璃的试剂瓶长期微开瓶口后,水玻璃变浑浊 (4)石棉和滑石都是硅酸盐,石棉具有纤维性质,而滑石可作润滑剂。 解:(1)用活泼金属或碳作还原剂,制备出来的硼或硅会和金属或碳生成金属化合物或碳化物。 17.4
17 4 (3)MgCO3 和 BaCO3 (4)PbCO3 和 CaCO3 解: 含氧酸盐热稳定性和金属离子的极化力大小有关,离子势(Z/r)大、或 18 、18+2 电子构 型的金属离子,对酸根的反极化作用大,酸根中 R-O 键易断,含氧酸盐变得不 稳定。 (1)Na2CO3 > BeCO3,因为 Be 2+ 的离子势(Z/r)比 Na + 的大。对 CO3 2–的反极化作用强。 (2)NaHCO3 < Na2CO3,因为 H + 是裸露质子,半径又很小,正电荷密度大,反极化作用特别 强。 (3)MgCO3 < BaCO3 ,因为 r Mg2+< r Ba2+ ,Mg 2+ 的 Z/r 比 Ba 2+ 的大,极化能力比 Ba 2+ 强。 (4)PbCO3 < CaCO3 ,因为 Pb 2+ 为 18+2 电子构型,极化能力比 8 电子构型的 Ca 2+ 大。 14.9. 如何鉴别下列各组物质: (1)Na2CO3 、Na2SiO3 、Na2B4O7·10H2O (2)NaHCO3 、Na2CO3 (3)CH4、SiH4 解:(1)分别于三种溶液中加酸,有气体(CO2)放出者为 Na2CO3 ,有白色沉淀析出者可能是 Na2SiO3 或 Na2B4O7·10H2O 。再分别取二者溶液,加入浓 H2SO4 和甲醇,并点燃,有 绿色火焰产生者为 Na2B4O7·10H2O。 (2)分别用 pH 试纸检验两溶液,pH ≈ 11,溶液呈强碱性者为 Na2CO3 ,pH 在 8 左右为弱 碱性者为 NaHCO3 。 也可以分别将两固体加热,容易分解产生 CO2气体者为 NaHCO3 , 而 Na2CO3 加热到熔化也不分解。 (3)分别将两种气体通入 AgNO3 溶液中,有黑色 Ag 析出者为 SiH4 。 14.10. 怎样净化下列两种气体: (1)含有少量 CO2、O2 和 H2O 等杂质的 CO 气体。 (2)含有少量 H2O、CO、O2、N2及微量 H2S 和 SO2 杂质的 CO2 气体。 解: (1)将含有杂质的 CO 气体,首先通过连二亚硫酸钠的碱性溶液吸收 O2 : 2Na2S2O4 + O2 + 4NaOH = 4Na2SO3 + 2H2O 然后,再依次通过 Ca(OH)2 溶液、浓 H2SO4 以吸收 CO2和 H2O。 (2)将含有杂质的 CO2气体通过冷的、浓 K2CO3 溶液吸收 CO2 ,CO、O2、N2不被吸收, H2S、SO2 也同时被吸收,但产物不同: CO2 + K2CO3 + H2O = 2KHCO3 SO2 + K2CO3 = K2SO3 + CO2↑ H2S + K2CO3 = K2S + H2O+ CO2↑ 将吸收过 CO2 的 KHCO3 溶液再加热,CO2即逸出。 2KHCO 3 CO 2 + K2CO 3 + H 2O 经浓 H2SO4 干燥后即可得纯净、干燥的 CO2 。 14.11. 试说明下列现象的原因: (1)制备纯硼或硅时,用氢气作还原剂比用活泼金属或碳好; (2)硼砂的水溶液是缓冲溶液。 (3)装有水玻璃的试剂瓶长期敞开瓶口后,水玻璃变浑浊。 (4)石棉和滑石都是硅酸盐,石棉具有纤维性质,而滑石可作润滑剂。 解:(1)用活泼金属或碳作还原剂,制备出来的硼或硅会和金属或碳生成金属化合物或碳化物

(2)硼砂NaB,O(OH4·8H0水解产生共轭酸碱对: B,05(OH)42-+5H20=2H3B03+2B(OH)4 HBO是酸,BOH,是共轭碱 (3)水玻璃Na:SiO接触空气后,与CO2作用,加速水解。 Si032+2H0=HSi03+20HH H,SO:不溶于水,故使溶液变浑浊」 (4)石棉为链状硅酸盐结构,故具有纤维性质:而滑石组分中的硅酸盐阴离子为片状结构 金属离子存在于片层之间,片与片之间容易相对滑动,故滑石有润滑感。 14.12.试说明下列事实的原因: (1)常温常压下,C0为气体而SO2为固体 )CF,不水而B,和S,都水腿 (3)BF和 水解产 物 ,除有相应的含氧酸外,前者生成BF 而后者却是SF。之 解:(1)C 、0均为第二周期元素,形成p一p键的倾向强,CO,分子中除有o键外,还有两 个键,加强了分子的稳定性。因此,它的品体类型是以小分子C0:为结构单元组成的 分子品体,熔、沸点低,故常温常压下为气体。 Si是第三周期元素,形成p一p键的能力弱,倾向于形成多个单键以增加键能,降低体 系能量,因此S0,是以S1 0四面体为结构单元组成的原子品体,培沸点极高,常温常 压下为固体 (2)非金属卤化物水解条件之一是中心原子要有空轨道,接受水分子中氧原子的孤对电子 C下,中C的配位数已饱和,没有空轨道接受,O配位。BF3为缺电子分子,尚有一个空 的D轨道可利用:SF,中原子有空的3d轨道,它们都能接受H,O分子配位,故能水解」 (3)4BF+3H0=HB0+3+3BF 3Si4+4H,0=LSi0, +4 因为B的最大配位数只能是4,故生成BF,而Si可利用空的3轨道成键,配位数可 扩大到6,故生成S证2, 14.13.试说明硅为何不溶于氧化性的酸(如浓酸)溶液中,却分别溶于碱溶液及HO,与H 组成的混合溶液中 解:在氧化性酸中,S被氧化时在共表面形成阻止进一步反应的致密的氧化物薄膜,故不潞 于氧化性酸中。H世的存在可消除Si表面的氧化物薄膜,生成可溶性的SF6,所以Si 可溶于HNO,和HF的混合溶液中。 S是非金属,可和碱反应放出H,同时生成的碱金属硅酸盐可溶,也促使了反应的进行。 14.14.试解释下列现象 (1)甲烷既没有酸性,也没有碱性 (2)硅烷的还原性比烷经强: (3)硅的卤化物比氢化物容易成链: (4)BH有二聚物BH,而BX却不形成二聚体 解:(1)C-H键是共价性的, 又因C和H原子半径均较小,具有较小的极化性,因此在0 分子的影响下,CH不产生H,故不显酸性。又因在CH分子中,C原子外层无孤对 电子及空轨道,不能接受H,故也不显碱性。 (2)H的电负性(x。2.1)介于C(X。2.5)和Si(,1.8)之间,Sl中H表现负氧化态: 17-5
17 5 (2)硼砂 Na2B4O5 (OH)4·8H2O 水解产生共轭酸碱对: H3BO3 是酸,B(OH)4 –是共轭碱。 (3)水玻璃 Na2SiO3接触空气后,与 CO2 作用,加速水解。 SiO3 2– + 2H2O = H2SiO3 + 2OH – H2SiO3 不溶于水,故使溶液变浑浊。 (4)石棉为链状硅酸盐结构,故具有纤维性质;而滑石组分中的硅酸盐阴离子为片状结构, 金属离子存在于片层之间,片与片之间容易相对滑动,故滑石有润滑感。 14.12. 试说明下列事实的原因; (1)常温常压下,CO2 为气体而 SiO2 为固体。 (2)CF4 不水解,而 BF3 和 SiF4都水解。 (3)BF3 和 SiF4水解产物中,除有相应的含氧酸外,前者生成 BF4 –,而后者却是 SiF6 2–。 解:(1)C 、O 均为第二周期元素,形成 p―pπ键的倾向强,CO2 分子中除有σ键外,还有两 个 键,加强了分子的稳定性。因此,它的晶体类型是以小分子 CO2 为结构单元组成的 分子晶体,熔、沸点低,故常温常压下为气体。 Si 是第三周期元素,形成 p―pπ键的能力弱,倾向于形成多个单键以增加键能,降低体 系能量,因此 SiO2 是以 Si―O 四面体为结构单元组成的原子晶体,熔沸点极高,常温常 压下为固体。 (2)非金属卤化物水解条件之一是中心原子要有空轨道,接受水分子中氧原子的孤对电子。 CF4 中 C 的配位数已饱和,没有空轨道接受 H2O 配位。BF3 为缺电子分子,尚有一个空 的 p 轨道可利用;SiF4中原子有空的 3d 轨道,它们都能接受 H2O 分子配位,故能水解。 (3) 4BF3 + 3H2O = H3BO3 + 3H+ + 3BF4 – 3SiF4 + 4H2O = H4SiO4 + 4H+ + 2SiF6 2– 因为 B 的最大配位数只能是 4,故生成 BF4 –,而 Si 可利用空的 3d 轨道成键,配位数可 扩大到 6,故生成 SiF6 2–。 14.13. 试说明硅为何不溶于氧化性的酸(如浓硝酸)溶液中,却分别溶于碱溶液及 HNO3 与 HF 组成的混合溶液中。 解: 在氧化性酸中,Si 被氧化时在其表面形成阻止进一步反应的致密的氧化物薄膜,故不溶 于氧化性酸中。HF 的存在可消除 Si 表面的氧化物薄膜,生成可溶性的[SiF6 2–],所以 Si 可溶于 HNO3 和 HF 的混合溶液中。 Si 是非金属,可和碱反应放出 H2,同时生成的碱金属硅酸盐可溶,也促使了反应的进行。 14.14. 试解释下列现象: (1)甲烷既没有酸性,也没有碱性; (2)硅烷的还原性比烷烃强; (3)硅的卤化物比氢化物容易成链; (4)BH3 有二聚物 B2H6,而 BX3 却不形成二聚体。 解:(1)C-H 键是共价性的,又因 C 和 H 原子半径均较小,具有较小的极化性,因此在 H2O 分子的影响下,CH4 不产生 H + ,故不显酸性。又因在 CH4 分子中,C 原子外层无孤对 电子及空轨道,不能接受 H + ,故也不显碱性。 (2) H 的电负性(xp=2.1)介于 C(xp=2.5)和 Si(xp=1.8)之间,SiH4 中 H 表现负氧化态;