
第9章原子结构和元素周期系 9.1·在自然界中氢有三种同位素,氧也有三种同位素,问:总共有多少种含不同核素的水分子? 由于H太少,可以忽略不计,问:不计H时天然水中共有多少种同位素异构水分子? 解1:组合解 (1)(C·C-3)·C=18: (2)C+C·C=g 解2:方阵(拉丁方解: (1)氢不相同:HOD H"OT DOT HOD HOT DOT 为3x3方阵 氢相同:HOH HOH H8OH D"OD DOD D"OD TOT T"OT T"OT 也为3x3方阵 (2)氢相同:HOH HOH HOH D'OD DOD D"OD 为2x3方阵 氢不同:HoDH7ODH8OD 为1x3方阵 答:总共有18种含不同核素的水分子;不计州时天然水中共有9种同位素异构水分子。 评注:第一个答案并没有给出同位素异构体的具体化学式,只是一个数学解而己,还不是化 学解。 是单货素元而天然碳有两种稳定同位东℃和0·请预首在质 能出现几 答:两个。即:2℃℉时峰和3C℉峰。 9.3用质谱仪测得溴的两种天然同位素的相对原子质量和同位素丰度分别为B78.9183占 50.54%,"Br80.9163占4946%,求溴的相对原子质量(原子量) 解:溴的相对原子量 =78.9183×50.54%+80.9163×49.46%-39.885+40.021=79.91 答:溴的相对原子质量为991。 评注:(1)本题的运算应当遵守有效数字运算规则。此题由于同位素丰度的有效数字只有4 位,算得的原子量的有效数字只有4位,达不到五位有效数字。由原子量表中查得的溴的 相对原子质量79.904(1)的获得显然要求更精确的同位素丰度。同位素丰度的有效数字的位 数常常不是由 于测定方法不够 而是由 取样得到的样品本 存在丰度的涨落。 正是许多元素的原子量有效数字较少的主要原因。(2)请注意,在上述计算中,加和前的时 间结果应当比最终结果多一位数字,其最后一位数字称为保留数字”。 94铊的天然同位素20T和0T1的核素质量分别为202.97amu和204.97amu,已知铊的相对 原子质量(原子量)为20439,求铊的同位素丰度. 解:设轮的丰度为x,则: 202.97x+204.97(1-x)=204.39
第 9 章原子结构和元素周期系 9.1* 在自然界中氢有三种同位素, 氧也有三种同位素, 问: 总共有多少种含不同核素的水分子? 由于 3H 太少,可以忽略不计,问:不计 3H 时天然水中共有多少种同位素异构水分子? 解 I :组合解: ( l ) ( C3 1·C3 1-3 )·C3 1=18; ( 2 ) (C2 1+C2 1)·C3 1=9 解 2 :方阵(拉丁方)解: ( l )氢不相同:H 16OD H 16OT D 16OT H 17OD H 17OT D 17OT H 18OD H 18OT D 18OT 为 3×3 方阵 氢相同: H 16OH H 17OH H 18OH D 16OD D 17OD D 18OD T 16OT T 17OT T 18OT 也为 3×3 方阵. ( 2 )氢相同: H 16OH H 17OH H 18OH D 16OD D 17OD D 18OD 为 2×3 方阵 氢不同: H 16OD H 17OD H 18OD 为 1×3 方阵 答:总共有 18 种含不同核素的水分子;不计 3H 时天然水中共有 9 种同位素异构水分子。 评注:第一个答案并没有给出同位素异构体的具体化学式,只是一个数学解而已,还不是化 学解。 9.2* 天然氟是单核素元素( 19 F ),而天然碳有两种稳定同位素( 12C 和 13C) ,请预言在质谱仪中 能出现几个相应于 CF4+ 的峰? 答:两个。即:12C 19F4+ 峰和 13C 19F4+ 峰。 9.3 用质谱仪测得溴的两种天然同位素的相对原子质量和同位素丰度分别为 79Br 78 . 9183 占 50.54%,81Br 80.9163 占 49.46%,求溴的相对原子质量(原子量)。 解:溴的相对原子量=78.9183×50.54%+80.9163 ×49.46%=39.885+40.021=79.91 答:溴的相对原子质量为 79.91 。 评注:(1)本题的运算应当遵守有效数字运算规则。此题由于同位素丰度的有效数字只有 4 位,算得的原子量的有效数字只有 4 位,达不到五位有效数字。由原子量表中查得的溴的 相对原子质量 79.904(1)的获得显然要求更精确的同位素丰度。同位素丰度的有效数字的位 数常常不是由于测定方法不够精确,而是由于取样得到的样品本身存在丰度的涨落,后者 正是许多元素的原子量有效数字较少的主要原因。(2)请注意,在上述计算中,加和前的中 间结果应当比最终结果多一位数字,其最后一位数字称为“保留数字”。 9.4 铊的天然同位素 203Tl 和 205Tl 的核素质量分别为 202.97 amu 和 204.97 amu ,已知铊的相对 原子质量(原子量)为 204.39 ,求铊的同位素丰度。 解:设铊 203Tl 的丰度为 x ,则: 202.97x + 204.97 (1-x)=204.39

x=029 答:铊0T1丰度为29%,T1丰度为71%。 评注:计算遵从有效数字运算规测,结果只有2位有效数字。 9.5等质量的银制成氯化银和陕化银,测得质量比AgC1:Ag-1.63810:1,又测得银和氯的 相对原子质量(原子量)分别为107.868和35.453,求碘的相对原子质量(原子量)。 解:碘的相对原子质量=(107.686+35.453)×1.68310-107.868=234.774-107.868=126.906 评注:此题是用化学方法测定原子量的典型例子,所得结果的有效数字位数达到6位,但 仍得不到原子量表中的数据的精度:126.904473 9.6*贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大 差别? 答:相对误差=(194.753-195.07195.078)×100%=-0.167% 评注:通过此题可对贝采里乌斯有更高的评价。 97*设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才数完1摩金原子(1 年按365天计)2 解:602×10mol-×1mol/T50×10×2x(3600s/h×24h/d×365d/a)1=19x105a 答:需要1.9x10年才数完(注:像这种数据可考虑取概数:200万年) 9,8试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素 的相对原子质量(原子量)的有效数字的位数却少至3~4位? 答:单核元素只有一种同位素,因而它们的相对原子质量十分准确,有效数字达到的位数较多: 对于那些只有一种同位素的丰度特别大(99%以上)的元素,同位素丰度的不确定性对它们的 原子量的准确性的曼 向较小,而对 那些 个同 素的丰度都较大的元素,原子量的不确定 性的就较高了,特荆是那些不同来源的样品中同位素丰度涨落很大的元素,原子量的不确定 性就更明显了。 9.9太阳系。例如地球,存在周期表所右稳定元素,而太阳却只开始发生氢燃烧。该核反应的 怎样理解这个事实? 答: 太阳的质量不大,是 个年轻的恒星,尚未发生氨燃烧 不能合成比氨重的原子。太阳系 的组成中所有比氨重的原子都是在形成太阳系时从其他星体的喷发物中俘获的,而不是太阳 合成的。 评注:太阳中的碳氧循环只起到催化氢燃烧的作用而不产生新的核素: p+C→Ny p4I4N→15O+y 15O→15N+e+u p叶liN一2C+a+y 总结果: 4p→a+2e'+2t26.7MeV
x=0.29 答:铊 203Tl 丰度为 29 % ,205Tl 丰度为 71 % 。 评注:计算遵从有效数字运算规则,结果只有 2 位有效数字。 9.5 等质量的银制成氯化银和碘化银,测得质量比 AgCl:AgI =1.63810:1 , 又测得银和氯的 相对原子质量(原子量)分别为 107.868 和 35.453,求碘的相对原子质量(原子量)。 解:碘的相对原子质量=(107.686+35.453 ) ×1.68310-107.868=234.774-107.868=126.906 评注:此题是用化学方法测定原子量的典型例子, 所得结果的有效数字位数达到 6 位,但 仍得不到原子量表中的数据的精度:126.90447(3) 9.6* 贝采里乌斯 1826 年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大 差别? 答:相对误差=( 194 .753-195.07 /195.078 ) × 100 % =-0.167 % 评注:通过此题可对贝采里乌斯有更高的评价。 9.7 * 设全球有 50 亿人,设每人每秒数 2 个金原子,需要多少年全球的人才数完 1 摩金原子(1 年按 365 天计)? 解: 6.02 × 10 23 mol-1× l mol/[50×10 8×2×(3600 s/h×24 h/d×365 d/a)] =1.9×10 6 a 答: 需要 1.9×10 6 年才数完(注:像这种数据可考虑取概数:200 万年) 9.8 试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达 9 位,而有的元素 的相对原子质量(原子量)的有效数字的位数却少至 3~4 位? 答:单核元素只有一种同位素,因而它们的相对原子质量十分准确,有效数字达到的位数较多; 对于那些只有一种同位素的丰度特别大(99%以上)的元素,同位素丰度的不确定性对它们的 原子量的准确性的影响较小, 而对于那些几个同位素的丰度都较大的元素,原子量的不确定 性的就较高了, 特别是那些不同来源的样品中同位素丰度涨落很大的元素,原子量的不确定 性就更明显了。 9.9* 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的 产物是只是氦,应怎样理解这个事实? 答: 太阳的质量不大,是一个年轻的恒星,尚未发生氦燃烧,不能合成比氦重的原子。太阳系 的组成中所有比氦重的原子都是在形成太阳系时从其他星体的喷发物中俘获的, 而不是太阳 合成的。 评注:太阳中的碳氧循环只起到催化氢燃烧的作用而不产生新的核素: p+ 12C → 13N+γ 13N → 13C+e + +υ p+ 13C → 14N+γ p+ 14N → 15O+γ 15O → 15N+e + +υ p+ 15N → 12C+α+γ 总结果: 4 p → α+2e+ +2υ+26.7MeV

9.10*中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万 物”,诗对比元素诞生说与这种古代哲学 参考答案:可把所谓的“元气”类比成字宙大爆炸前的物质形态。阴阳比作大爆炸形成的电 子和质子,它们大部分转化为氢,随后凝集成星团,发生核反应,“万物,即其他原子和 由原子结合生成的分子乃至建立在分子水平以上各层次的物质由此而生。 评注:这种类比决不意味着古人的哲学猜想是科学假设。科学假设的基础是科学观察和 科学实验的分析与综合,不是主观思辨的产物,尽管科学假设仍有可能被科学实验证实 是错误的。尽管哲学有可能指导科学研究,没有哲学头脑 可能成为有成就的科学家 但哲学永远不可能代替科学本身。 9.11*“金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克深信不疑。与 化学元素论相比,它出发点最致命的错误是什么? 参考答案:根据化学元素论,化学反应只是改变了原子的结合方式,而一种元素不会变成 有在发生核反 应的条件下 元素才 然而, 五行说却认为在通常条 件下金木水火土(元素)相生相克,即可以相互转化,这说明,五行说跟共他古代文明的 元素论相似,其出发点最致命错误是:并未认识到,客观世界千变万变的表象背后组藏着 的元素本身并不会在通常条件下发生改变,物质的变化仅仅是元素结合方式发生改变而 已。 9.12*请用计算机编一个小程序,v=1=R(122一1m,2计算氢光谱各谐系的谱线的波长(本 练习为开放式习题,并不需要所有学生都会做)。 n. 1(来曼谱系) 1 3 4 2(巴尔麦谱系) 1 2 3 4 波长 3(帕逊谱系) 1 2 3 4 波长 4(布来凯特系 1 33 4 波长 5(冯特谱系) 1 2 4 波长 参老答案:以下是用Visual Basic语言锦的程序: 输入l,n2,输出w为波长label4.caption为提示 If(nl =1)Then Lablel4.Caplion=“来曼谱系 Elself(nl=2 Then Lable14 Caplion=“巴尔麦谱系 Elself (nl=3)Then Lablel4.Caplion=“帕逊谱系 Elself(nl=4 Then Lablel4.Caplion-“布来凯特谱系 Elself nl=5 Then Lable14.Caplion=“冯特系
9.10* 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万 物”,请对比元素诞生说与这种古代哲学。 参考答案:可把所谓的“元气”类比成宇宙大爆炸前的物质形态.阴阳比作大爆炸形成的电 子和质子,它们大部分转化为氢,随后凝集成星团,发生核反应,“万物”,即其他原子和 由原子结合生成的分子乃至建立在分子水平以上各层次的物质由此而生。 评注:这种类比决不意味着古人的哲学猜想是科学假设。科学假设的基础是科学观察和 科学实验的分析与综合,不是主观思辨的产物,尽管科学假设仍有可能被科学实验证实 是错误的。尽管哲学有可能指导科学研究,没有哲学头脑不可能成为有成就的科学家, 但哲学永远不可能代替科学本身。 9.11* “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。与 化学元素论相比,它出发点最致命的错误是什么? 参考答案:根据化学元素论,化学反应只是改变了原子的结合方式,而一种元素不会变成 另一种元素,只有在发生核反应的条件下,元素才会转化。然而,五行说却认为在通常条 件下金木水火土(元素)相生相克,即可以相互转化,这说明,五行说跟其他古代文明的 元素论相似,其出发点最致命错误是:并未认识到,客观世界千变万变的表象背后组藏着 的元素本身并不会在通常条件下发生改变,物质的变化仅仅是元素结合方式发生改变而 已。 9.12* 请用计算机编一个小程序, v =1/λ=RH(1/2 2-1/n2 2)计算氢光谱各谱系的谱线的波长 (本 练习为开放式习题,并不需要所有学生都会做)。 n1 n2 1 (来曼谱系) 1 2 3 4 波长 2 (巴尔麦谱系) 1 2 3 4 波长 3 (帕逊谱系) 1 2 3 4 波长 4 (布来凯特谱系) 1 2 3 4 波长 5 (冯特谱系) 1 2 3 4 波长 参考答案:以下是用 Visual Basic 语言编的程序: 输入 nl ,n2,输出 w 为波长 labeI4 . caption 为提示 If ( nl =1 ) Then Lable14 .Caplion =“来曼谱系” Elself ( nl=2 ) Then Lable14 .Caplion =“巴尔麦谱系” Elself ( nl=3 ) Then Lable14 .Caplion =“帕逊谱系” Elself ( nl=4 ) Then Lable14 .Caplion=“布来凯特谱系” Elself ( nl=5 ) Then Lable14 .Caplion =“冯特谱系

Else Lablel4.Caplion-"eror轻确认nl为1至5的数 End If If (n2>0And n2<5)Then If(nl=n2)Then W=0 Else W=AbsV1.1107**i1-(2*i2m End If Else Lablel4.Caplion=”error径确认n2为1至4的数 End If 9.13*计算下列辐射的频率并给出共颜色:(1)一激光波长633m;(2)高压汞灯辐射之 435.8nm:(3)锂的最强辐射670.8nm. 解:(1)频率o=cn.=2.998×10m.s-'/633×10-”m=4.72×10“ (2)频率D=cn.=2.998x10m.s435.8×10-m=6879x104Hz (3)频率D=c0.=2998×103ms-1/670.8×10-9m=4.469x1014H2 ,从本题开始到19题的目的是熟练掌握波长、频率、能量的关系,同时也为使解题人 接触与化学有关的光的某些基本事实。 9.14Br2分子分解为Br原子需要的最低解离能为190kJm0l,求引起溴分子解离需要吸收的 最低能量子的波长与频率。 解: E=NAh =E/Nh=190x10.ml6.626×10-J.s-1×6.02x102mol-1=4.76×10 1=cb=2.998×10m.s-/4.76x104s-'=6.30x10-7m 答:能引起溴分子分解需要吸收的最低能量子的波长是630m频率是4.76×10也。 评注:引起溴分子分解的光子能量一定高于溴吸收可见光而显色的能量,因后者是分子的 化学键的振动即不分解引起的。为加强读者对此的认识,特将溴的吸收光谱图附于后:
Else Lable14 .Caplion =”error 轻确认 nl 为 1 至 5 的数” End If If(n2>0And n2<5)Then If(nl=n2) Then W=0 Else W=Abs(1/1.1*10^7*(i1*i1)-(i2*i2)))) End If Else Lable14 .Caplion =”error 轻确认 n2 为 1 至 4 的数” End If 9.13* 计算下列辐射的频率并给出其颜色:( 1 )氦-氖激光波长 633nm ; ( 2 )高压汞灯辐射之一 435 . 8nm ; ( 3 )锂的最强辐射 670 . 8 nm。 解:(1)频率 υ=c/λ =2.998×10 8m . s-1 /633×10-9m=4.72×10 14Hz ( 2 )频率 υ=c/λ =2.998×10 8m . s-1 /435.8×10-9m=6.879×10 14Hz ( 3 )频率 υ=c/λ =2.998×10 8m . s-1 /670.8×10-9m=4.469×10 14Hz 评注:从本题开始到 19 题的目的是熟练掌握波长、频率、能量的关系,同时也为使解题人 接触与化学有关的光的某些基本事实。 9.14 Br2 分子分解为 Br 原子需要的最低解离能为 190kJ/mol ,求引起溴分子解离需要吸收的 最低能量子的波长与频率。 解: E=NAhυ υ=E/ NAh=190×10 3J. mol-1 /6.626×10-34 J. s-1 × 6.02x10 23 mol-1=4.76×10 14Hz λ =c/υ=2.998×10 8m . s-1 /4.76×10 14 s-1=6.30×10-7m 答:能引起溴分子分解需要吸收的最低能量子的波长是 630 nm ;频率是 4.76 ×10 14 Hz 。 评注:引起溴分子分解的光子能量一定高于溴吸收可见光而显色的能量,因后者是分子的 化学键的振动即不分解引起的。为加强读者对此的认识,特将溴的吸收光谱图附于后:
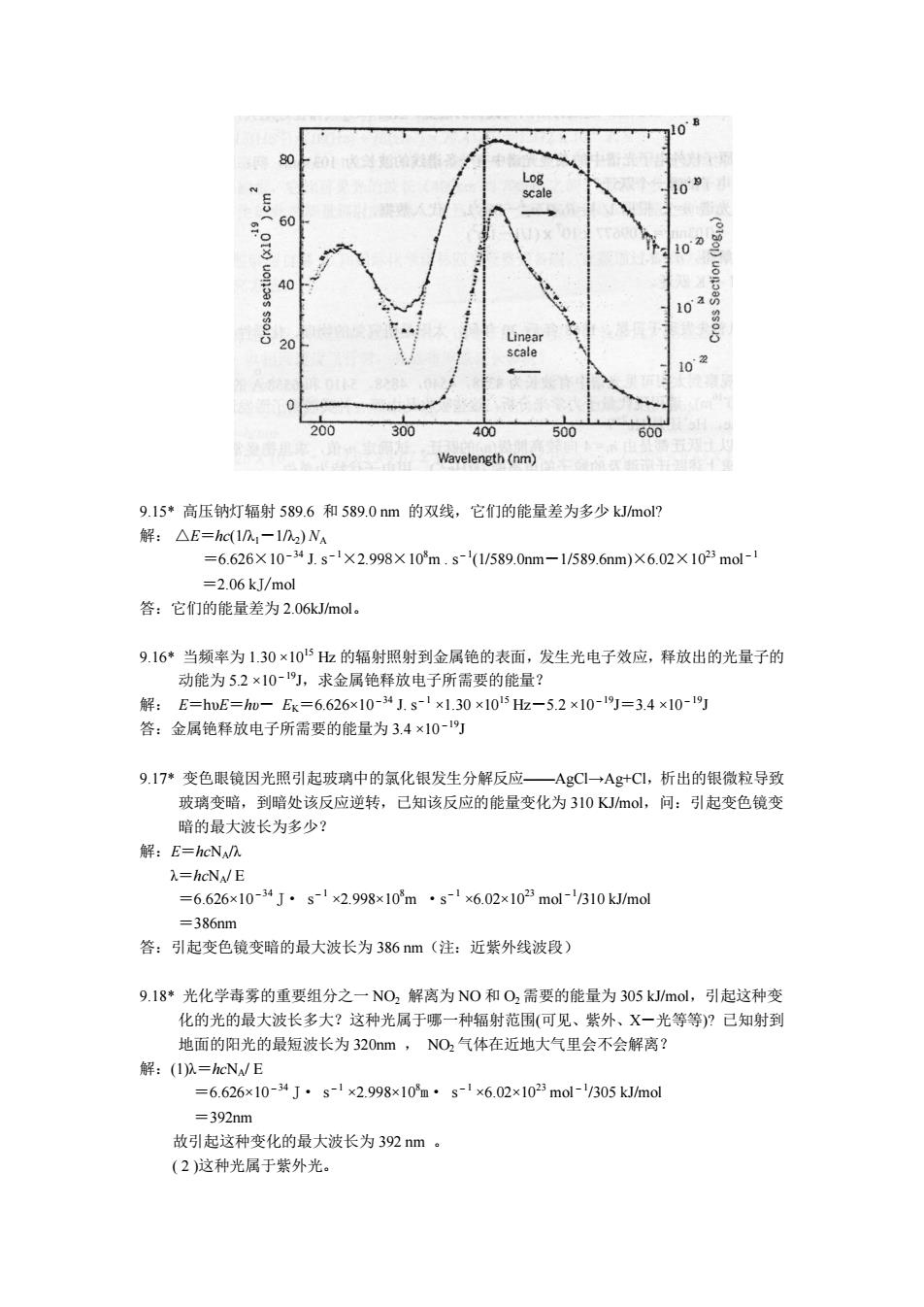
10 200 300 400 500 Wavelength(nm) 9.15*高压钠灯辐射589.6和589.0nm的双线,它们的能量差为多少kJmo? 解:△E=h(In-ln)Na =6.626X10-41.s-1×2.998×10m.s/589.0nm-1/589.6nm)×6.02×102mol- -2.06kJ/mol 答:它们的能量差为2.06kJm0l. 9.16*当频率为1.30×105出的辐射照射到金属铯的表面,发生光电子效应,释放出的光量子的 动能为52×10-,求金属铯释放电子所需要的能量? hE-hu =6.626× 1.30×105h-5.2×10-19=34×10-19 答:金属绝释放电子所需要的能量为3.4×10-灯 9.17*变色眼镜因光照引起玻璃中的氯化银发生分解反应一AgC1→Ag+C1,析出的银微粒导致 玻璃变暗,到暗处该反应逆转,已知该反应的能量变化为310KJmo,问:引起变色镜变 暗的最大波长为多少 解:E=heN). 1.=hcN/E =6.626×10-4J·s↓×2.998x10m·s1x6.02x102mo310kJ/m0dl =386nm 答:引起变色镜变暗的最大波长为386nm(注:近紫外线波段) 9.18*光化学毒雾的重要组分之一NO2解离为NO和O2需要的能量为305kJ/mol,引起这种变 化的光的最大波长多大?这种光属于哪一种辐射范围(可见、紫外、X一光等等)?已知射到 地面的阳光的最短波长为320m,NO,气体在近地大气里会不会解离? 解:(I以=hcNE =6.626x10-4J·s-x2.998x10m·s-x6.02x1025mol-/305 kJ/mol =392nm 故引起这种变化的最大波长为32nm。 (2)这种光属于紫外光
9.15* 高压钠灯辐射 589.6 和 589.0 nm 的双线,它们的能量差为多少 kJ/mol? 解: △E=hc(1/λ1-1/λ2) NA =6.626×10-34 J. s-1×2.998×10 8m . s-1(1/589.0nm-1/589.6nm)×6.02×10 23 mol-1 =2.06 kJ/mol 答:它们的能量差为 2.06kJ/mol。 9.16* 当频率为 1.30 ×10 15 Hz 的辐射照射到金属铯的表面,发生光电子效应,释放出的光量子的 动能为 5.2 ×10-19J,求金属铯释放电子所需要的能量? 解: E=hυE=hυ- EK=6.626×10-34 J. s-1 ×1.30 ×10 15 Hz-5.2 ×10-19J=3.4 ×10-19J 答:金属铯释放电子所需要的能量为 3.4 ×10-19J 9.17* 变色眼镜因光照引起玻璃中的氯化银发生分解反应——AgCl→Ag+Cl,析出的银微粒导致 玻璃变暗,到暗处该反应逆转,已知该反应的能量变化为 310 KJ/mol,问:引起变色镜变 暗的最大波长为多少? 解:E=hcNA/λ λ=hcNA/ E =6.626×10-34 J· s-1 ×2.998×10 8m ·s-1 ×6.02×10 23 mol-1 /310 kJ/mol =386nm 答:引起变色镜变暗的最大波长为 386 nm(注:近紫外线波段) 9.18* 光化学毒雾的重要组分之一 NO2 解离为 NO 和 O2 需要的能量为 305 kJ/mol,引起这种变 化的光的最大波长多大?这种光属于哪一种辐射范围(可见、紫外、X-光等等)? 已知射到 地面的阳光的最短波长为 320nm , NO2 气体在近地大气里会不会解离? 解:(1)λ=hcNA/ E =6.626×10-34 J· s-1 ×2.998×10 8m· s-1 ×6.02×10 23 mol-1 /305 kJ/mol =392nm 故引起这种变化的最大波长为 392 nm 。 ( 2 )这种光属于紫外光