
84.在反应C0+C2一COCh中,C0与C以相同的摩尔数相互作用,当平衡时 C0仅剩下一半,如果反应前混合物的总压为1atm,平衡时气体总压为多少? 85.在25℃,1am时N,0,和NO2的平衡混合物的密度为3.18gdm,求: 1)混合气体的平均分子量。2)该条件下N,O4的离解度 (3)NO2和N,O的分压。 (4)反应N,O4一2NO2的平衡常数Kp 86.固态的NH4HS分解时建立下列平衡: NH4HS(s)NHs(g)+H2S(g) 当25.9℃时,平衡的气体总压是0.658atm。假设在此温度下,固体NH4HS在 密闭容器中分解,瓶内原有0.45atm的HS存在,求平衡时各气体的分压。 87.在1000℃时Fe0+C0、一Fe+C02的K,=0.403,求欲得1 molFe需通入多少摩尔 C0? 88.在8.2℃时将0.5mol的N,04溶于450cm3的CHCL中,分压达到平衡,问平衡时溶液 中NO2的浓度若干?已知在8.2℃时NO4=2NO2的平衡常数K=1.08x103. 89.由1.5mol的N0、1.0mol的C2和2.5mol的N0C1混合在15dm3的容器中,在230℃ 反应为2NO(g)+Cl(g)→2NOCI(g。平衡时,NOC1为3.06mol,试计算 (1)平衡时NO的摩尔数。 2)平衡常数K、 90.在一定温度下,一定量的PCl的气体体积为1dm3,此时PCl有50%解离为PCl3和 C2,用质量作用定律说明在下列情况下,解离度是增加还是减少?(此时压强为1am) ()降低压强,使体积变为2dm2 2)保持体积不变,加入N,使压强为2atm (3)保持压强不变,加入使体积为2dm3。 (4保持压强不变,加入Cl2使体积变为2dm2。 (5)保持压强不变,加入PC13使体积变为2dm3.。 91.溴化亚硝酰NOBr)是一种气态化合物,能由下面的反应生成:2NO+Br一2NOBr 在25℃时,这个反应的平衡常数为116(atm)',这时所有的物质都为气态物质。这个反应是 放热的, (1)假设这些物质都引入了一个反应室中,各自的分压为:NOBr:0.8atm:NO:0.4atm: B2:02atm:这样会不会发生反应?如果会,是NOBr的净生成还是它的净分解?试解释。 (2)在25℃建立平衡后温度升高到100℃,由于温度变化,N0Br是净生成还是净分解? 试解释。 (3)假设氢注入在25C上式反应已达到平衡的长颈瓶中,直至长颈瓶的压强为平衡时的 两倍,对于存在的NOBr的量有否影响? 92.计算C(石墨)+2H(g)=CH4(g,在25℃时的平衡常数。 已知△H=-74.78 kJ-mol,△S=-80.59J-mol-.K-1. 16
16 84. 在反应 CO + Cl2 COCl2 中,CO 与 Cl2 以相同的摩尔数相互作用,当平衡时, CO 仅剩下一半,如果反应前混合物的总压为 1atm,平衡时气体总压为多少? 85. 在 25℃,1atm 时 N2O4 和 NO2 的平衡混合物的密度为 3.18gdm-3 ,求: (1)混合气体的平均分子量。 (2)该条件下 N2O4 的离解度。 (3)NO2 和 N2O4 的分压。 (4)反应 N2O4 2NO2 的平衡常数 Kp。 86. 固态的 NH4HS 分解时建立下列平衡: NH4HS(s) NH3(g) + H2S(g) 当 25.9℃时,平衡的气体总压是 0.658atm。假设在此温度下,固体 NH4HS 在 密闭容器中分解,瓶内原有 0.45atm 的 H2S 存在,求平衡时各气体的分压。 87. 在 1000℃时 FeO + CO Fe + CO2 的 Kp=0.403,求欲得 1molFe 需通入多少摩尔 CO? 88. 在 8.2℃时将 0.5mol 的 N2O4 溶于 450cm3 的 CHCl3 中,分压达到平衡,问平衡时溶液 中 NO2 的浓度若干?已知在 8.2℃时 N2O4 2NO2 的平衡常数 Kc=1.0810-5 。 89. 由 1.5mol 的 NO、1.0mol 的 Cl2 和 2.5mol 的 NOCl 混合在 15dm3 的容器中,在 230℃ 反应为 2NO(g) + Cl2(g) 2NOCl(g)。平衡时,NOCl 为 3.06mol,试计算: (1)平衡时 NO 的摩尔数。 (2)平衡常数 Kc、Kp。 90. 在一定温度下,一定量的 PCl5 的气体体积为 1dm3 ,此时 PCl5 有 50%解离为 PCl3 和 Cl2,用质量作用定律说明在下列情况下,解离度是增加还是减少?(此时压强为 1atm) (1)降低压强,使体积变为 2dm3 。 (2)保持体积不变,加入 N2,使压强为 2atm。 (3)保持压强不变,加入 N2 使体积为 2dm3 。 (4)保持压强不变,加入 Cl2 使体积变为 2dm3 。 (5)保持压强不变,加入 PCl3 使体积变为 2dm3 。 91. 溴化亚硝酰(NOBr)是一种气态化合物,能由下面的反应生成:2NO+Br2 2NOBr。 在 25℃时,这个反应的平衡常数为 116(atm)-1 ,这时所有的物质都为气态物质。这个反应是 放热的, (1)假设这些物质都引入了一个反应室中,各自的分压为:NOBr:0.8atm;NO:0.4atm; Br2:0.2atm;这样会不会发生反应?如果会,是 NOBr 的净生成还是它的净分解?试解释。 (2)在 25℃建立平衡后温度升高到 100℃,由于温度变化,NOBr 是净生成还是净分解? 试解释。 (3)假设氦注入在 25℃上式反应已达到平衡的长颈瓶中,直至长颈瓶的压强为平衡时的 两倍,对于存在的 NOBr 的量有否影响? 92. 计算 C(石墨) + 2H2(g) = CH4(g),在 25℃时的平衡常数。 已知H ө = -74.78kJmol-1 ,S ө = —80.59Jmol-1 K-1

93.在1200K和石墨存在的情况下,C0(g)+C(石墨)一2C0(g.平衡混合物中C0 占摩尔分数为98.3%,C02占1.69%,总压为1atm,问: (山)C0和C02分压为多少? 2)平衡常数K。为多少? ()此反应的△G为多少 94.求下列各反应的△G°和平衡常数K,(所需数据,见附表) (山4r(aq)+02(g)+4H、一2H00+2(g) 2)C0(g)+2H(g) CH3OH(1) (3)3Hg)+S02g)、一HS(g)+2H00 (4)Ca(s)+C0(g) Cao(s)+2CO(1) 95.在448℃时反应H(g)+g) 2H(g)的K,=66.9,在350℃该反应的K。=50.0. (1)计算在这个温度范围内的△H令 (2)计算在这两个温度下,反应的AG日 96.在700K时,反应:C0(g)+2H(g)、一CH,0Hg)的△G悬=-13.46kJ.mol,计算 此反应的K,值。 97.在395℃时反应C0C2(g)一C0(g)+2H(g)的K,为456x103,计算此反应的 △G8。 98.N04(g)s 一2NO(g)平衡体系的K,和温度C的关系如下: K。 0.141 0.308 0.628 25 35 45 1)将1。对1/T作图 (②)从直线的斜率求△H (3)计算每 个温度的△G ④计算每 一个温度的AS 99.己知BaO(s)+H00=Ba(OH(s) AFm=-103kJ-mol- Ba(OH)2(s)+aqBa**(aq)+2OH(aq) A.H=-52kJ-mol-1 Ba(OH)2-8H2O(s)+aq=Ba2*(aq)+2OH(aq) A/=+64kJ-mol- 请回答下列问题。若能,给出答案:若不能,简述原因。 ()能求得BaOs)的溶解热吗? (2)能求得Ba(OH)(s)转变成Ba(OHD2-8HhO能量变化吗? (3)能求得“O2-”(s)+HO=2OH(s的能量吗? (④能求得“02-”(句+ag→20(s)的能量吗? 100.在298.15K时CaS04-2H,0(s、CaS04s)、H,00)的标准生成吉布斯函数分别为:-1796、 -1320、-237kJmo,水的饱和蒸气压为3575Pa。 (1)判断在298.15K时,将CaS042HOs)放入饱和水蒸气的空气中是否会分解 (2)求298.15K时CaS042H0(s)的分解压力
17 93. 在 1200K 和石墨存在的情况下,CO2(g) + C(石墨) 2CO(g)。平衡混合物中 CO 占摩尔分数为 98.3%,CO2 占 1.69%,总压为 1atm,问: (1) CO 和 CO2 分压为多少? (2) 平衡常数 Kp 为多少? (3) 此反应的G 为多少? 94. 求下列各反应的G ө 和平衡常数 K,(所需数据,见附表) (1) 4I(aq) + O2(g) + 4H+ 2H2O(l) + 2I2(g) (2) CO(g) + 2H2(g) CH3OH(l) (3) 3H2(g) + SO2(g) H2S(g) + 2H2O(l) (4) Ca(s) + CO2(g) CaO(s) + 2CO(l) 95. 在 448℃时反应 H2(g) + I2(g) 2HI(g)的 Kp=66.9,在 350℃该反应的 Kp=50.0。 (1) 计算在这个温度范围内的H 。 (2) 计算在这两个温度下,反应的G 。 96. 在 700K 时,反应:CO(g)+2H2(g) CH3OH(g)的G 700 = -13.46kJ.mol-1 ,计算 此反应的 Kp 值。 97. 在 395℃时反应 COCl2(g) CO(g) + 2H2(g) 的 Kp 为 4.5610-2 ,计算此反应的 G 668。 98. N2O4(g) 2NO2(g)平衡体系的 Kp 和温度 t℃的关系如下: Kp 0.141 0.308 0.628 t(℃) 25 35 45 (1) 将 lgKp 对 1/T 作图 (2) 从直线的斜率求H ө (3) 计算每一个温度的G ө (4) 计算每一个温度的S ө 99. 已知 BaO(s) + H2O(l) = Ba(OH)2(s) rHm = -103kJ·mol1 Ba(OH)2(s) + aq Ba2+(aq) + 2OH- (aq) rHm = -52kJ·mol1 Ba(OH)2·8H2O(s) + aq = Ba2+(aq) + 2OH- (aq) rHm = +64kJ·mol1 请回答下列问题。若能,给出答案;若不能,简述原因。 (1) 能求得 BaO(s)的溶解热吗? (2) 能求得 Ba(OH)2(s)转变成 Ba(OH)2·8H2O 能量变化吗? (3) 能求得“O2”(s) + H2O(l) = 2OH (s)的能量吗? (4) 能求得“O2”(s) + aq 2OH (s)的能量吗? 100. 在 298.15K 时 CaSO4·2H2O(s)、CaSO4(s)、H2O(l)的标准生成吉布斯函数分别为:1796、 1320、237(kJ· mol1 ),水的饱和蒸气压为 3575Pa。 (1) 判断在 298.15K 时,将 CaSO4·2H2O(s)放入饱和水蒸气的空气中是否会分解。 (2) 求 298.15K 时 CaSO4·2H2O(s)的分解压力

第三章化学动力学基础 1.有A气体和B气体进行反应,若将A气体浓度增加一倍,速率增加400%,若将B气 体的浓度增加一倍,速率增加200%,试写出反应式。 2.下列生成NO2的反应:2NO十O2一2NO2其反应速率表示式为 v=AINOPIO, 如果压力增加到原来的两倍,试计算速率之变化。 3.在抽空的刚性容器中,引入一定量纯A气体,发生如下反应: A(g) →B(g)+2C(g)。设反应能进行完全,经恒温到323K时,开始计时,测定 体系总压随时间的变化关系如下: /min 0 30 50 /kPa 5333 7333800010666 求该反应级数及速率常数 4.若气体混合物体积缩小到原来的13,下列反应的初速率变化为多少? 2S02+02→2S03 5.在308K时,反应N0(g)→2N02(g)+1/202g)的k=1.35x105, 在318K时,k=4.98×105,试求这个反应的活化能? 6.CH,CH0的热分解反应是:CH,CHO(g)→CH(g)+COg)在700K时,-0.0105,己知 Ea=18.1 kJ-mol厂,试求800K时的k。 7.己知HCI(g)在1atm和25℃时的生成热为一88.2 kJ-mol",反应 H(g)+Cl(g)=2HCI(g) 的活化能为112.9 kJ-mol1。试计算逆反应的活化能。 8.某一个化学反应,当温度由300K升高到310K时,反应速率增加了一倍,试求这个反 应的活化能。 9.某化学反应,在300K时,20min内反应完成了50%,在350K时,5min内反应完成了 50%,计算这个反应的活化能。 10.已知在320℃时反应S0,C1(g)→S0(g+C1(g)是一级反应,速率常数为2.2x10s1. 试求:()10.0gS02C2分解一半需多少时间? (2)2.00gS0C经2h之后还剩多少克? 11.在人体内,被酵母催化的某生化反应的活化能为39m0。当人发烧到313K时, 此反应的速率常数增大到多少倍? 12.蔗糖催化水解CHO1+H0 化剂→2C6H106是一级反应,在25℃速率常数为 5.7×10s。试求: (1)浓度为1moldm3蔗糖溶液分解10%需要多少时间 (2)若反应活化能为110 kJ.mol,那么在什么温度时反应速率是25℃时的十分之一?
18 第三章 化学动力学基础 1. 有 A 气体和 B 气体进行反应,若将 A 气体浓度增加一倍,速率增加 400%,若将 B 气 体的浓度增加一倍,速率增加 200%,试写出反应式。 2. 下列生成 NO2 的反应:2NO+O2 2NO2 其反应速率表示式为 [NO] [O ] 2 2 v k 如果压力增加到原来的两倍,试计算速率之变化。 3. 在抽空的刚性容器中,引入一定量纯 A 气体,发生如下反应: A(g) B(g) + 2C(g)。设反应能进行完全,经恒温到 323K 时,开始计时,测定 体系总压随时间的变化关系如下: t / min 0 30 50 ∞ p 总 / kPa 53.33 73.33 80.00 106.66 求该反应级数及速率常数 4. 若气体混合物体积缩小到原来的 1/3,下列反应的初速率变化为多少? 2SO2 + O2 2SO3 5. 在 308K 时,反应 N2O5(g) 2NO2(g) + 1/2O2(g) 的 k = 1.3510-5 , 在 318K 时,k = 4.9810-5 ,试求这个反应的活化能? 6. CH3CHO 的热分解反应是:CH3CHO(g) CH4(g) + CO(g) 在 700K 时,k=0.0105,已知 Ea=188.1kJmol-1 ,试求 800K 时的 k。 7. 已知 HCl(g)在 1atm 和 25℃时的生成热为-88.2kJmol-1 ,反应 H2(g) + Cl2(g) = 2HCl(g) 的活化能为 112.9kJmol-1 。试计算逆反应的活化能。 8. 某一个化学反应,当温度由 300K 升高到 310K 时,反应速率增加了一倍,试求这个反 应的活化能。 9. 某化学反应,在 300K 时,20min 内反应完成了 50%,在 350K 时,5min 内反应完成了 50%,计算这个反应的活化能。 10. 已知在 320℃时反应 SO2Cl2(g)SO2(g)+Cl2(g)是一级反应,速率常数为 2.210-5 s -1 。 试求:(1)10.0gSO2 Cl2 分解一半需多少时间? (2)2.00gSO2Cl2 经 2h 之后还剩多少克? 11. 在人体内,被酵母催化的某生化反应的活化能为 39kJmol-1 。当人发烧到 313K 时, 此反应的速率常数增大到多少倍? 12. 蔗糖催化水解 C12H22O11+H2O 催化剂 2C6H12O6 是一级反应,在 25℃速率常数为 5.710-5 s -1 。试求: (1)浓度为 1moldm-3 蔗糖溶液分解 10%需要多少时间? (2)若反应活化能为 110kJ.mol-1 ,那么在什么温度时反应速率是 25℃时的十分之一?

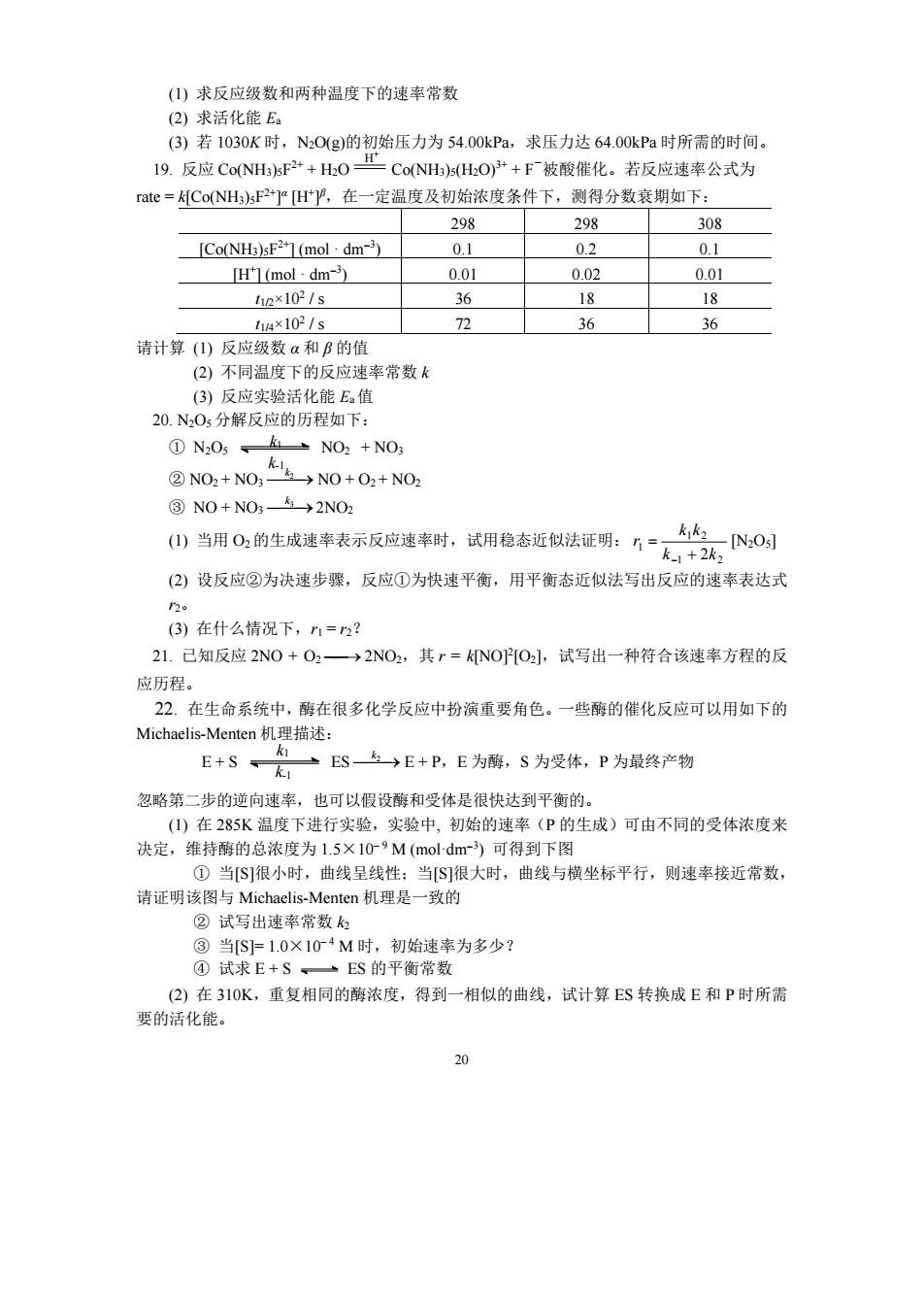
13.反应2NO+2→N2+2H0在一定温度下,某密闭容器中等摩尔的比NO与混合物 在不同初压下的半衰期为 po(mmHg) 355 340.5 288 251230 202 te(min) 95 101 130 160 183224 求反应级数。 14环戊一烯(沸点40℃易在气相中形成双聚:2 CsHs(g)-CIH(e 现将0.50cm3环戊二烯(p=0.802g.cm3)放入容器为1.000dm2的抽空密闭容器中,加热到 130℃,经过一段时间,测定总压的结果如下: min)10 20 3040 50 60 pe(kPa)18.0716.6215.6314.8714.3313.88 (1)计算温度升到130℃时尚未聚合的起始压力。 (2)计算60min时环戊二烯的分压。 ()此反应的反应级数和反应速率常数。 15.把一定量的PH(g)引入含有惰性气体的温度为873K的反应器中,PH(g)可完全分解 为P4(g)和H(g),测得总压随时间的变化如下: 60 120 p/kPa 262.40 272.90 275.53 276.40 求反应级数及速率常数 16.气相反应C1,0+2N,0→NO,C1+NOC1+2NO+O2的可能历程是: N2Os NO2+NOs (快平衡) NO2+NO3- NO+O:+NO: (慢) NO+CLO-3 NO.CI+CI (快) CI+:CI (快 而N,05分解历程如下: N05k3 NO2+NO (快平衡) NO2+NO3 2NO+O2+NO, (慢) NO+NO:- 3→2N02 (快) 试求这两个反应的速度方程式,你能从这两个结果得出什么结论? 17.2NO(g)+O2→2NO(g)存在三种可能的机理,试写出每一种机理的分步反应,若反应 速率一oco,问上述反应按哪种机理进行? 18.N2O(g)的热分解反应为2N2O(g)4→2N2(g)+O2(g,从实验测出不同温度时各个起 始压力与半衰期如下: 反应温度T/K 967 967 1030 初始压力Pp/kPa 156787 39.197 7.066 47.996 半衰期2/s 380 1520 1440 212
19 13. 反应 2NO+2H2N2+2H2O 在一定温度下,某密闭容器中等摩尔的比 NO 与 H2 混合物 在不同初压下的半衰期为 p0(mmHg) 355 340.5 288 251 230 202 t1/2(min) 95 101 130 160 183 224 求反应级数。 14. 环戊二烯(沸点 40℃)易在气相中形成双聚:2C5H6(g)→C10H12(g) 现将 0.50cm3 环戊二烯( =0.802g.cm-3 )放入容器为 1.000dm3 的抽空密闭容器中,加热到 130℃,经过一段时间,测定总压的结果如下: t(min) 10 20 30 40 50 60 p 总(kPa) 18.07 16.62 15.63 14.87 14.33 13.88 (1) 计算温度升到 130℃时尚未聚合的起始压力。 (2) 计算 60min 时环戊二烯的分压。 (3) 此反应的反应级数和反应速率常数。 15. 把一定量的 PH3(g)引入含有惰性气体的温度为 873K 的反应器中,PH3(g)可完全分解 为 P4(g)和 H2(g),测得总压随时间的变化如下: t / s 0 60 120 ∞ p / kPa 262.40 272.90 275.53 276.40 求反应级数及速率常数 16. 气相反应 Cl2O + 2N2O5 NO3Cl + NO2Cl + 2NO2 + O2 的可能历程是: N2O5 NO2 + NO3 (快平衡) NO2 + NO3 k 2 NO + O2 + NO2 (慢) NO + Cl2O k 3 NO2Cl + Cl (快) Cl + NO3 k 4 NO3Cl (快) 而 N2O5 分解历程如下: N2O5 NO2 + NO3 (快平衡) NO2 + NO3 k 2 NO + O2 + NO2 (慢) NO + NO3 k 3 2NO2 (快) 试求这两个反应的速度方程式,你能从这两个结果得出什么结论? 17. 2NO(g) + O2 2NO2(g)存在三种可能的机理,试写出每一种机理的分步反应,若反应 速率 v=kcNO 2 cO2,问上述反应按哪种机理进行? 18. N2O(g)的热分解反应为 2N2O(g) k 2N2(g) + O2(g),从实验测出不同温度时各个起 始压力与半衰期如下: 反应温度 T / K 967 967 1030 1030 初始压力 p0 / kPa 156.787 39.197 7.066 47.996 半衰期 t1/2 / s 380 1520 1440 212 k1 k-1 k1 k2
()求反应级数和两种温度下的速率常数 (2)求活化能E (3)若1030K时,NOg)的初始压力为54.00kP阳,求压力达64.00kPa时所需的时间。 19.反应Co(NHF2++HO—Co(NHs))s(HO)+F被酸催化。若反应速率公式为 rate=CoNH)sF2PHP,在一定温度及初始浓度条件下,测得分数衰期如下: 298 298 308 [Co(NHs)sF2(moldm-3 01 02 01 [H'](mol dm-) 0.0 00 tn×102/s 36 18 18 n×102/g 72 36 36 请计算(①)反应级数a和B的值 (2)不同温度下的反应速率常数 (③)反应实验活化能E值 20.N205分解反应的历程如下: ①N05→NO2+NO ②NO2+NO,NO+O,+NO, ③NO+NO3→2NO ()当用O:的生成速率表示反应速率时,试用稳态近似法证明:中20 (2)设反应②为决速步骤,反应①为快速平衡,用平衡态近似法写出反应的速率表达式 (3)在什么情况下,n=n? 21.己知反应2NO+O2一→2NO2,其r=NOO2,试写出一种符合该速率方程的反 应历程。 22.在生命系统中,酶在很多化学反应中粉演重要角色。一些酶的催化反应可以用如下的 Michaelis-Menten机理描述: E+S、一ESE+P,E为酶,S为受体,P为最终产物 忽略第二步的逆向速率,也可以假设酶和受体是很快达到平衡的。 (1)在285K温度下进行实验,实验中,初始的速率(P的生成)可由不同的受体浓度来 决定,维持酶的总浓度为15×10M(m0ldm ,可得到下图 ①当[S]很小时,曲线呈线性:当[很大时,曲线与横坐标平行,则速率接近常数 请证明该图与Michaelis-Menten机理是一致的 ②试写出速率常数购 ③当IS1=10X10厂+M时,初始谏率为名少? ④试求E+S ·S的平衡常数 (②)在31O水,重复相同的酶浓度,得到一相似的曲线,试计算ES转换成E和P时所需 要的活化能。 20
20 (1) 求反应级数和两种温度下的速率常数 (2) 求活化能 Ea (3) 若 1030K 时,N2O(g)的初始压力为 54.00kPa,求压力达 64.00kPa 时所需的时间。 19. 反应 Co(NH3)5F2+ + H2O H+ Co(NH3)5(H2O)3+ + F- 被酸催化。若反应速率公式为 rate = k[Co(NH3)5F2+] α [H+ ] β ,在一定温度及初始浓度条件下,测得分数衰期如下: 298 298 308 [Co(NH3)5F2+] (mol · dm3 ) 0.1 0.2 0.1 [H+ ] (mol · dm3 ) 0.01 0.02 0.01 t1/2×102 / s 36 18 18 t1/4×102 / s 72 36 36 请计算 (1) 反应级数 α 和 β 的值 (2) 不同温度下的反应速率常数 k (3) 反应实验活化能 Ea值 20. N2O5 分解反应的历程如下: ① N2O5 NO2 + NO3 ② NO2 + NO3 2 k NO + O2 + NO2 ③ NO + NO3 3 k 2NO2 (1) 当用 O2 的生成速率表示反应速率时,试用稳态近似法证明: 1 2 1 2 1 k 2k k k r [N2O5] (2) 设反应②为决速步骤,反应①为快速平衡,用平衡态近似法写出反应的速率表达式 r2。 (3) 在什么情况下,r1 = r2? 21. 已知反应 2NO + O2 2NO2,其 r = k[NO]2 [O2],试写出一种符合该速率方程的反 应历程。 22. 在生命系统中,酶在很多化学反应中扮演重要角色。一些酶的催化反应可以用如下的 Michaelis-Menten 机理描述: E + S ES 2 k E + P,E 为酶,S 为受体,P 为最终产物 忽略第二步的逆向速率,也可以假设酶和受体是很快达到平衡的。 (1) 在 285K 温度下进行实验,实验中, 初始的速率(P 的生成)可由不同的受体浓度来 决定,维持酶的总浓度为 1.5×10– 9 M (mol·dm3 ) 可得到下图 ① 当[S]很小时,曲线呈线性;当[S]很大时,曲线与横坐标平行,则速率接近常数, 请证明该图与 Michaelis-Menten 机理是一致的 ② 试写出速率常数 k2 ③ 当[S]= 1.0×10– 4 M 时,初始速率为多少? ④ 试求 E + S ES 的平衡常数 (2) 在 310K,重复相同的酶浓度,得到一相似的曲线,试计算 ES 转换成 E 和 P 时所需 要的活化能。 k-1 k1 k-1 k1