
的理论基础,可利用它来分析和解释具体问题 (2)在组分数的计算式C=S一R一R中,R是指独立存在的化学平衡数,若其中 一个反应可由其它反应组合得到,则不是独立的。例如在C(S)、CO(g)、C02(g)和 O2(g)组成的系统中可能存在反应:C(sH12)O2(g)=COg、C(s+02(g)CO2g、 (g)C02(g)等,但只有两个反应是独立的即 ()在组分数的计算式C=S一R一R中,其它浓度限制条件R通常是反应产生的 产物符合一定比例(仅对同相有效,通常指气相,固相一般不考虑)或者人为指定 而引起的个数 (4)关干相态撕卫的计算·与相不管有多少物质 也只有 一般只有一个相液体不分层时 一个 ,分层时 一层一相:固休物质不形成固休时一个周休 个相,形成固 溶体时与液相类似。若某相存在的量很少可以忽略不计时,则可不算,例如凝聚系 统不考虑气相。 (⑤)相律F-C一P+2式中的2表示系统的温度和压力对相平衡的影响。当温度或 S6-2单组分系统相图 (C=)平衡体系,根据相律有: F=C-P+2=3-P 变量可用T,p表示 为两相,F=1,若为三相,最小自由度F=0。所以单组分体系最多只能有三相共 存。 相图:达相平衡时相变点与T,p关系描在pT上构成的图,平面图。 一、 水的相平衡数据与相图 水的相态 析: 存在单独相态F=2:气体、液体、固体 存在两相平衡F=1: 熔化与凝固平衡过程:固体液体,饱和蒸气压随温度升高而降低(特殊*) 升华与凝华平衡过程:固体气体,饱和蒸气压随温度升高而升高 汽化与凝结平衡过程: 液体气体,饱和蒸气压随温度升高而升高 存在三 点0:固体 气体,温度0.01℃,压力610Pa。 2.水的相平衡实验数据与相图 将水气、冰水、水蒸气的平衡蒸气压与温度的实验数据作在pT图上描成连 续曲线,并进行相态的标注,即为水的相图,见图5一2-1。其中曲线 TB,水、气平衡即气化曲线 TC:冰、气 即化曲线 TA:冰、水平衡即升华曲线。 TD:过冷水曲线。 这三条曲线把相图分成三个区域,分别为气相区,液相区,固相区。 三条曲线的交点T为三相点:冰、水、气,是无变量系统,系统温度、压力为0.01 ℃,0.610kPa)不能变化 在相图中表示系统状态的点为系统点,例如O点为三相点,a点为(140℃ 101kP)。从相图上根据系统点的变化,很容易得到系统相态与温度和压力的关系
的理论基础,可利用它来分析和解释具体问题。 (2) 在组分数的计算式C=S-R-R'中,R是指独立存在的化学平衡数,若其中 一个反应可由其它反应组合得到,则不是独立的。例如在C(s)、CO(g)、CO2(g)和 O2(g)组成的系统中可能存在反应:C(s)+(1/2)O2(g)=CO(g)、C(s)+O2(g)=CO2(g)、 C(s)+CO2(g)=2CO(g)、CO(g)+(1/2)O2(g)=CO2(g)等,但只有两个反应是独立的即 R=2,因为其中两个反应通过加减组合可得到其它反应。 (3) 在组分数的计算式C=S-R-R'中,其它浓度限制条件R'通常是反应产生的 产物符合一定比例(仅对同相有效,通常指气相,固相一般不考虑)或者人为指定 而引起的个数 (4) 关于相态数P的计算: 气相不管有多少物质,一般只有一个相; 液体不分层时 也只有一个相,分层时一层一相; 固体物质不形成固溶体时一个固体一个相,形成固 溶体时与液相类似。若某相存在的量很少可以忽略不计时,则可不算,例如凝聚系 统不考虑气相。 (5) 相律F=C-P+2式中的2表示系统的温度和压力对相平衡的影响。当温度或 压力之一固定不变(即指定)时,只有一个强度量可变(压力或温度),相律计算 式变为F=C-P+1。当系统的状态受到有n个强度性质影响时,相律变为F=C-P+n。 §6-2 单组分系统相图 单组分(C=1)平衡体系,根据相律有: F=C-P+2=3-P 因系统最少为1相(相数P=1), F=3-1=2,变量可用T,p表示。 为两相,F=1,若为三相,最小自由度F=0。所以单组分体系最多只能有三相共 存。 相图:达相平衡时相变点与T,p关系描在p-T上构成的图,平面图。 一、 水的相平衡数据与相图 1. 水的相态分析: 存在单独相态F=2: 气体、液体、固体 存在两相平衡F=1: 熔化与凝固平衡过程: 固体 液体,饱和蒸气压随温度升高而降低(特殊*) 升华与凝华平衡过程: 固体 气体,饱和蒸气压随温度升高而升高 汽化与凝结平衡过程: 液体 气体,饱和蒸气压随温度升高而升高 存在三相点F=0:固体 液体 气体,温度0.01℃,压力610Pa。 2.水的相平衡实验数据与相图 将水 气、冰水、水蒸气的平衡蒸气压与温度的实验数据作在p-T图上描成连 续曲线,并进行相态的标注,即为水的相图,见图5-2-1。其中曲线 TB:水、气平衡即气化曲线。 TC:冰、气平衡即熔化曲线。 TA:冰、水平衡即升华曲线。 TD:过冷水曲线。 这三条曲线把相图分成三个区域,分别为气相区,液相区,固相区。 三条曲线的交点T为三相点:冰、水、气,是无变量系统,系统温度、压力为(0.01 ℃,0.610kPa)不能变化。 在相图中表示系统状态的点为系统点,例如O点为三相点,a点为(140℃, 101kPa)。从相图上根据系统点的变化,很容易得到系统相态与温度和压力的关系
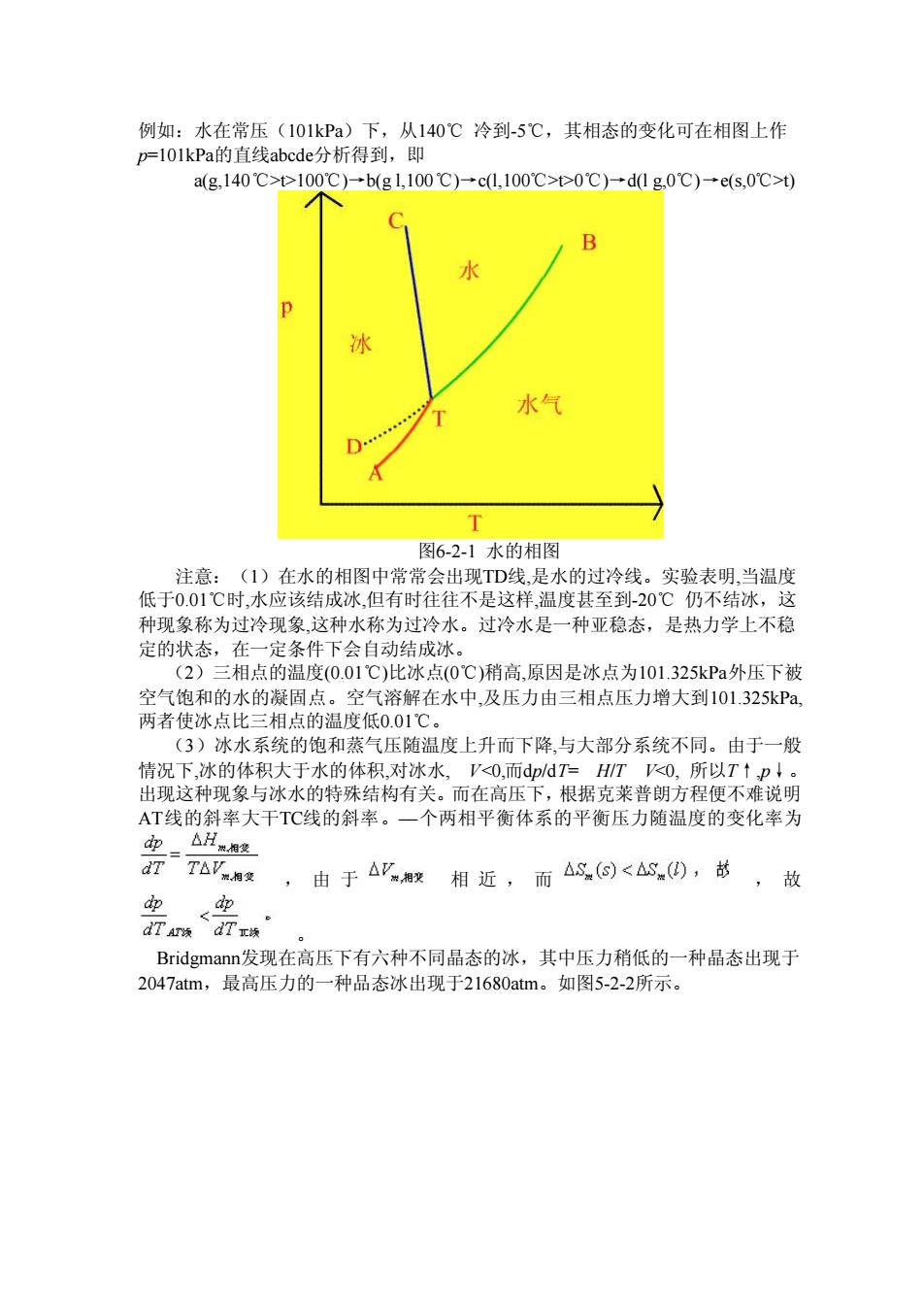
例如:水在常压(101kPa)下,从140℃冷到-5℃,其相态的变化可在相图上作 p=l01kPa的直线abcde分析得到,即 a(g140℃>>100C)-b(gl,100℃)-cl,100℃>>0℃)-d1g0℃)→e(s,0℃>0) 水 水气 图6-2-1水的相图 注意:(1)在水的相图中常常会出现TD线,是水的过冷线。实验表明,当温度 低于0.01℃时,水应该结成冰,但有时往往不是这样,温度甚至到-20℃仍不结冰,这 种现象称为村冷现象这种水称为过冷水。时冷水是一种亚稳态,是热力学上不稳 定的状态, 一定条件下会自动结成冰 (2 相点的温度(0.01℃)比冰点(0℃)稍高,原因是冰点为101.325kPa外压下被 空气饱和的水的凝固点。空气溶解在水中,及压力由三相点压力增大到101.325kP, 两者使冰点比三相点的温度低0.01℃。 (3)冰水系统的饱和蒸气压随温度上升而下降,与大部分系统不同。由于一般 情况下,冰的体积大于水的体积对冰水 0而。 HT0,所以Tt 这种 现象与冰水日 殊结构有关 而在高压 根据克莱普朗 程便不 AT线的斜率大干TC线的斜率。一个两相平衡体系的平衡压力随温度的变化率为 d迎_△H相 ,由于△相近,而△<,苏 ,故 中 dTamnd7x株 Bridgmann2发现在高压下有六种不同品态的冰,其中压力稍低的一种晶态出现于 2047atm,最高压力的一种品态冰出现于21680atm。如图5-2-2所示
例如:水在常压(101kPa)下,从140℃ 冷到-5℃,其相态的变化可在相图上作 p=101kPa的直线abcde分析得到,即 a(g,140℃>t>100℃)→b(g l,100℃)→c(l,100℃>t>0℃)→d(l g,0℃)→e(s,0℃>t) 图6-2-1 水的相图 注意:(1)在水的相图中常常会出现TD线,是水的过冷线。实验表明,当温度 低于0.01℃时,水应该结成冰,但有时往往不是这样,温度甚至到-20℃ 仍不结冰,这 种现象称为过冷现象,这种水称为过冷水。过冷水是一种亚稳态,是热力学上不稳 定的状态,在一定条件下会自动结成冰。 (2)三相点的温度(0.01℃)比冰点(0℃)稍高,原因是冰点为101.325kPa外压下被 空气饱和的水的凝固点。空气溶解在水中,及压力由三相点压力增大到101.325kPa, 两者使冰点比三相点的温度低0.01℃。 (3)冰水系统的饱和蒸气压随温度上升而下降,与大部分系统不同。由于一般 情况下,冰的体积大于水的体积,对冰水, V<0,而dp/dT= H/T V<0, 所以T↑,p↓。 出现这种现象与冰水的特殊结构有关。而在高压下,根据克莱普朗方程便不难说明 AT线的斜率大干TC线的斜率。— 个两相平衡体系的平衡压力随温度的变化率为 , 由 于 相 近 , 而 , 故 。 Bridgmann发现在高压下有六种不同晶态的冰,其中压力稍低的一种晶态出现于 2047atm,最高压力的一种品态冰出现于21680atm。如图5-2-2所示
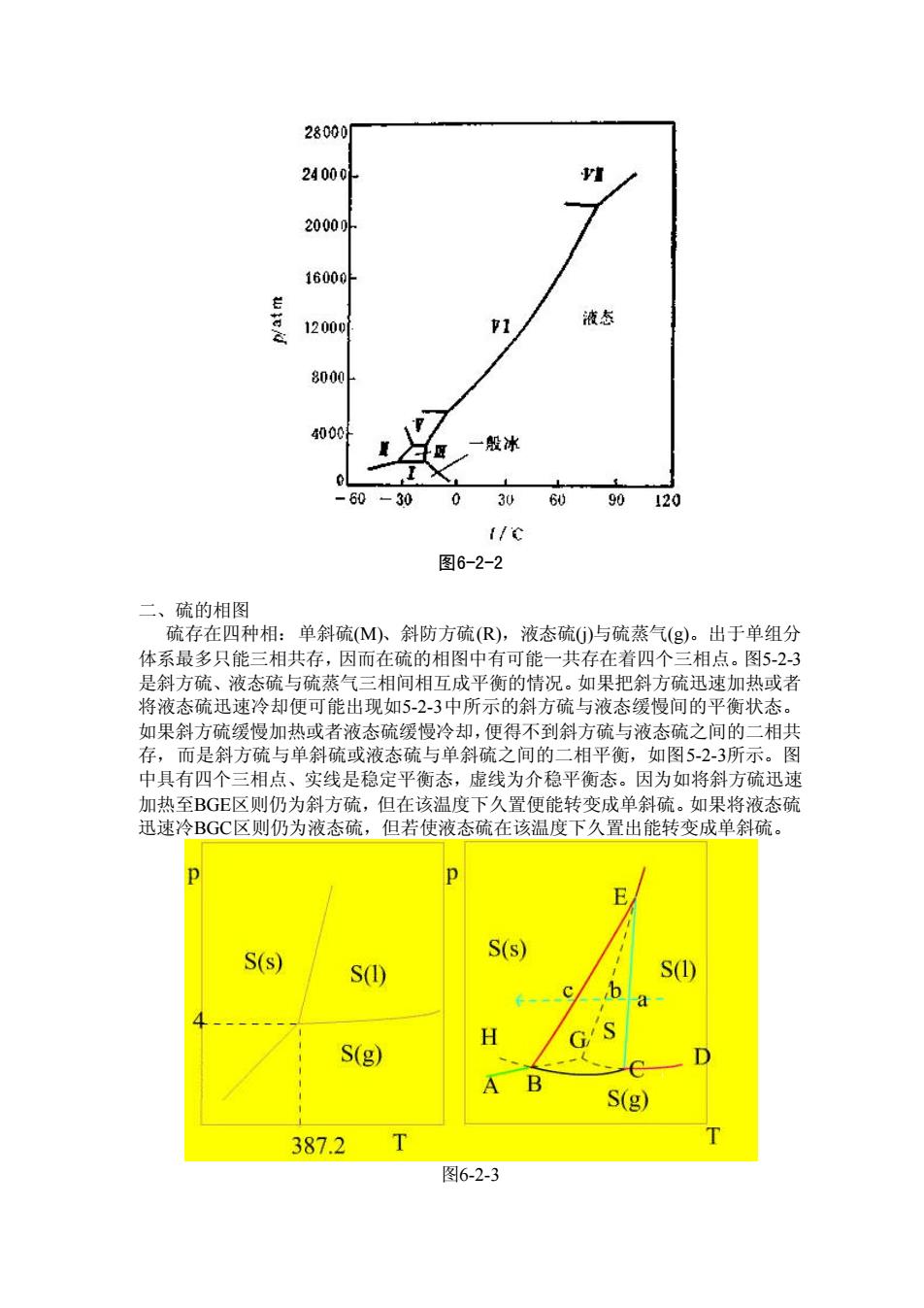
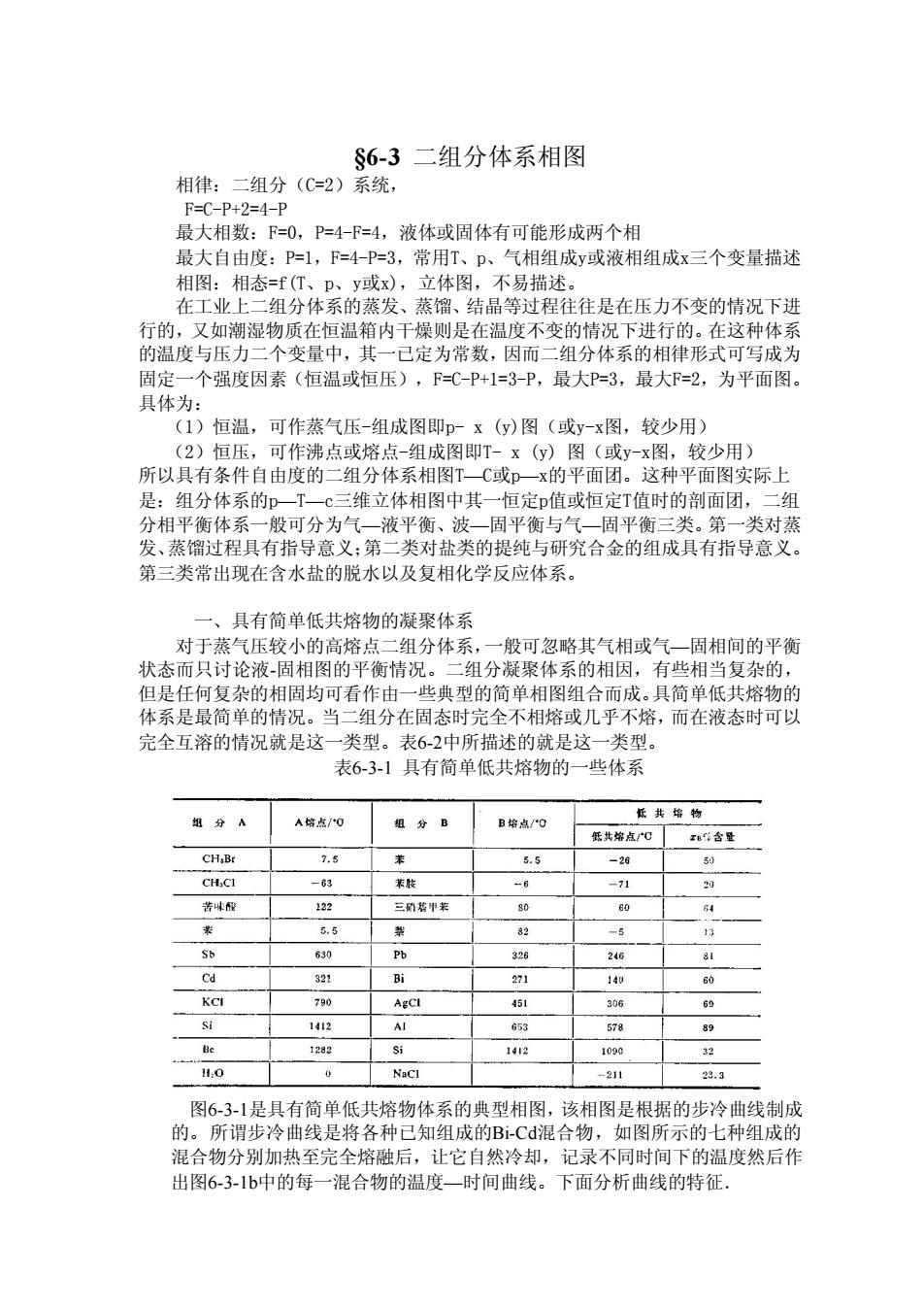
28000 2400 1600 1200c 1 液态 8000 4000 / 一般冰 I 60 -30 0 30 90120 I/C 图6-2-2 二、硫的相图 硫存在四种相:单斜硫(M)、斜防方硫(R),液态硫G)与硫蒸气(g)。出于单组分 体系最多只能三相共存,因而在硫的相图中有可能一共存在若四个三相点。图5-23 平衡状态 如果斜方硫缓慢加热或者液态硫缓慢冷却,便得不到斜方硫与液态硫之间的二相共 存,而是斜方硫与单斜硫或液态硫与单斜硫之间的二相平衡,如图5-2-3所示。图 中具有四个三相点、实线是稳定平衡态,虚线为介稳平衡态。因为如将斜方硫迅速 加热至BGE区则仍为斜方硫,但在该温度下久置便能转变成单斜硫。如果将液态硫 迅速冷BGC区则仍为液态硫,但若使液态硫在该温度下久置出能转变成单斜硫 E S(s) S(s) S① S c b G'S S(g) B S(g) 387.2 人 图6-2-3
图6-2-2 二、硫的相图 硫存在四种相:单斜硫(M)、斜防方硫(R),液态硫(j)与硫蒸气(g)。出于单组分 体系最多只能三相共存,因而在硫的相图中有可能一共存在着四个三相点。图5-2-3 是斜方硫、液态硫与硫蒸气三相间相互成平衡的情况。如果把斜方硫迅速加热或者 将液态硫迅速冷却便可能出现如5-2-3中所示的斜方硫与液态缓慢间的平衡状态。 如果斜方硫缓慢加热或者液态硫缓慢冷却,便得不到斜方硫与液态硫之间的二相共 存,而是斜方硫与单斜硫或液态硫与单斜硫之间的二相平衡,如图5-2-3所示。图 中具有四个三相点、实线是稳定平衡态,虚线为介稳平衡态。因为如将斜方硫迅速 加热至BGE区则仍为斜方硫,但在该温度下久置便能转变成单斜硫。如果将液态硫 迅速冷BGC区则仍为液态硫,但若使液态硫在该温度下久置出能转变成单斜硫。 图6-2-3
S6-3二组分体系相图 相律:二组分(C=2)系统, F=C-P+2=4-P 最大相数:F=0,P=4-F=4,液体或固体有可能形成两个相 最大自由度:P=1,F=4-P=3,常用T、D、气相组成y或液相组成x三个变量描述 相图:相态=f(T、 Dy或x),立体图, 不易描述。 在工业上 组分体系的蒸发 蒸馏、结晶等过程往往是在压力不变的情况下进 行的,又如潮湿物质在恒温箱内干燥则是在温度不变的情况下进行的。在这种体系 的温度与压力二个变量中,其一已定为常数,因而二组分体系的相律形式可写成为 固定一个强度因素(恒温或恒压),F=C-P+1=3-P,最大P=3,最大F=2,为平面图。 且休为 (1)恒温,可作蒸气压-组成图即px(y)图(或y-x图,较少用) (2)恒压,可作沸点或熔点-组成图即T-x(y)图(或y-x图,较少用 所以具有条件自由度的二组分体系相图T一C或D一x的平面团。这种平面图实际上 是:组分体系的p一T一c三维立体相图中其一恒定值或恒定T值时的剖面团,二组 分相平衡体系一般可分为气一液平衡、波一固平衡与气固平衡三类。第一类对蒸 发、蒸馏过程具有指导意义:第二类对盐类的提纯与研究合金的组成具有指导意义 第三类常出现在含水盐的脱水以及复相化学反应体系。 “、具有简单低共塔物的凝聚体系 对于蒸气压较小的高熔点二组分体 一般可忽略其气相或气一固相间的平 状态而只讨论液-固相图的平衡情 但是任何复杂的相 二组分凝聚体系的相因,有些相当复杂的, 固均 看作 些典型的简单相图组合 而成。具简单低共熔物 体系是最简单的情况。当二组分在同态时完全 不相熔或儿乎不熔,而在液态时可以 完全互溶的情况就是这一类型。表6-2中所描述的就是这一类型。 表6-3-1具有简单低共熔物的一些体系 组分A A格点/0 组分B 共物 D点/0 低共点0 CH:Be -71 0 122 80 6,5 82 -5 630 326 246 301 B时 1 14 KC 282 112 1G90 3红 140 23.3 图6-31是具有简单低共熔物体系的典型相图,该相图是根据的步冷曲线制成 的。所谓步冷曲线是将各种己知组成的Bi-Cd混合物,如图所示的七种组成的 混合物分别加热至完全熔融后,让它自然冷却,记录不同时间下的温度然后作 出图63-1b中的每一混合物的温度 一时间曲线。 下面分析曲线的特征
§6-3 二组分体系相图 相律:二组分(C=2)系统, F=C-P+2=4-P 最大相数:F=0,P=4-F=4,液体或固体有可能形成两个相 最大自由度:P=1,F=4-P=3,常用T、p、气相组成y或液相组成x三个变量描述 相图:相态=f(T、p、y或x),立体图,不易描述。 在工业上二组分体系的蒸发、蒸馏、结晶等过程往往是在压力不变的情况下进 行的,又如潮湿物质在恒温箱内干燥则是在温度不变的情况下进行的。在这种体系 的温度与压力二个变量中,其一已定为常数,因而二组分体系的相律形式可写成为 固定一个强度因素(恒温或恒压),F=C-P+1=3-P,最大P=3,最大F=2,为平面图。 具体为: (1)恒温,可作蒸气压-组成图即p- x (y)图(或y-x图,较少用) (2)恒压,可作沸点或熔点-组成图即T- x (y) 图(或y-x图,较少用) 所以具有条件自由度的二组分体系相图T— C或p— x的平面团。这种平面图实际上 是:组分体系的p— T— c三维立体相图中其一恒定p值或恒定T值时的剖面团,二组 分相平衡体系一般可分为气— 液平衡、波— 固平衡与气— 固平衡三类。第一类对蒸 发、蒸馏过程具有指导意义;第二类对盐类的提纯与研究合金的组成具有指导意义。 第三类常出现在含水盐的脱水以及复相化学反应体系。 一、具有简单低共熔物的凝聚体系 对于蒸气压较小的高熔点二组分体系,一般可忽略其气相或气— 固相间的平衡 状态而只讨论液-固相图的平衡情况。二组分凝聚体系的相因,有些相当复杂的, 但是任何复杂的相固均可看作由一些典型的简单相图组合而成。具简单低共熔物的 体系是最简单的情况。当二组分在固态时完全不相熔或几乎不熔,而在液态时可以 完全互溶的情况就是这一类型。表6-2中所描述的就是这一类型。 表6-3-1 具有简单低共熔物的一些体系 图6-3-1是具有简单低共熔物体系的典型相图,该相图是根据的步冷曲线制成 的。所谓步冷曲线是将各种已知组成的Bi-Cd混合物,如图所示的七种组成的 混合物分别加热至完全熔融后,让它自然冷却,记录不同时间下的温度然后作 出图6-3-1b中的每一混合物的温度— 时间曲线。下面分析曲线的特征.
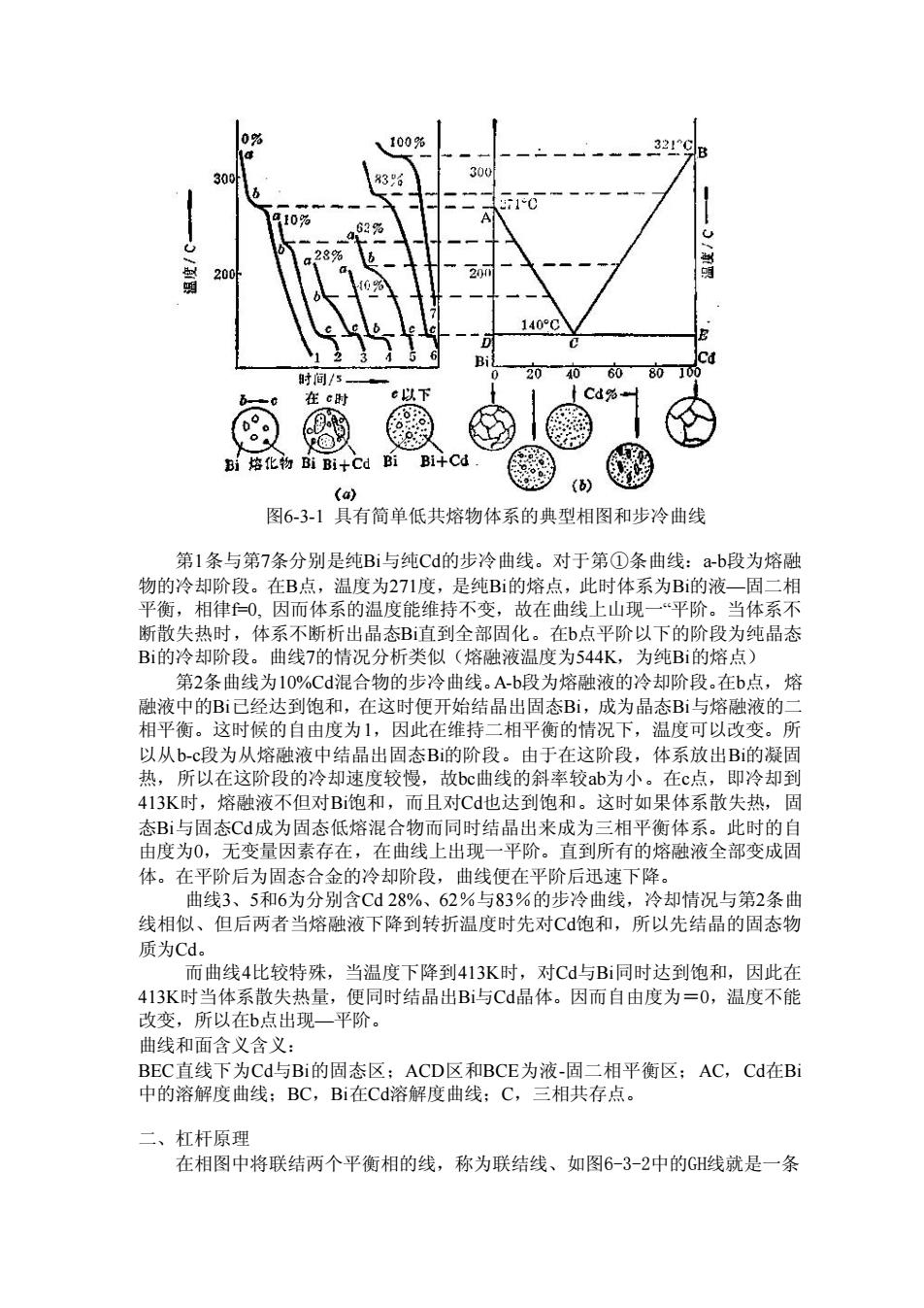
321 140 时间/5 格的BiB1+Cd Bi Bi-4Cd Lo) 图6-3-1具有简单低共熔物体系的典型相图和步冷曲线 第1条与第7条分别是纯Bi与纯C的步冷曲线。对于第①条曲线:a-b段为熔融 物的冷却阶段。在B点,温度为271度,是纯B的熔点,此时体系为B的液一固二有 平衡,相律0,因而体系的温度能维持不变,故在曲线上山现一“平阶。当体系不 断散失热时,体系不断析出晶态B直到全部固化。在b点平阶以下的阶段为纯晶态 B的冷却阶段。曲线7的情况分析类似(熔融液温度为544K,为纯B的熔点) 第2条曲线为10%C混合物的步冷曲线。A-b段为熔融液的冷却阶段。在b点,熔 融液中的B已经达到饱和,在这时便开女 晶出周 成为晶态B1与格 平衡。这时候的自由度为,因此在维持三相平衡的情况下温度花李, 以从b-c段为从熔融液中结品出固态B的阶段。由于在这阶段,体系放出B的凝固 热,所以在这阶段的冷却速度较慢,故bc曲线的斜率较ab为小。在c点,即冷却到 413K时,熔融液不但对B饱和,而且对C也达到饱和。这时如果体系散失热,固 态Bi与固态C成为固态低熔混合物而同时结晶出来成为三相平衡体系。此时的自 由度为0, 无变量因素存在,在曲线上出现 平阶。直到所有的熔融液全部变成居 体。在平阶后为固态合金的冷却阶段,曲线便在平阶后迅速下降。 曲线3、5和6为分别含Cd28%、62%与83%的步冷曲线,冷却情况与第2条曲 线相似、但后两者当熔融液下降到转折温度时先对C饱和,所以先结晶的固态物 质为cd。 万曲线4比较特殊 ,当温度下降到413K时 ,对Cd与Bi同时达到饱和,因此在 413K时当体系散失热量,便同时结晶出B与Cd晶体。因而自由度为=0,温度不能 改变,所以在b点出现一平阶。 曲线和面含义含义: BEC直线下为Cd与Bi的周态区;ACD区和BCE为液-周二相平衡区;AC,Cd在Bi 中的溶解度曲线: BC ,Bi在Cd溶解度曲线;C, 相共存点 二、杠杆原理 在相图中将联结两个平衡相的线,称为联结线、如图6-3-2中的GH线就是一条
图6-3-1 具有简单低共熔物体系的典型相图和步冷曲线 第1条与第7条分别是纯Bi与纯Cd的步冷曲线。对于第①条曲线:a-b段为熔融 物的冷却阶段。在B点,温度为271度,是纯Bi的熔点,此时体系为Bi的液— 固二相 平衡,相律f=0, 因而体系的温度能维持不变,故在曲线上山现一“平阶。当体系不 断散失热时,体系不断析出晶态Bi直到全部固化。在b点平阶以下的阶段为纯晶态 Bi的冷却阶段。曲线7的情况分析类似(熔融液温度为544K,为纯Bi的熔点) 第2条曲线为10%Cd混合物的步冷曲线。A-b段为熔融液的冷却阶段。在b点,熔 融液中的Bi已经达到饱和,在这时便开始结晶出固态Bi,成为晶态Bi与熔融液的二 相平衡。这时候的自由度为1,因此在维持二相平衡的情况下,温度可以改变。所 以从b-c段为从熔融液中结晶出固态Bi的阶段。由于在这阶段,体系放出Bi的凝固 热,所以在这阶段的冷却速度较慢,故bc曲线的斜率较ab为小。在c点,即冷却到 413K时,熔融液不但对Bi饱和,而且对Cd也达到饱和。这时如果体系散失热,固 态Bi与固态Cd成为固态低熔混合物而同时结晶出来成为三相平衡体系。此时的自 由度为0,无变量因素存在,在曲线上出现一平阶。直到所有的熔融液全部变成固 体。在平阶后为固态合金的冷却阶段,曲线便在平阶后迅速下降。 曲线3、5和6为分别含Cd 28%、62%与83%的步冷曲线,冷却情况与第2条曲 线相似、但后两者当熔融液下降到转折温度时先对Cd饱和,所以先结晶的固态物 质为Cd。 而曲线4比较特殊,当温度下降到413K时,对Cd与Bi同时达到饱和,因此在 413K时当体系散失热量,便同时结晶出Bi与Cd晶体。因而自由度为=0,温度不能 改变,所以在b点出现— 平阶。 曲线和面含义含义: BEC直线下为Cd与Bi的固态区;ACD区和BCE为液-固二相平衡区;AC,Cd在Bi 中的溶解度曲线;BC,Bi在Cd溶解度曲线;C,三相共存点。 二、杠杆原理 在相图中将联结两个平衡相的线,称为联结线、如图6-3-2中的GH线就是一条