
第二部分电解与极化作用 (electrolysis and polarization) 教学 分解电压,极化作用,极化曲线电化学极化与氢的超电势,金屈的析出,金 内容 属离子的分离和共同沉积,电解还原与氧化:金属的腐蚀与防腐,化学电源 电化学基础研究的前沿领域:表面(界面)电化学,电催化,生物电化学 电化学传感器,半导体(光)电化学,谱学电化学,化学修饰电极 教学 掌握电化动力学的一般原理,使学生掌握电化学的基本理论和技能。为后续 目的:专业课的学习奠定坚实的理论基础。 教学 讲解法, 万法: 教学 电化教学 手段: 教学 分解电压:极化作用:电解时电极上的反应 重点 教学 金属的电化学腐蚀与防腐:化学电源 难点 课时 8学时 分配: 7-6电解池分解电压 (decompostion voltage of electrochemical cells) 电解池与原电池 原电池:将化学能转变为电能的装置 电解池:将电能转变为化学能的装置 在一定条件下二者可以相互转化。如将要接触到的二次电池
第二部分 电解与极化作用 (electrolysis and polarization) 教学 内容 分解电压,极化作用,极化曲线 电化学极化与氢的超电势,金属的析出,金 属离子的分离和共同沉积,电解还原与氧化; 金属的腐蚀与防腐,化学电源 电化学基础研究的前沿领域:表面(界面)电化学,电催化,生物电化学, 电化学传感器,半导体(光)电化学,谱学电化学,化学修饰电极 教学 目的: 掌握电化动力学的一般原理, 使学生掌握电化学的基本理论和技能。为后续 专业课的学习奠定坚实的理论基础。 教学 方法: 讲解法, 教学 手段: 电化教学 教学 重点: 分解电压; 极化作用; 电解时电极上的反应 教学 难点: 金属的电化学腐蚀与防腐; 化学电源 课时 分配: 8学时 7-6电解池分解电压 (decompostion voltage of electrochemical cells) 电解池与原电池; 原电池:将化学能转变为电能的装置 电解池:将电能转变为化学能的装置 在一定条件下二者可以相互转化。如将要接触到的二次电池

本章主要讨论电解池 理论分解电压使某电解质溶液能连续不断发生电解时所必须外加的最小电压 理论分解电压在数值上等于该电解池作为可逆电池时的可逆电动势。 分解电压的测定 使用Pt电极电解H20,加入中性盐用来导电,实验装置如图所示。逐渐增加外加电 压,由安培计G和伏特计V分别测定线路中的电流强度I和电压E,画出I-E曲线 -110 分解电压的测定 b下 倒定分解电压时的电洗一电屈尚线 分解电压的实验测定外加电压很小时,几乎无电流通过,阴、阳极上无2气和氧气 随着E的增大, 电极表面产生少量氢气和氧气,但压力低于大气压,无法逸出 实生的氢气和氧气成了原电池,外加电压必须克服这反电动办 继续增加电压, 有少午增加,如图中1-2段。当外压增至2-3段,氢气和氧气的压力等于大气压力,呈 气泡逸出,反电动势达极大值Eb,max。再增加电压,使I迅速增加。将直线外延至I=0 处,得E(分解)值,这是使电解池不断工作所必需外加的最小电压,称为分解电压。 实际分解电压要使电解池顺利地进行连续反应,除了克服作为原电池时的可逆电动势 外,还要克服由于极化在阴、阳极上产生的超电势,以及克服电池电阻所产生的电位 降。这三者的加和就称为实际分解电压。所以分解电压的数值会随着通入电流强度的 增加而增加
本章主要讨论电解池 理论分解电压 使某电解质溶液能连续不断发生电解时所必须外加的最小电压. 理论分解电压在数值上等于该电解池作为可逆电池时的可逆电动势. 分解电压的测定 使用Pt电极电解H2O,加入中性盐用来导电,实验装置如图所示。逐渐增加外加电 压,由安培计G和伏特计V分别测定线路中的电流强度I 和电压E,画出I-E曲线 分解电压的实验测定 外加电压很小时,几乎无电流通过,阴、阳极上无H2气和氧气 放出。随着E的增大,电极表面产生少量氢气和氧气,但压力低于大气压,无法逸出。 所产生的氢气和氧气构成了原电池,外加电压必须克服这反电动势,继续增加电压,I 有少许增加,如图中1-2段。当外压增至2-3段,氢气和氧气的压力等于大气压力,呈 气泡逸出,反电动势达极大值 Eb,max。再增加电压,使I 迅速增加。将直线外延至I =0 处,得E(分解)值,这是使电解池不断工作所必需外加的最小电压,称为分解电压。 实际分解电压 要使电解池顺利地进行连续反应,除了克服作为原电池时的可逆电动势 外,还要克服由于极化在阴、阳极上产生的超电势,以及克服电池电阻所产生的电位 降。这三者的加和就称为实际分解电压。所以分解电压的数值会随着通入电流强度的 增加而增加

小结 7-7极化作用 (Polarization) 当电极处于平衡状态,电极上无电流通过时,这时的电极电势分别称为阳极平衡 电势和阴极平衡电势.在有电流通过时,随着电极上电流密度的增加 电极实际分解电 势值对平衡值的偏离也愈来愈大,这种对平衡电势的偏离现象称为电极的极化。 极化产生的原因 根据极化产生的不同原因,通常把极化大致分为两类:浓差极化和电化学极化(1) 浓差极化:在电解过程中,电极附近某离子浓度由于电极反应而发生变化,本体溶液 中离子扩散的速度又赶不 上弥补这个变化,就导致电极附近溶液的浓度与本体溶液间 有一个浓度梯度,这种浓度差别引起的电极电势的改变称为浓差极化,用搅拌和升温 的方法可以减少浓差极化,但也可以利用滴汞电极上的浓差极化进行极谱分析。(2) 电化学极化:电极反应总是分若干步进行,若其中一步反应速率较慢,需要较高的活 化能,为了使电极反应顺利进行所额外施加的电压称为电化学超电势(亦称为活化超 电势),这种极化现象称为电化学极化。 超电势(overpotential) 在某一电流密度下,实际发生电解的电极电势与平衡电极电势之间的差值称为超电势。 阳极上由于超电势使电极电势变大,阴极上由于超电势使电极电势变小。为了使超电 E阳不可逆)=E(阳平)+阳) 极化曲线(polarization curve))(,),XEEr-阳阳不可阳逆平()En=+平阳阳 阴)=E(阴,平)-E阴,不可逆) 阳)=E(阳,不可逆)-E(阳,平) 超电势或电极电势与电流密度之间的关系曲线称为极化曲线,极化曲线的形状和变化 规律反映了电化学过程的动力学特征。 梦电的发电的电的电 化曲线随着电流密度的增大,两电极上的超电势也增大,阳极 电解也 电解地中两电城的械化南线
小结 7-7 极化作用 (Polarization) 当电极处于平衡状态,电极上无电流通过时,这时的电极电势分别称为阳极平衡 电势和阴极平衡电势.在有电流通过时,随着电极上电流密度的增加,电极实际分解电 势值对平衡值的偏离也愈来愈大,这种对平衡电势的偏离现象称为电极的极化。 极化产生的原因 根据极化产生的不同原因,通常把极化大致分为两类:浓差极化和电化学极化(1) 浓差极化:在电解过程中,电极附近某离子浓度由于电极反应而发生变化,本体溶液 中离子扩散的速度又赶不上弥补这个变化,就导致电极附近溶液的浓度与本体溶液间 有一个浓度梯度,这种浓度差别引起的电极电势的改变称为浓差极化,用搅拌和升温 的方法可以减少浓差极化,但也可以利用滴汞电极上的浓差极化进行极谱分析。(2) 电化学极化:电极反应总是分若干步进行,若其中一步反应速率较慢,需要较高的活 化能,为了使电极反应顺利进行所额外施加的电压称为电化学超电势(亦称为活化超 电势),这种极化现象称为电化学极化。 超电势(overpotential) 在某一电流密度下,实际发生电解的电极电势与平衡电极电势之间的差值称为超电势。 阳极上由于超电势使电极电势变大,阴极上由于超电势使电极电势变小。 为了使超电 势都是正值,把阴极超电势和阳极超电势分别定义为: 极化曲线(polarization curve) ()(,),)(EEη=−阳阳不可阳逆平 ((,()) Eη=+平阳阳 超电势或电极电势与电流密度之间的关系曲线称为极化曲线,极化曲线的形状和变化 规律反映了电化学过程的动力学特征。 (1)电解池中两电极的极化曲线随着电流密度的增大,两电极上的超电势也增大,阳极 析出电势变大,阴极析出电势变小,使外加的电压增加,额外消耗了电能
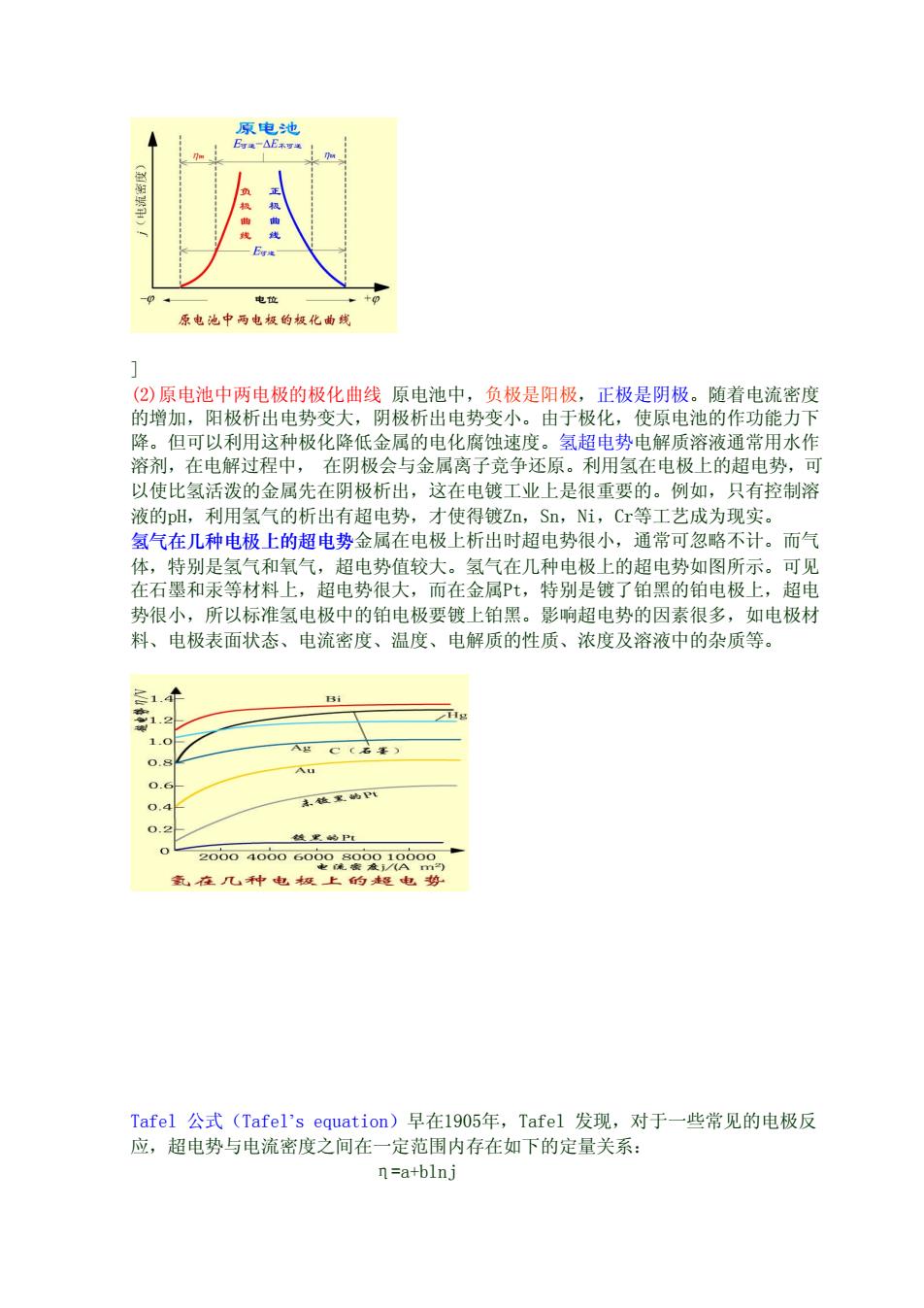
原电池 电位 原电池中两电投的化曲 (2)原电池中两电极的极化曲线原电池中,负极是阳极 正极是阴极。随着电流密度 的增加,阳极析出电 分变大, 阴极析出电势变小。由于极化,使原电池的作功能力】 降。但可以利用这种极化降低金属的电化腐蚀速度。氢超电势电解质溶液通常用水作 溶剂,在电解过程中,在阴极会与金属离子竞争还原。利用氢在电极上的超电势,可 以使比氢活泼的金属先在阴极析出,这在电镀工业上是很重要的。例如,只有控制溶 液的H,利用氢气的析出有超电势,才使得镀Z, Sn,Ni,Cr等工艺成为现实 氢气在几种电极上的超电势金属在电极上析出时超电势很小,通常可忽略不计。而 体,特别是氢气和氧气,超电势值较大。氢气在几种电极上的超电势如图所示。可见 在石墨和汞等材料上,超电势很大,而在金属Pt,特别是镀了铂黑的铂电极上,超电 势很小,所以标准氢电极中的铂电极要镀上铂黑。影响超电势的因素很多,如电极材 料、电极表面状态、电流密度、温度、电解质的性质、浓度及溶液中的杂质等。 Bi 1. 1. 精文的四 Tafel公式(Tafel's equation)早在1905年,Tafel发现,对于一些常见的电极反 应,超电势与电流密度之间在一定范围内存在如下的定量关系: n=a+blnj
] (2)原电池中两电极的极化曲线 原电池中,负极是阳极,正极是阴极。随着电流密度 的增加,阳极析出电势变大,阴极析出电势变小。由于极化,使原电池的作功能力下 降。但可以利用这种极化降低金属的电化腐蚀速度。氢超电势电解质溶液通常用水作 溶剂,在电解过程中, 在阴极会与金属离子竞争还原。利用氢在电极上的超电势,可 以使比氢活泼的金属先在阴极析出,这在电镀工业上是很重要的。例如,只有控制溶 液的pH,利用氢气的析出有超电势,才使得镀Zn,Sn,Ni,Cr等工艺成为现实。 氢气在几种电极上的超电势金属在电极上析出时超电势很小,通常可忽略不计。而气 体,特别是氢气和氧气,超电势值较大。氢气在几种电极上的超电势如图所示。可见 在石墨和汞等材料上,超电势很大,而在金属Pt,特别是镀了铂黑的铂电极上,超电 势很小,所以标准氢电极中的铂电极要镀上铂黑。影响超电势的因素很多,如电极材 料、电极表面状态、电流密度、温度、电解质的性质、浓度及溶液中的杂质等。 Tafel 公式(Tafel’s equation)早在1905年,Tafel 发现,对于一些常见的电极反 应,超电势与电流密度之间在一定范围内存在如下的定量关系: η=a+blnj

这就称为Tafel公式。式中j是电流密度 是单位电流密度时的超电势值,与电极 材料、表面状态、溶液组成和温度等因索有关,是超电势值的决定因素。在常温下 一般等于。 7-8电解时电极上的反应 阴极上的反应 电解时阴极上发生还原反应。发生还原的物质通常有(1)金属离子,(2) 氢离子(中性水溶液中 )。判断在阴极上首先析出何种物质,应把可能发生还原 物质的电极电势计算出米,同时考虑它的超电势。电极电势最大的首先在阴极析出。 阳极上的反应电解时阳极上发生氧化反应。发生氧化的物质通常有:(1)阴离子, (2)阳极本身发生氧化 判断在阳极上 先发生 么反应. 拉把可能发生氧化物质的电极电势计算出来,同时 要考虑它的超电势。电极电势最小的首先在阳极氧化。 EOD- E(HH)=- RT 、1 -n 分解电压确定了阳极、阴极析出的物质后,将两者的析出电势相减,就得到了实际 分解电压。因为电解池中阳极是正极,电极电势较高,所以用阳极析出电势减去阴极 析出电势 水溶液时,由于或的析出,会改变或的浓度, 计算电极电势 时应把这个因素考虑进去。 分解电压=E(阳极,析出)-E阴极,析出) 金屈离子的分离 如果溶液中含有多个析出电势不同的金属离子,可以控制外加电压的大小,使金属离 子分步析出而达到分离的目的 为了使分离效果较好,后 种离子反应时,前一种离子的活度应减少到以下,这样 要求两种离子的析出电势相差一定的数值。 由醒的成用 阴极产品:电镀、金属提纯、保护、产品的美化(包括金属、塑料)和制备 及有机 物的还原产物等。阳极产品:铝合金的氧化和着色、制备氧气、双氧水、氯气以及有 机物的氧化产物等。常见的电解制备有氯碱工业、由丙烯腈制乙二腈、用硝基苯制苯 胺等。 7-9金属的电化学腐蚀和防腐 金属腐蚀分类: (1)化学腐蚀 金属表面与介质如气体或非电解质液体等因发生化学作用而引起的 图蚀,称为化学临蚀。化学腐蚀作用进行时无电流产生 (2)电化 金屈 质如 电解质溶液等,因形成微电池 作为阳极发生氧化而使金属发生腐蚀。这种由于电化学作用引起的腐蚀称为电化学腐 电化学腐蚀实例带有铁铆钉的铜板若暴露在空气中,表面被潮湿空气或雨水浸润
这就称为Tafel 公式。式中 j 是电流密度, 是单位电流密度时的超电势值,与电极 材料、表面状态、溶液组成和温度等因素有关, 是超电势值的决定因素。 在常温下 一般等于 。 7-8 电解时电极上的反应 阴极上的反应 电解时阴极上发生还原反应。发生还原的物质通常有(1)金属离子,(2) 氢离子(中性水溶液中 )。判断在阴极上首先析出何种物质,应把可能发生还原 物质的电极电势计算出来,同时考虑它的超电势。电极电势最大的首先在阴极析出。 阳极上的反应 电解时阳极上发生氧化反应。发生氧化的物质通常有:(1)阴离子, 如 等,(2)阳极本身发生氧化。 判断在阳极上首先发生什么反应,应把可能发生氧化物质的电极电势计算出来,同时 要考虑它的超电势。电极电势最小的首先在阳极氧化。 分解电压 确定了阳极、阴极析出的物质后,将两者的析出电势相减,就得到了实际 分解电压。因为电解池中阳极是正极,电极电势较高,所以用阳极析出电势减去阴极 析出电势。电解水溶液时,由于 或 的析出,会改变 或 的浓度,计算电极电势 时应把这个因素考虑进去。 金属离子的分离 如果溶液中含有多个析出电势不同的金属离子,可以控制外加电压的大小,使金属离 子分步析出而达到分离的目的。 为了使分离效果较好,后一种离子反应时,前一种离子的活度应减少到 以下,这样 要求两种离子的析出电势相差一定的数值。 电解的应用 阴极产品:电镀、金属提纯、保护、产品的美化(包括金属、塑料)和制备 及有机 物的还原产物等。阳极产品:铝合金的氧化和着色、制备氧气、双氧水、氯气以及有 机物的氧化产物等。常见的电解制备有氯碱工业、由丙烯腈制乙二腈、用硝基苯制苯 胺等。 7-9 金属的电化学腐蚀和防腐 金属腐蚀分类: (1)化学腐蚀 金属表面与介质如气体或非电解质液体等因发生化学作用而引起的 腐蚀,称为化学腐蚀。化学腐蚀作用进行时无电流产生。 (2)电化学腐蚀 金属表面与介质如潮湿空气或电解质溶液等,因形成微电池,金属 作为阳极发生氧化而使金属发生腐蚀。这种由于电化学作用引起的腐蚀称为电化学腐 蚀。 电化学腐蚀实例带有铁铆钉的铜板若暴露在空气中,表面被潮湿空气或雨水浸润