
常用术语和概念 4、状态和状态函数 体系中所有物理性质和化学性质的总和即为状 态。 也就是说一个体系的物理性质和化学性质都确 定了,则称为一个状态。 如:气体的状态可由压力、体积、温度及各组 分物质的量等物理量来决定。如果其中的一个或多 个物理量发生改变时,体系即由一种状态变为另一 种状态。 对于一个体系来说当其处于不同状态时,其性 质必然有所不同。这些用来描述规定状态的性质用 数学术语来讲称它们为“状态函数
常用术语和概念 4、状态和状态函数 体系中所有物理性质和化学性质的总和即为状 态。 也就是说一个体系的物理性质和化学性质都确 定了,则称为一个状态。 如:气体的状态可由压力、体积、温度及各组 分物质的量等物理量来决定。如果其中的一个或多 个物理量发生改变时,体系即由一种状态变为另一 种状态。 对于一个体系来说当其处于不同状态时,其性 质必然有所不同。这些用来描述规定状态的性质用 数学术语来讲称它们为“状态函数

常用术语和概念 5、状态函数的特征 状态函数的变化只决定于体系的始态和终态, 而与变化的途径无关,状态一定值一定,殊途同归 变化等(与始终态有关而与途径无关,周而复始变化 零。 如:一定量的理想气体的状态变化,它由始态 p1=1.01×105Pa,T=298K变为p2=2.02×105Pa, T2398K。此过程可以有下列两种不同途径(“途 径”:状态变化所经历的具体步骤):
5、状态函数的特征 状态函数的变化只决定于体系的始态和终态, 而与变化的途径无关,状态一定值一定,殊途同归 变化等(与始终态有关而与途径无关,周而复始变化 零。 如:一定量的理想气体的状态变化,它由始态 p1 =1.01×105Pa,T1 =298K变为p2 =2.02×105Pa, T2 =398K。此过程可以有下列两种不同途径(“途 径”:状态变化所经历的具体步骤): 常用术语和概念
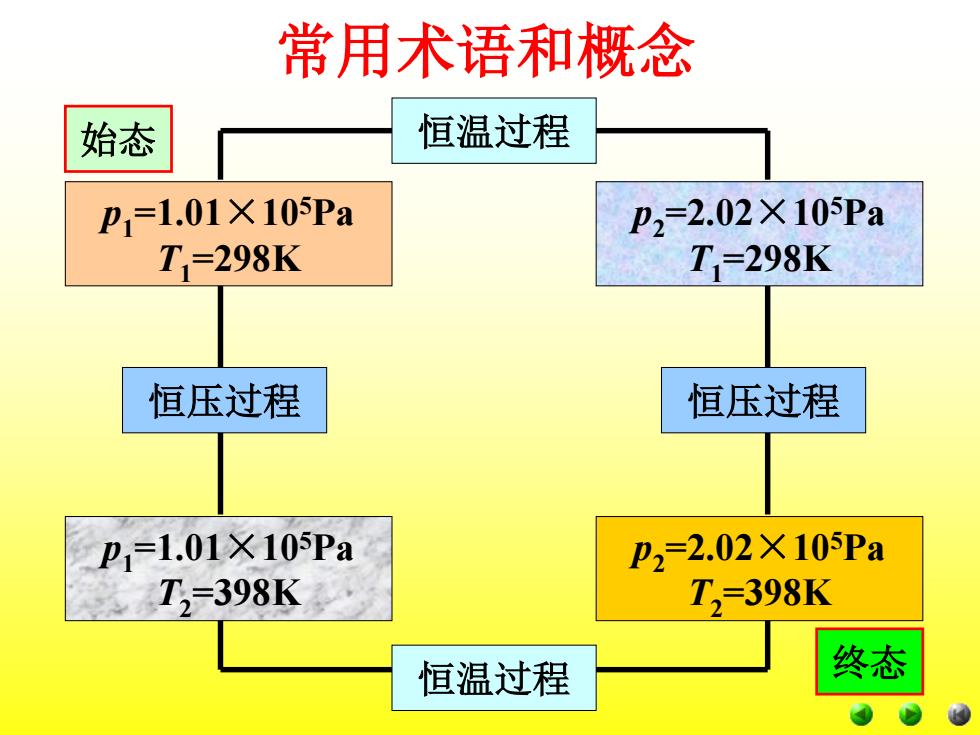
常用术语和概念 始态 恒温过程 p1=1.01×105Pa p2=2.02×10Pa T=298K T=298K 恒压过程 恒压过程 P1=1.01X10Pa P2=2.02×105Pa T,=398K T,=398K 恒温过程 终态
常用术语和概念 p1 =1.01×105Pa T1 =298K p2 =2.02×105Pa T2 =398K p2 =2.02×105Pa T1 =298K p1 =1.01×105Pa T2 =398K 恒温过程 恒压过程 恒温过程 恒压过程 始态 终态

热力学第一定律和热化学 一、热力学第一定律 热力学第一定律的一个中心问题是“能量守恒” 其数学表达式为:△U=Q+W △U为体系始态到终态内能变化值;△U=U,-U,内 能U是体系内部能量的总和,包括如下几部分: ①体系内所有物质的分子运动的动能,分子中 原子和电子运动的能量,如分子的转动动能、振动 动能等; ②分子间的位能,分子内原子间的位能,如: 质子与质子间的作用,化学键能等; ③原子核内的能量
一、热力学第一定律 热力学第一定律的一个中心问题是“能量守恒” 其数学表达式为:U=Q+W U为体系始态到终态内能变化值;U=U2 -U1内 能U是体系内部能量的总和,包括如下几部分: ①体系内所有物质的分子运动的动能,分子中 原子和电子运动的能量,如分子的转动动能、振动 动能等; ②分子间的位能,分子内原子间的位能,如: 质子与质子间的作用,化学键能等; ③原子核内的能量。 热力学第一定律和热化学

热力学第一定律和热化学 由于内能包括位能等因素,所以内能的绝对值 很难求得。 但对解决实际问题并无妨碍,因为在处理实际 问题时我们考虑的主要是内能的变化值。 而内能的差值可以从过程中,体系与环境能量 传递的功和热的数值来求出。 内能U是状态函数。 △U=Q+W Q为体系所吸收的热,若体系放热Q为负值; W为功,环境对体系做功W为正值,反之为负 值。 Q和不属于体系的状态,而是过程,即不属 于状态函数
热力学第一定律和热化学 由于内能包括位能等因素,所以内能的绝对值 很难求得。 但对解决实际问题并无妨碍,因为在处理实际 问题时我们考虑的主要是内能的变化值。 而内能的差值可以从过程中,体系与环境能量 传递的功和热的数值来求出。 内能U是状态函数。 U=Q+W Q为体系所吸收的热,若体系放热Q为负值; W为功,环境对体系做功W为正值,反之为负 值。 Q和W不属于体系的状态,而是过程,即不属 于状态函数