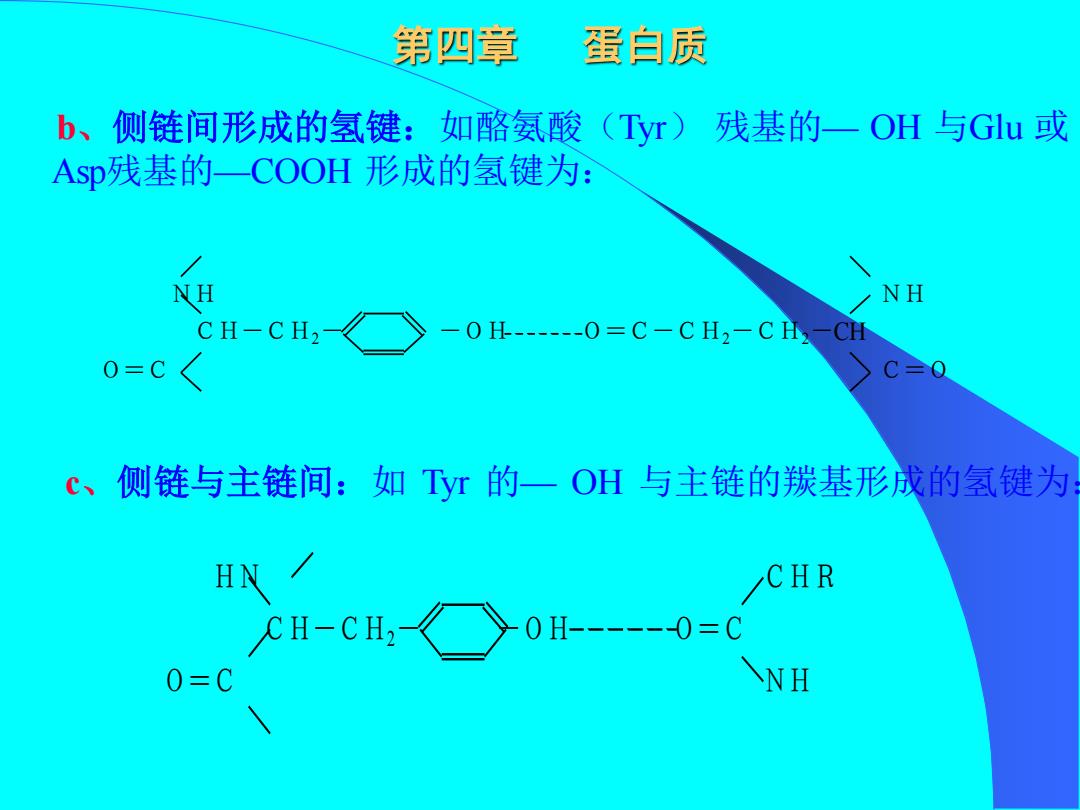
第四章 蛋自质 b、侧链间形成的氢键:如酪氨酸(Tyr) 残基的一OH与G引u或 Asp残基的一COOH形成的氢键为: NH 彡NH CH-CH2 -0 H-------0=C-C H2-C H2-CH 0=C c、侧链与主链间:如Tyr的一OH与主链的羰基形成的氢键为 HN CHR H-cH,《>0H--0= 0=C ANH
第四章 蛋白质 b、侧链间形成的氢键:如酪氨酸(Tyr) 残基的— OH 与Glu 或 Asp残基的—COOH 形成的氢键为: c、侧链与主链间:如 Tyr 的— OH 与主链的羰基形成的氢键为: NH NH CH-CH2- -OH O=C-CH2-CH2-CH O=C C=O HN CHR CH-CH2- -OH O=C O=C NH

第四章 蛋白质 3)二硫键:两个硫原子间的化学键,有链间、链内键。在某些 蛋白质分子中二硫键一旦被破坏,生物活性则丧失。在蛋白质分 子中往往有一SH和一S一S一,它们可发生交换反应: CysI-S-S-Cys2 Cys3S Cys1-S-S-Cys3 Cys2S 4)范德华力 三种形式 (学生自学) 5)琉水键:是指两个疏水基团为避开水相而聚集在一起的作用 力。疏水键与盐键对盐或有机溶剂的反应是相反的: ★非极性溶剂能破坏疏水键、但加强盐键: 女盐则增强疏水键、但可破坏盐键
第四章 蛋白质 3) 二硫键:两个硫原子间的化学键,有链间、链内键。在某些 蛋白质分子中二硫键一旦被破坏,生物活性则丧失。在蛋白质分 子中往往有-SH和-S-S-,它们可发生交换反应: 4) 范德华力 三种形式 (学生自学) 5) 疏水键:是指两个疏水基团为避开水相而聚集在一起的作用 力。疏水键与盐键对盐或有机溶剂的反应是相反的: ★ 非极性溶剂能破坏疏水键、但加强盐键; ★ 盐则增强疏水键、但可破坏盐键。 Cys1-S-S-Cys2 + Cys3S - Cys1-S-S- Cys3 + Cys2S -
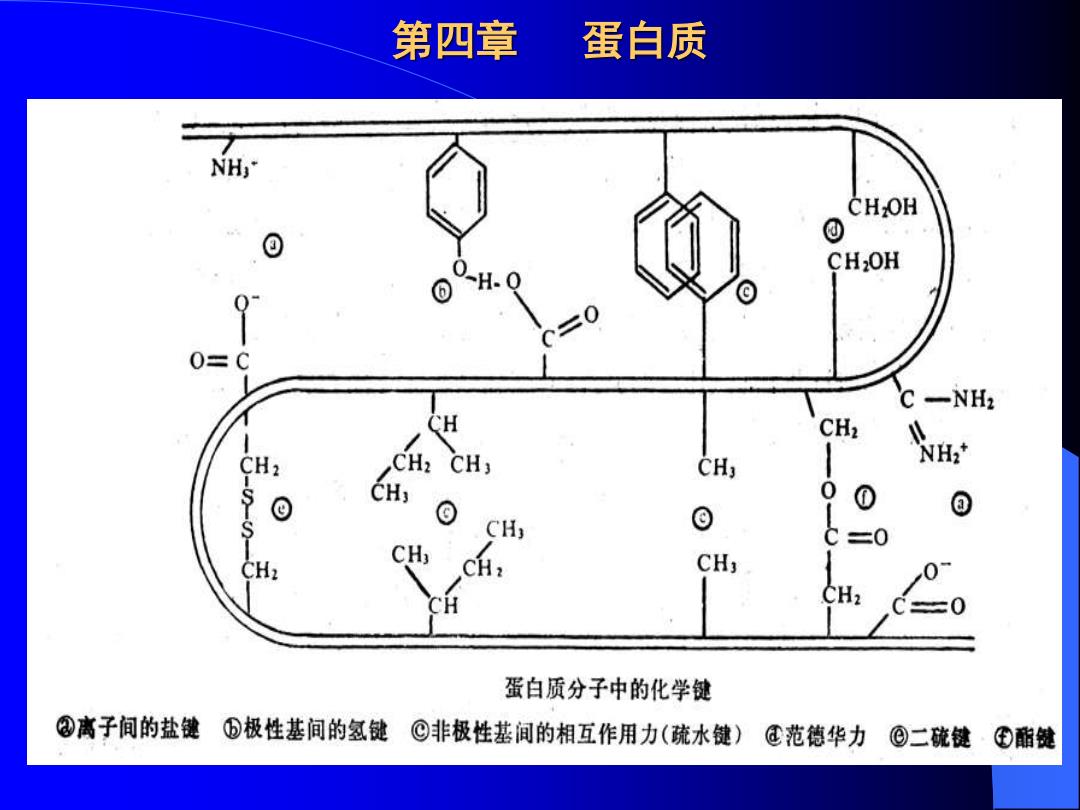
第四章 蛋白质 CHOH CH2OH 0=C C-NH2 CH CH2 CH2 NHz* CH; 0 0 CH ⊙ C三0 CH, CH3 蛋白质分子中的化学健 ②离子间的盐健⑤极性基间的氢键©非极性基间的相互作用力(疏水键)®范德华力⑨二硫键·④酯健
第四章 蛋白质

第四章 蛋白质 4.2.3蛋白质的变性 4.2.3.1变性概念 天然的蛋白质因受物理或化学因素影响,其分子 内部原有的高度规律性结构发生变化,致使蛋白质 的理化性质和生物学性质都有所改变,但并不导致 蛋白质一级结构的破坏,这种现象叫做变性作用。 食品中的蛋白质在变性时通常不再溶解并失去某 些功能性质,但部分变性的蛋白质比起天然蛋白质 更易消化、起泡性和乳化性更好,热变性也是热胶 凝形成蛋白质凝胶的先决条件;蛋白质变性时它的 固有粘度提高而结晶能力丧失
第四章 蛋白质 4.2.3 蛋白质的变性 4.2.3.1 变性概念 天然的蛋白质因受物理或化学因素影响,其分子 内部原有的高度规律性结构发生变化,致使蛋白质 的理化性质和生物学性质都有所改变,但并不导致 蛋白质一级结构的破坏,这种现象叫做变性作用。 食品中的蛋白质在变性时通常不再溶解并失去某 些功能性质,但部分变性的蛋白质比起天然蛋白质 更易消化、起泡性和乳化性更好,热变性也是热胶 凝形成蛋白质凝胶的先决条件;蛋白质变性时它的 固有粘度提高而结晶能力丧失

第四章 蛋白质 4.2,3.2变性热力学 要想测定一个蛋白质溶液中天然的和变性的蛋白 质所占的分数是不可能的。但是,蛋白质变性时必 定会影响到蛋白质的某些化学和物理性质,如紫外 吸光度、荧光、粘度、沉降系数、光学特性、园二 色谱、巯基反应能力和酶活力。因此,测定这些物 理和化学性质的变化可以研究蛋白质的变性。 当测定一种物理或化学性质Y的变化作为变性剂 的浓度或温度的函数时,许多单体球状蛋白质(仅 有三级结构)的变性方式可用下图表示
第四章 蛋白质 4.2.3.2 变性热力学 要想测定一个蛋白质溶液中天然的和变性的蛋白 质所占的分数是不可能的。但是,蛋白质变性时必 定会影响到蛋白质的某些化学和物理性质,如紫外 吸光度、荧光、粘度、沉降系数、光学特性、园二 色谱、巯基反应能力和酶活力。因此,测定这些物 理和化学性质的变化可以研究蛋白质的变性。 当测定一种物理或化学性质Y的变化作为变性剂 的浓度或温度的函数时,许多单体球状蛋白质(仅 有三级结构)的变性方式可用下图表示