第四章 蛋白质 氨基酸的pKa和pl值(25℃) 氨基酸 pKal pKa2 pKaR pI (a-COO (a-NH4) (R=侧链) 丙氨酸 2.35 9.59 6.02 精氨酸 2.17 9.04 12.48 10.76 天门冬酰胺 2.02 8.80 5.41 天门冬氨酸 2.00 9.82 3.86 2.97 半胱氨酸 1.96 10.28 8.18 5.07 谷氨酸胺 2.17 9.13 6.65 谷氨酸 2.10 9.67 4.25 3.22 甘氨酸 2.34 9.78 6.05 组氨酸 1.82 9.17 6.00 7.58 异亮氨酸 2.36 9.68 6.02 亮氨酸 2.36 9.64 6.00 赖氨酸 2.18 8.95 10.63 9.74 甲硫氨酸 2.28 9.21 5.75 苯丙氨酸 1.83 9.24 5.53 脯氨酸 1.99 10.6 8.30 丝氨酸 2.21 9.15 5.68 苏氨酸 2.71 9.62 6.15 色氨酸 2.38 9.30 5.89 酪氨酸 2.20 9.11 10.07 5.65 缬氨酸 2.32 9.62 5.97
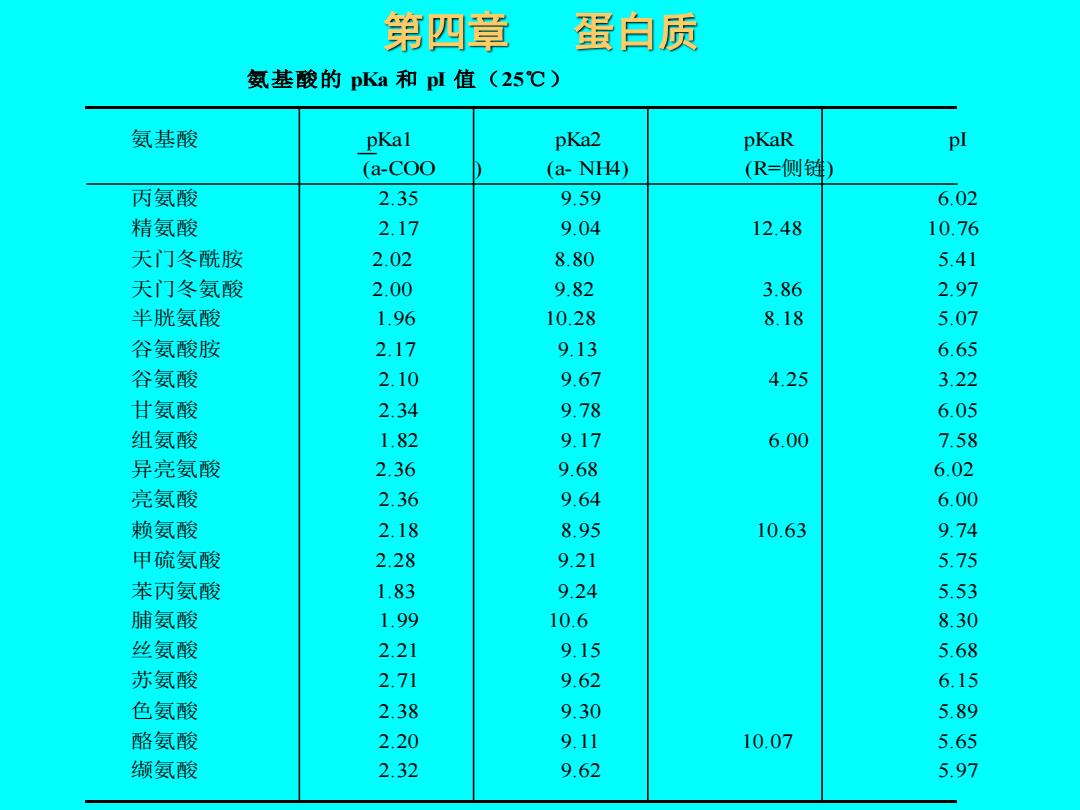
第四章 蛋白质 氨基酸的 pKa 和 pI 值(25℃ ) 氨基酸 pKa1 pKa2 pKaR pI ( a-COO ) ( a- NH4) (R=侧链) 丙氨酸 2.35 9.59 6.02 精氨酸 2.17 9.04 12.48 10.76 天门冬酰胺 2.02 8.80 5.41 天门冬氨酸 2.00 9.82 3.86 2.97 半胱氨酸 1.96 10.28 8.18 5.07 谷氨酸胺 2.17 9.13 6.65 谷氨酸 2.10 9.67 4.25 3.22 甘氨酸 2.34 9.78 6.05 组氨酸 1.82 9.17 6.00 7.58 异亮氨酸 2.36 9.68 6.02 亮氨酸 2.36 9.64 6.00 赖氨酸 2.18 8.95 10.63 9.74 甲硫氨酸 2.28 9.21 5.75 苯丙氨酸 1.83 9.24 5.53 脯氨酸 1.99 10.6 8.30 丝氨酸 2.21 9.15 5.68 苏氨酸 2.71 9.62 6.15 色氨酸 2.38 9.30 5.89 酪氨酸 2.20 9.11 10.07 5.65 缬氨酸 2.32 9.62 5.97

第四章 蛋白质 3)氨基酸与甲醛、亚硝酸、茚三酮的作用 (1)甲醛反应:测定氨基酸氨基的含量来定量氨基酸基础,也可 用来测定蛋白质的水解度。 R-CH-COO-R-CH-COO-+H+ DH中和 NH," NH, HCHO R-CH-COO- 羟甲基氨基酸 NHCH OH HCHO R-CH-COO- 二羟甲基氨基酸 N(CH,OH)2
第四章 蛋白质 3)氨基酸与甲醛、亚硝酸、茚三酮的作用 (1)甲醛反应:测定氨基酸氨基的含量来定量氨基酸基础,也可 用来测定蛋白质的水解度

第四章 蛋白质 (2)亚硝酸反应 氨基酸与亚硝酸反应后,放出的氮气是定量的,一半来自 氨基酸分子的α氨基,一半来自亚硝酸,故可通过测定放出的氮 气的体积来算出氨基的含量,这是Van Slyke氨基氮测定法的基础: (脯氨酸与羟脯氨酸不能进行这一反应) R-CH-COOHHNQ-*R一CH-COOH4N2个十H2O NHz... OH (3)与茚三酮反应 氨基酸与茚三酮反应,生成紫色化合物(脯氨酸与羟脯氨酸 生成黄色化合物),这一反应常用于氨基酸的定性与定量分析中
第四章 蛋白质 (2)亚硝酸反应 氨基酸与亚硝酸反应后,放出的氮气是定量的,一半来自 氨基酸分子的α氨基,一半来自亚硝酸,故可通过测定放出的氮 气的体积来算出氨基的含量,这是Van Slyke氨基氮测定法的基础。 (脯氨酸与羟脯氨酸不能进行这一反应) (3) 与茚三酮反应 氨基酸与茚三酮反应,生成紫色化合物(脯氨酸与羟脯氨酸 生成黄色化合物),这一反应常用于氨基酸的定性与定量分析中

第四章 蛋白质 4)与金属离子的螯合作用 氨基酸的一NH、一SH、一COOH均可与Cu2+、C02+ Mn+、Fe2+、Zn+等二价离子发生螯合作用。所以,当人们重 金属中毒时,可能服用蛋白质进行解毒。 4.2蛋白质的结构 4.2.1概念 级结构:蛋白质分子中氨基酸的连接方式和排列顺序。 二组结构:指蛋白质多肽链本身的折叠和盘绕方式,天然蛋白质 般均含有α-螺旋,阝-折叠和耶转角等基本结构。 三级结构:蛋白质分子在二级结构的基础上,进一步沿多个方向 进行卷曲、折叠、盘绕而成紧密的近似球形的结构。 四级结构:由两条或两条以上的具有三级结构的多肽链聚合而成 特定构象的蛋白质分子叫蛋白质有四级结构
第四章 蛋白质 4)与金属离子的螯合作用 氨基酸的—NH2、— SH、—COOH均可与Cu2+ 、Co 2+ 、 Mn2+ 、Fe2+ 、Zn2+ 等二价离子发生螯合作用。所以,当人们重 金属中毒时,可能服用蛋白质进行解毒。 4.2 蛋白质的结构 4.2.1 概念 一级结构:蛋白质分子中氨基酸的连接方式和排列顺序。 二组结构:指蛋白质多肽链本身的折叠和盘绕方式,天然蛋白质 一般均含有α-螺旋,β-折叠和β-转角等基本结构。 三级结构:蛋白质分子在二级结构的基础上,进一步沿多个方向 进行卷曲、折叠、盘绕而成紧密的近似球形的结构。 四级结构:由两条或两条以上的具有三级结构的多肽链聚合而成 特定构象的蛋白质 分子叫蛋白质有四级结构

第四章 蛋自质 4.2.2蛋白质结构中相互作用的次级键 )盐键:是指蛋白质同一分子中带不同电荷的侧链基团之间的离 子对作用。如LyS、Arg等氨基酸侧链一NH,易与Glu、Asp侧 链一COO一或肽链末端的 -COO 形成盐键。盐键在酸碱作 用下易被破坏,且在蛋白质分子中的数目不多。 2)氢键:主要是肽链上的羰基与亚氨基(一NH一)间形成的。 氢键在蛋白质分子中的数目较多。氢键可在两条多肽链间、一条 多肽链内部形成。 a、主链间羰基与亚氨基之间形成的氢键为 R- C=0 )---H-N H-N CHR
第四章 蛋白质 4.2.2 蛋白质结构中相互作用的次级键 1) 盐键:是指蛋白质同一分子中带不同电荷的侧链基团之间的离 子对作用。如Lys、Arg 等氨基酸侧链 -NH+ 3易与Glu、Asp 侧 链—COO- 或肽链末端的 —COO- 形成盐键。盐键在酸碱作 用下易被破坏,且在蛋白质分子中的数目不多。 2) 氢键:主要是肽链上的羰基与亚氨基(— NH —)间形成的。 氢键在蛋白质分子中的数目较多。氢键可在两条多肽链间、一条 多肽链内部形成。 a、主链间羰基与亚氨基之间形成的氢键为 R-C C=O H C O H-N H-N CHR