
4.Lewis结构式稳定性的判据:形式电荷Q (1)Q定义: >若共用电子平均分配给成键原子,原子所带的电荷数 ·例如:N与CO,成键数3,孤电子对数2,N的Q为0 e √氧原子的Q为+1 c.o √碳原子的Q为-1 ·是共价键形成的平等与否的标志,与原子实际吸引电 子能力(即元素电负性)无关 >多种Lewis结构式,Qr稳定性判据: ·Q应尽可能小 ·两相邻原子之间的Q尽可能避免同号 ·若Q与元素电负性一致,则该结构更稳定 6
4.Lewis 结构式稳定性的判据:形式电荷QF (1) QF定义: 若共用电子平均分配给成键原子,原子所带的电荷数 • 例如:N2与CO,成键数3,孤电子对数2,N的QF为0 • 是共价键形成的平等与否的标志,与原子实际吸引电 子能力 (即元素电负性) 无关 多种Lewis结构式,QF稳定性判据: • QF应尽可能小 • 两相邻原子之间的QF尽可能避免同号 • 若QF与元素电负性一致,则该结构更稳定 氧原子的QF为+1 碳原子的QF为1 6
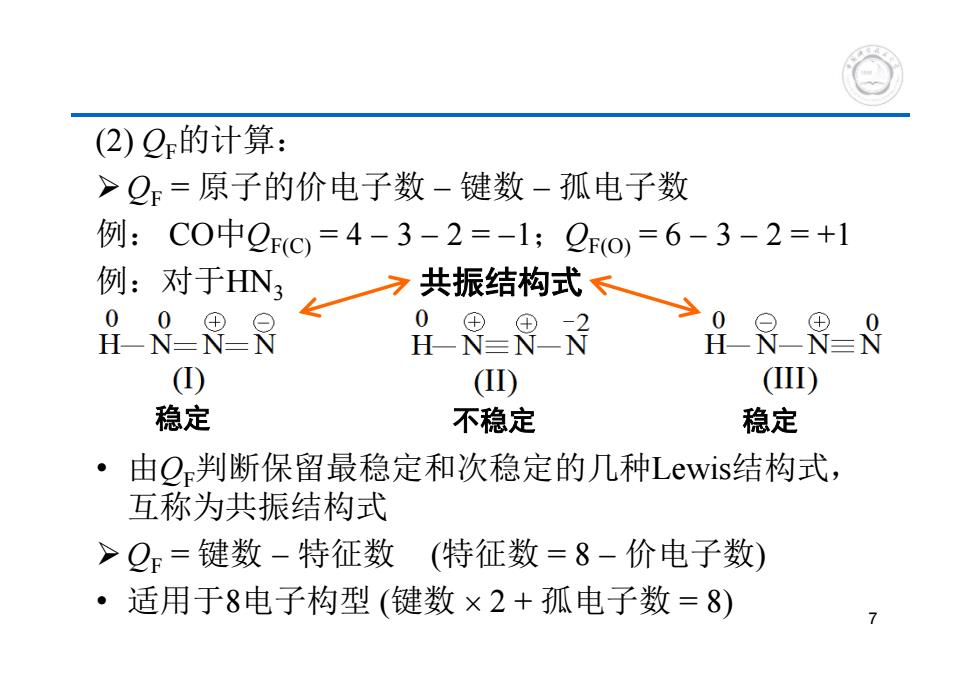
(2)Q的计算: >Q=原子的价电子数-键数-孤电子数 例:C0中00=4-3-2=-1;Qo,=6-3-2=+1 例:对于HN? 了共振结构式、 HN-8 :周=8 RR8 0 (①) (I) (I1) 稳定 不稳定 稳定 ·由Q判断保留最稳定和次稳定的几种Lewis结构式, 互称为共振结构式 >Q=键数-特征数(特征数=8-价电子数) ·适用于8电子构型(键数×2+孤电子数=8) 7
(2) QF的计算: QF = 原子的价电子数 键数 孤电子数 例: CO中QF(C) = 4 3 2 = 1;QF(O) = 6 3 2 = +1 例:对于HN3 • 由QF判断保留最稳定和次稳定的几种Lewis结构式, 互称为共振结构式 QF = 键数 特征数 (特征数 = 8 价电子数) • 适用于8电子构型 (键数 2 + 孤电子数 = 8) 稳定 不稳定 稳定 共振结构式 7
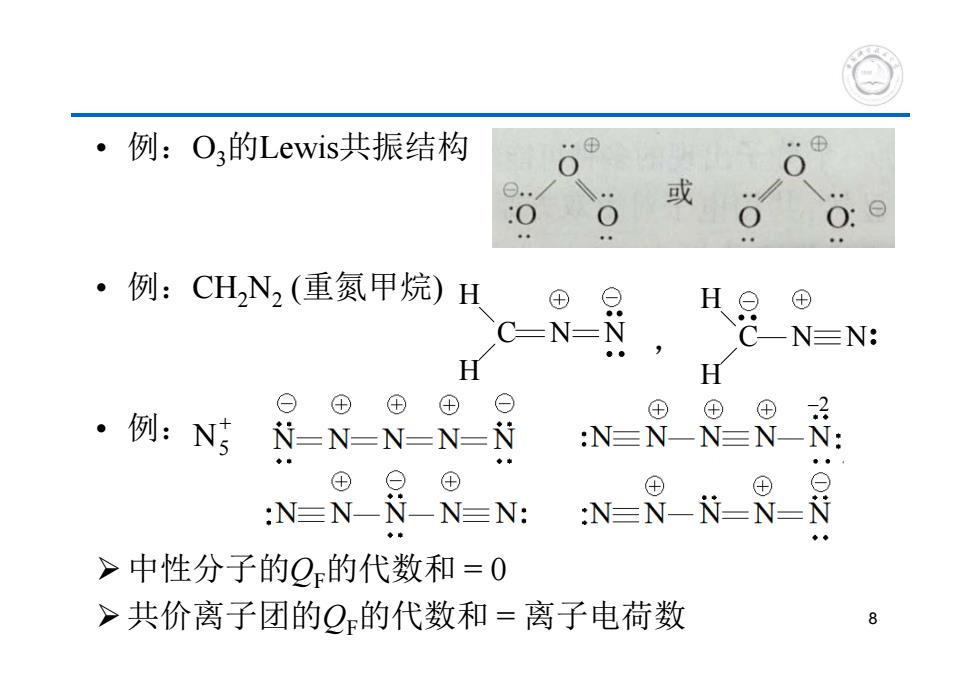
·例:O,的Lewis共振结构 .⊕ · 或 ·例:CHN2(重氮甲烷)H 8月 ⊕ N=N: H H ⊙⊕ ⊕⊕⊙ 。例:N ⊕ N-N-N-N-N :N=N-】 8 ④ ⊕ ⊕ N-N-N-N-N: :N=N-i -8周 >中性分子的Q的代数和=0 >共价离子团的Q的代数和=离子电荷数 8
• 例:O3的Lewis共振结构 • 例:CH2N2 (重氮甲烷) • 例: 中性分子的QF的代数和 = 0 共价离子团的QF的代数和 = 离子电荷数 , H C H N N H C H N N N5 2 8

5.Lewis结构式的应用 (1)判断结构的稳定性 >多原子共价分子离子团:原子间多种排列方式 >例如: ·C02:OC0还是C00? ·NO:NNO还是NON? cyanate ion OCN-比fulminate ion CNO-稳定? (2)计算共价分子/离子团中原子之间的键级 >键级:键合两原子形成化学键的重数,键相对强度 ·例如: CH共振结构式为一〔 其C一C键级=(1+2)/2=3/2 9
5.Lewis 结构式的应用 (1) 判断结构的稳定性 多原子共价分子/离子团:原子间多种排列方式 例如: • CO2 :OCO 还是 COO? • N2O :NNO 还是 NON? • cyanate ion OCN-比 fulminate ion CNO-稳定? (2) 计算共价分子/离子团中原子之间的键级 键级:键合两原子形成化学键的重数,键相对强度 • 例如: C6H6 共振结构式为 其C-C键级 = (1 +2) / 2 = 3/2 9

>键级越大, 键能越大,键长越短,稳定性越高 ·例: NO3的N一O键级=(1+1+2)/3=4/3,3个N一O键等价 ·例:H ⊕ HO⊕ C-N-N CNEN: H H H一C键级=1,C一N键级=3/2,N一N键级=5/2 √N一N键比C一N键强, √重氮甲烷易分解成N,和CH,活性基团 10
键级越大,键能越大,键长越短,稳定性越高 • 例: NO3的N-O键级 = (1 + 1 +2)/3 = 4/3,3个N-O键等价 • 例: H-C键级 = 1, C-N键级 = 3/2, N-N键级 = 5/2 N-N键比C-N键强, 重氮甲烷易分解成N2和CH2活性基团 , H C H N N H C H N N 10