
0.2有机合成化学 0.2.1有机合成化学的研究进展 有机合成化学是利用现有的已知物质(单质或化合物),采用合成手段或技术,根据 定的反应原理,合成出人们所期望的目标分子。人们在了解自然、认识自然并改造自然的 过程中,首先遇到了许多对人类有利的天然化合物,并通过已有方法阐明了这些天然化合 物的结构,有机合成化学家则在实验室中用人工方法来合成这些天然产物,用以证明它们 的结构。这种证明往往是最直接、最严格、最有效的,也是最后的证明。在这种验证过程 中,既不能单凭勤尽,也不能凭灵机一动就进行工作。它要求有机合成化学家必须具有丰 富而又扎实的基础知识,利用理性思维按“计划”进行工作,这里的“计划”包含了对已知反 应原理的归纳总结,对现有合成手段的评价,对目标分子的系统分析以及对目标分子的合 成设计。合成化学家的目的不仅于此,他们还可以根据人类社会的需要来改造天然产物 的结构,甚至创造出一种全新的结构。在此必须强调的是,有机合成化学家在合成“复杂 天然化合物·的过程中所运用的方法与理论往往会给后人留下一种宝贵的经验,从而出 现了有机合成方法学。例如,罗宾逊()在合成环状化合物过程中,对于化 学结构和反应性以及反应过程之间关系的深刻思考,对于将机理分析应用于有机合成等 都产生了深远的影响,也使有机合成化学第一次成为 门课程。他发展的一些巧妙的有 机合成方法,更是启发了后人发现一些新的有机合成手段与反应规律。因此,有机合成是 改造物质世界的有机合成,正如美国有机化学家伍德沃德(R.B.Woodward)所说的那样 “有机合成在现有的自然界旁边建立了一个新的自然界”,从而给人类繁复的大千世界增 添了更加丰富多彩的内容。 1)复杂天然产物合成讲展 谈到复杂天然产物的合成,自然会想到伍德 CH: N(CH 沃德与他领导的研究小组所合成的复杂天然产 物。伍德沃德是一个敢于不断向最复杂天然产物 HC. CH 挑战的人,从27岁开始,他先后合成了喹宁、胆甾 CH; 醇、羊毛缁醇、马钱子碱、利血平、四环素、维生素 CH B红霉素。在此特别值得一提的是红霉素与维 生素B的合成。红霉素分子(见图0.1)中含有18 CH OH 个手性中心,理论上应有262144个异构体,对如 CH,OCH 此复杂的对象,若不能对它的立体化学、构象分 图0.1红莓素的结构 析、有机合成等有极为精确的了解,要立体专一地 完成它的全合成工作是难以想象的,该项工作仅署名作者就达49人之多。 也许养是垫磨离身条件下,所要合成的月标分子是复杂的,而在今天,这种"复杂“分子 ·4

维生物B2(见图0.2)的合成,则 H,NOCH.CHC 几乎组织了近百人、耗时达15年之久 0 H CH.HC CH-CONI 这项工作的完成使有机合成更多地从 H.NCH.C 艺术走向理性,因为在这项十分艰巨 H.C N I 的合成工作中,伍德沃德及其合作者 (瑞士的Eschenmoser)不仅提出了一些 HNCH.C \CH 新的合成方法,而且还发现了周环反 HNCH.CH.C CH.CHCONH, 应的重要规则,即分子轨道对称性守 CH 恒原则。为此,他曾获得了诺贝尔化 -CH 学奖。红霉素与维生素B2的合成是 伍德沃德一生合成工作的顶峰,但毕 ⊙0 CH 竟不是有机合成的世界顶峰。近年 来,又出现了具有多个手性中心的矣 CHOH 2 能霉煮、傅来霉素、银杏内酯等的全合 图0.2维生素B的结构 成工作。特别值得一提的是,海葵毒 素的全合成。海葵毒素(见图0.3)的分了式为C0HN0,分子中具有64个手性中心 和7个骨架内双键,因此具有21个异构体(近于天文数字),要立体专一地合成该分子,其 艰巨性是可想而知的:又由于海葵毒素是迄今为止已知最毒的物质之一,它的合成自然十 分引人注目,雅怪美国的化学与工程(新闻)评论说:若有机合成也有珠穆朗玛蜂的话,海 葵毒素的合成就是其珠穆朗玛峰。然而,对有机合成来说,这决不是顶峰,随着有机合成 手段的不断增多,有机合成理论的不断完善,还会有更困难的问题待解决。 OH .OH OH OH HO OH 01 OH HO(H,CN个: OH Me OH HO -OH HO OH Me-o OH 0 OH OH Me HO OH OH OH 图03海葵素的结构 2)具有结构兴趣的非天然产物的合成进展 在复杂天然产物合成之外,另一类显示有机合成创造力工作的是高张力非天然产物 ·5
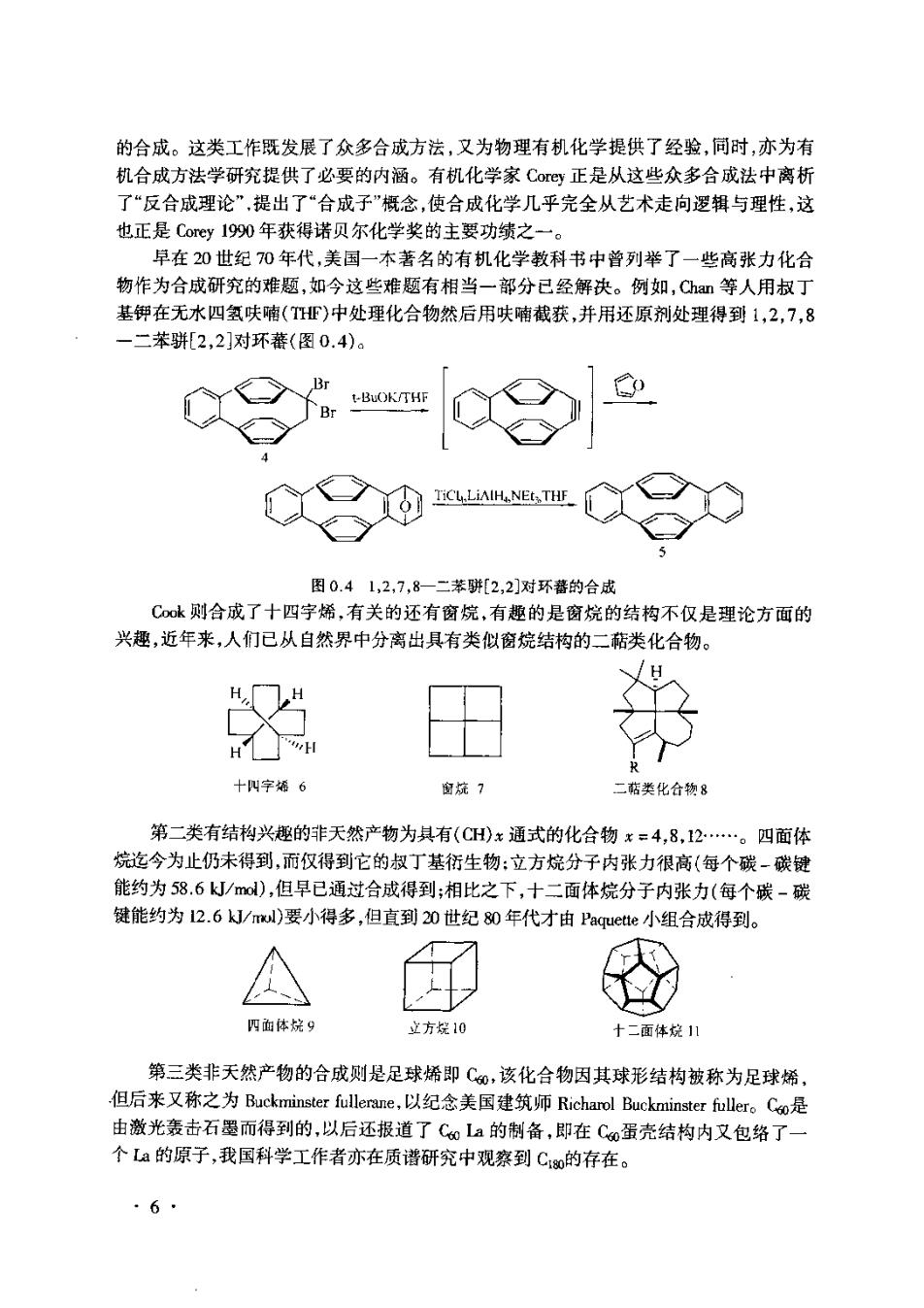
的合成。这类工作既发展了众多合成方法,又为物理有机化学提供了经验,同时,亦为有 机合成方法学研究提供了必要的内涵。有机化学家Co©正是从这些众多合成法中离析 了“反合成理论”,提出了“合成子”概念,使合成化学儿乎完全从艺术走向逻辑与理性,这 也正是Coey1990年获得诺贝尔化学奖的主要功绩之一。 早在20世纪0年代,美国一本著名的有机化学教科书中曾列举了一些高张力化合 物作为合成研究的难题,如今这些难题有相当一部分已经解决。例如,C等人用叔丁 基钾在无水四氢呋喃(HF)中处理化合物然后用呋喃截获,并用还原剂处理得到1,2,7,8 二苯骈[2,2]对环蕃(图0.4) 图0.41,2,7,8-二苯骈[2,2对环蕃的合成 Ck则合成了十四字烯,有关的还有窗烷,有趣的是窗烷的结构不仅是理论方面的 兴趣,近年来,人们已从自然界中分离出具有类似窗烷结构的二萜类化合物。 H 十字婚6 窗烷? 二钻类化合物8 第二类有结构兴趣的非天然产物为其有(CH)x通式的化合物x=4,8,12.。四面体 烷迄今为止仍未得到,而仅得到它的叔丁基衍生物:立方烷分子内张力很高(每个碳-碳键 能约为58.6k/md),但早已通过合成得到;相比之下,十二面体烷分子内张力(每个碳-碳 键能约为12.6J/m)要小得多,但直到20世纪80年代才由Paqu©te小组合成得到。 四面体烷9 立方烷10 十二面体烷11 第三类非天然产物的合成则是足球烯即C,该化合物因其球形结构祓称为足球烯 但后来又称之为Buckminster fullerane,以纪念美国建筑师Richarol Buckminster fuller。Co是 由激光轰击石愚而得到的,以后还报道了C0La的制备,即在C0蛋壳结构内又包络了 个La的原子,我国科学工作者亦在质谱研究中观察到C0的存在。 ·6

0.2.2有机合成方法学研究进展 前述有关复杂天然产物及高张力非天然产物的合成,都是建立在一定的合成手段基 础之上。9世纪50年代之前,许多合成方法来自于对天然产物降解的深人研究。如今 有机化学家则能从逻辑思维的理性角度分析设计出目标分子的合成策略及具体的合成手 在发展一个有用的合成方法时,有机合成化学家常要考虑如下几个问题: ()产率; (2)反应条件 (3)反应选择性(包括化学、区域及立体选择性); (4】反应起始原料来源: (5)使化学计量反应尽可能向催化循环发展: (6)环境污染」 而温和的反应条件,优异的选择性及催化性反应往往是当前有机合成化学察关注的 焦点。因为这些问题的解决就意味着高产率与低污染。 1)化学选择性 化学选择性主要指试剂对不同官能团的选择性反应,在有机合成中,往往要进行各种 官能团的转换、引入或脱除,因而化学选择姓在多步合成或对多官能团化合物的反应中显 得十分重要。 化学选择性包括,选择性还原反应、选择性氧化与高度选择性的保护基团。有关选择 性还原反应,在fhopPeun所著的有机合成一书中,对各种还原剂对不同官能团反 应的雅易程度给出了一张比较清晰的相关表。对Hudlicky的专著亦应该加以重祝。 相比之下,有关选择性氧化反应的研究则远不及还原反应那样透彻,尽管Fhp Pm所著的有机合成一书中亦有一张类似还原反应那样的相关图,但氧化剂的选择性 往往较差,只能依靠底物不同的特点来认真考察试剂系统。目前,选择性氧化仍主要集中 于不同醇类的氧化及氧化程度控制。例如,人们将硝酸铜或KM0,附者于硅胶之上,可 选择性地将仲醇及苄醇氧化为酮与苯甲醛,而对分子中的伯醇则无任何影响。相反地,氧 化伯醇与仲醇完全不受影响的试剂则不多,依文献报道,初获成功的这类试剂有: (1)次氯酸钠-四甲基六氢吡啶-N-氧化物; (2)二氯化钙-三苯氧腾-苯; (3)二氢化二茂结催化的Oppenaner氧化。 控制氧化程度的问题,最主要的是出醇到醛或酮不被进一步氧化,这类试剂较多,但 值得一提的是由草酰氯活化的二甲亚砜(DMSO)氧化体系。 高度选择性的保护基团,在有机合成,尤其在复杂的多官能团化合物的合成中显得十 分重要。例如,在海葵毒索的合成中,基团保护显得格外重要,海葵毒素分子中有1个湖 基,1个氨基和41个羟基,Ksi合成小组共选用了8种不同的保护基团,等合成完带保护 基的海葵毒素后,依次又脱去这些基团,最后以35%的高产率脱除了8种42个保护基团 在有机合成中,羟基保护是常用的合成技术,传统的烯基醚(如乙烯基乙醚)保护虽然 。7
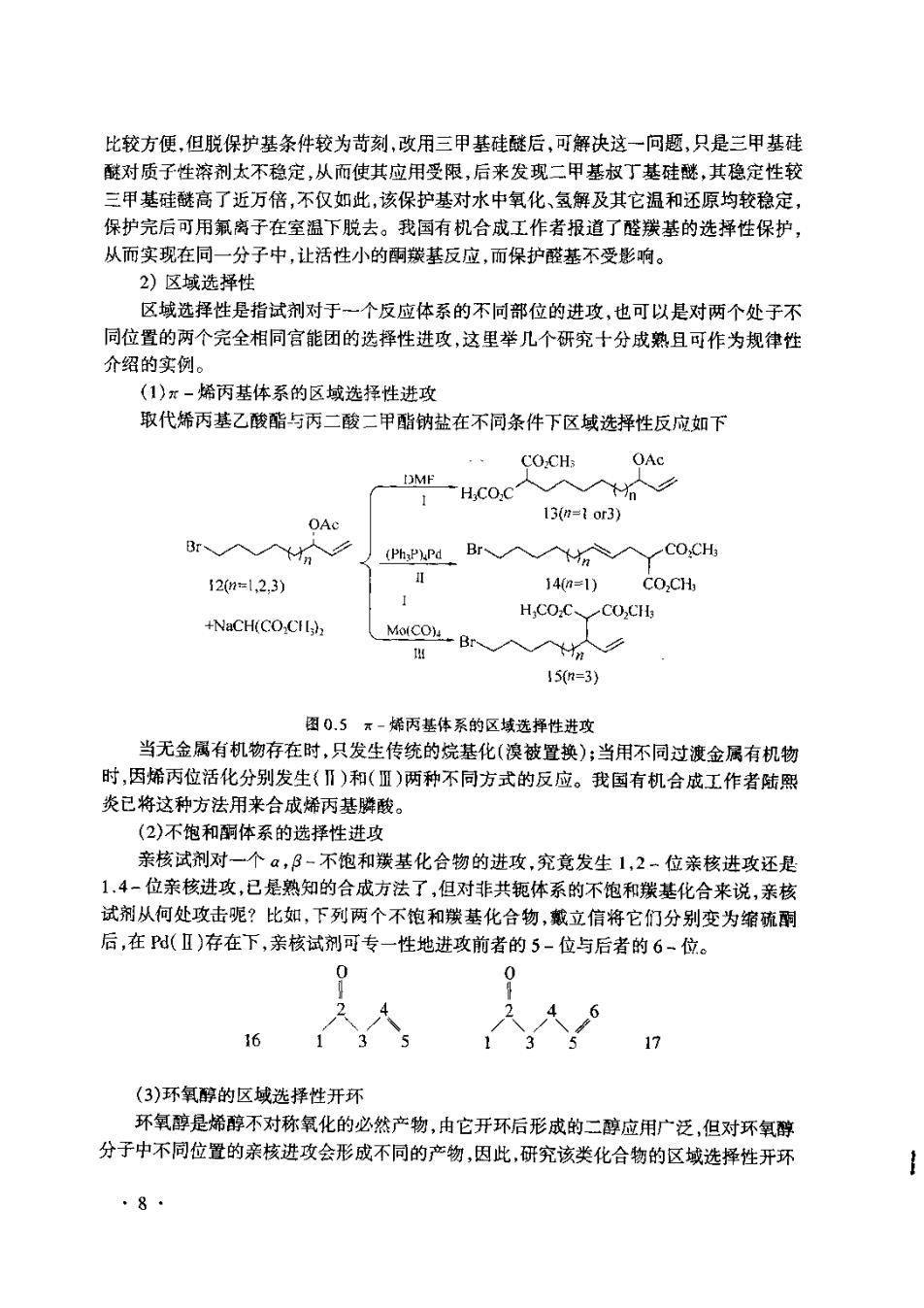
比较方便,但脱保护基条件较为苛刻,改用三甲基硅醚后,可解决这一问题,只是三甲基硅 醚对质子性溶剂太不稳定,从而使其应用受限,后来发现二甲基叔丁基硅醚,其稳定性较 三甲基硅醚高了近万倍,不仅如此,该保护基对水中氧化、氢解及其它温和还原均较稳定 保护完后可用氟离子在室温下脱去。我国有机合成工作者报道了醛羰基的选择性保护 从而实现在同一分子中,让活性小的雨羰基反应,而保护醛基不受影响。 2)区域选择性 区域选择性是指试剂对于一个反应体系的不同部位的进攻,也可以是对两个处子不 同位置的两个完全相同官能团的选择性进攻,这里举几个研究十分成熟且可作为规律性 介绍的实例。 (1)r-烯丙基体系的区域选择性进攻 取代烯丙基乙酸酯与丙二酸二甲酯钠盐在不同条件下区域选择性反应如下 CO.CH OAc DME H.COC 13m=1or3) Br、 (PhP'yPd Br 入入 CO.CH 120n=l,2,3) 146a=1) CO.CH H.CO.CCO,CH; +NaCH(CO.CI) Mco-Br入 、 15=3) 图05-烯丙基体系的区域洗择性并改 当无金属有机物存在时,只发生传统的烷基化(溴被置换);当用不同过渡金属有机物 时,因烯丙位活化分别发生(Ⅱ)和(皿)两种不同方式的反应。我国有机合成工作者陆熙 炎己将这种方法用来合成烯丙基瞬酸 (2)不饱和酮体系的选择性进攻 亲核试剂对一个,B-不饱和基化合物的进攻,究竟发生1,2-位亲核进攻还是 1.4-位亲核进攻,已是熟知的合成方法了,但对非共轭体系的不饱和羰基化合来说,亲核 试剂从何处攻击呢?比如,下列两个不饱和羰基化合物,戴立信将它们分别变为缩硫酮 后,在P(Ⅱ)存在下,亲核试剂可专一性地进攻前者的5-位与后者的6-位。 6 16 (3)环氧醇的区域选择性开环 环氧醇是烯醇不对称氧化的必然产物,由它开环后形成的二醇应用广泛,但对环氧碑 分子中不同位置的亲核进攻会形成不同的产物,因此,研究该类化合物的区域选择性开环 ·8