
8.4 滴定曲线(1) 氧化还原滴定反应的滴定曲线一般通过 实验方法测得,也可根据能斯特方程进行理 论计算。 氧化还原滴定曲线以电对的电极电位为 纵坐标,横坐标为标准溶液体积(或相对于 终点体积滴定的百分数)。值得注意的是, 滴定曲线起始点并不在纵坐标上,这与其他 几类滴定曲线有所不同
8.4 滴定曲线(1) 氧化还原滴定反应的滴定曲线一般通过 实验方法测得,也可根据能斯特方程进行理 论计算。 氧化还原滴定曲线以电对的电极电位为 纵坐标,横坐标为标准溶液体积(或相对于 终点体积滴定的百分数)。值得注意的是, 滴定曲线起始点并不在纵坐标上,这与其他 几类滴定曲线有所不同
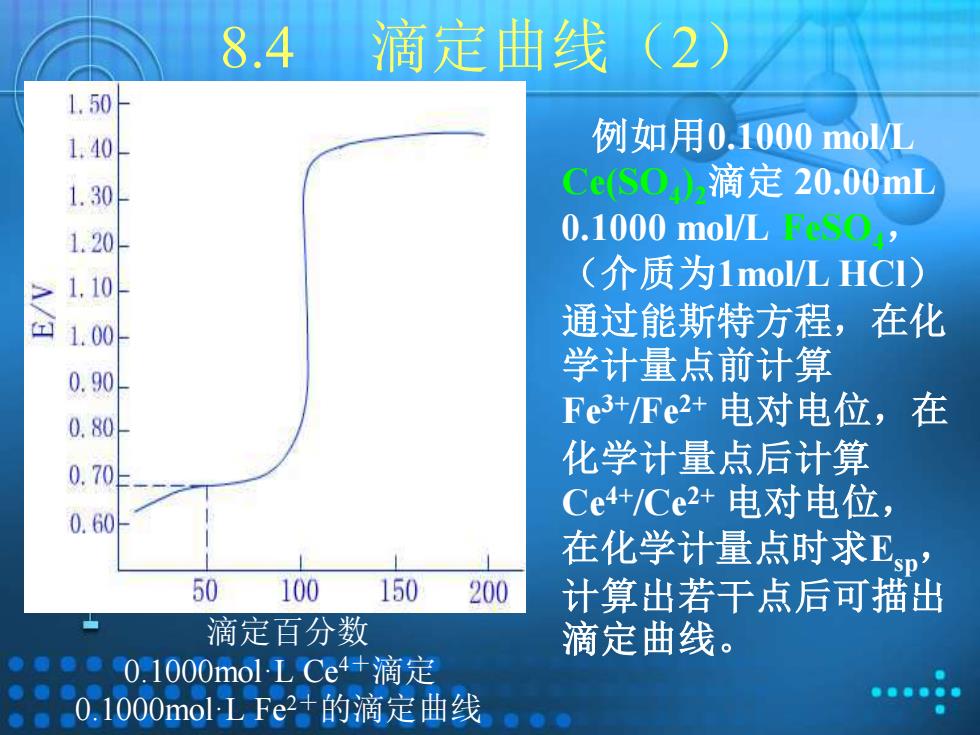
8.4 滴定曲线(2) 1.50 1.40 例如用0.1000mol/L 1.30 CeS0)2滴定20.00mL 1.20 0.1000 mol/L, 31.10 (介质为1 mol/L HCI) 合1.00 通过能斯特方程,在化 0.90 学计量点前计算 0.80 Fe3+Fe2+电对电位,在 0.70日 化学计量点后计算 0.60 Ce4+/Ce2+电对电位, 在化学计量点时求卫p' 50 100 150 200 计算出若干点后可描出 滴定百分数 滴定曲线。 01000 mol-L Ce4+滴定 0.1000 mol L Fe2+的滴定曲线
8.4 滴定曲线(2) 例如用0.1000 mol/L Ce(SO4 ) 2滴定 20.00mL 0.1000 mol/L FeSO4, (介质为1mol/L HCl) 通过能斯特方程,在化 学计量点前计算 Fe3+/Fe2+ 电对电位,在 化学计量点后计算 Ce4+/Ce2+ 电对电位, 在化学计量点时求Esp, 计算出若干点后可描出 滴定百分数 滴定曲线。 0.1000mol·L Ce 4+滴定 0.1000mol·L Fe2+的滴定曲线

1、滴定曲线的绘制 下面就以0.1000 mol/L Ce(SO4)2滴定 20.00mL0.1000mol/LFeS04,(介质为 1mol/LHC1)为例说明可逆的、对称的氧 化还原电对的滴定曲线。 滴定反应为: 滴定开始后,溶液中存在两个电对,根据 能斯特方程式,两个电对的电极电位分别 为:
1、滴定曲线的绘制 • 下 面 就 以 0 . 1000 mol/L Ce(SO4 ) 2 滴 定 20.00mL 0.1000 mol/L FeSO4,(介质为 1mol/L HCl)为例说明可逆的、对称的氧 化还原电对的滴定曲线。 • 滴定反应为: • 滴定开始后,溶液中存在两个电对,根据 能斯特方程式,两个电对的电极电位分别 为:

1、滴定曲线的绘制(2) Pre+1Fe=p*2+0.0591g Fe3 Fe3+/Fe2+ 0.68 C Pco/co=c+0.0591g Ce4+ Ce3+ =1.44/
1、滴定曲线的绘制(2)

1、滴定曲线的绘制(3) 在滴定过程中,每加入一定量滴定剂, 反应达到一个新的平衡,此时两个电对 的电极电位相等,即 因此,溶液中各平衡点的电位可选用便 于计算的任何一个电对来计算
1、滴定曲线的绘制(3) • 在滴定过程中,每加入一定量滴定剂, 反应达到一个新的平衡,此时两个电对 的电极电位相等,即 • 因此,溶液中各平衡点的电位可选用便 于计算的任何一个电对来计算。 3+ 2+ = 4+ 3+ Fe / Fe Ce /Ce