
(3)salts a.CoCl-6H2O-53c>CoCl2H2O-90c>CoClH2O-120c>Co[CoCl] 粉红色 紫红色 蓝紫色 蓝色 b.MS(M=Fe、Co、Ni)M2++s2=MS↓(黑色) 新产生的CoS、NiS易溶于稀酸,静止后成为另一种变体,就不易溶解在 稀酸中 c.FeSO4 > 工业制备:2FeS2+702+2H20→2FeS04+2H2S04 溶液中析出的是浅绿色的FeSO,·7H,O,俗称绿矾。 FeSO,易溶于水,在水中有微弱的水解,使溶液显酸性; > FeS0,被空气氧化:2FeS04+1/202+H0→2Fe(OH)S04 > 受热分解:2FeS04△Fe203+S02+S03 硫酸亚铁与碱金属疏酸盐形成复盐M2SO4FeSO46H2O。最重要的复盐是 FeSO4(NH4)2SO,6H,O(摩尔氏盐),常被用作还原试剂。 10FeS04+2KMnO4+8H2S04→5Fe2(S043+K2S04+2MnS04+8H20 6FeS04+K2Cr207+7H2S04→3Fe2(S043+K2S04+Cr2(S04)3+7H20 16
(3) salts ¾ 工业制备: 2FeS2 + 7O2 + 2H2O → 2FeSO4 + 2H2SO4 溶液中析出的是浅绿色的FeSO4·7H2O,俗称绿矾。 ¾ FeSO4易溶于水,在水中有微弱的水解,使溶液显酸性; ¾ FeSO4被空气氧化:2FeSO4 + 1/2O2 + H2O → 2Fe(OH)SO4 ¾ 受热分解: ¾ 硫酸亚铁与碱金属硫酸盐形成复盐MI 2SO4·FeSO4·6H2O。最重要的复盐是 FeSO4·(NH4)2SO4·6H2O(摩尔氏盐),常被用作还原试剂。 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O 6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O 16 b. MS(M = Fe、Co、Ni) 新产生的CoS、NiS易溶于稀酸,静止后成为另一种变体,就不易溶解在 稀酸中
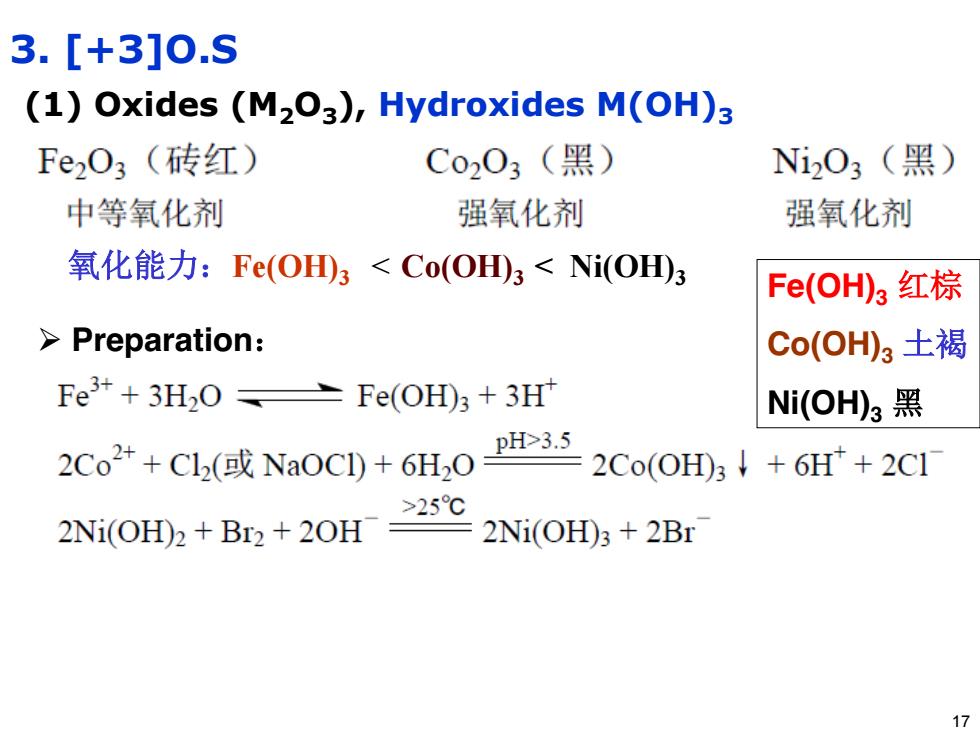
3.[+3]0.S (1)Oxides (M2O3),Hydroxides M(OH)3 Fe2O3(砖红) C0203(黑) Ni2O3(黑) 中等氧化剂 强氧化剂 强氧化剂 氧化能力:Fe(OHD)3<Co(OH田3<Ni(OD)3 Fe(OH)3红棕 Preparation: Co(OH)3土褐 Fe3++3H2O Fe(OH)3+3H* Ni(OH)3黑 2Co2++C12(或Na0C1)+6H20 pH>3.5 2Co(OH)3↓+6H+2C1 >25℃ 2Ni(OH)2+Br2+20H 2Ni(OH)3+2Br 17
3. [+3]O.S (1) Oxides (M2O3), Hydroxides M(OH)3 氧化能力:Fe(OH)3 < Co(OH)3 < Ni(OH)3 ¾ Preparation: Fe(OH)3 红棕 Co(OH)3 土褐 Ni(OH)3 黑 17
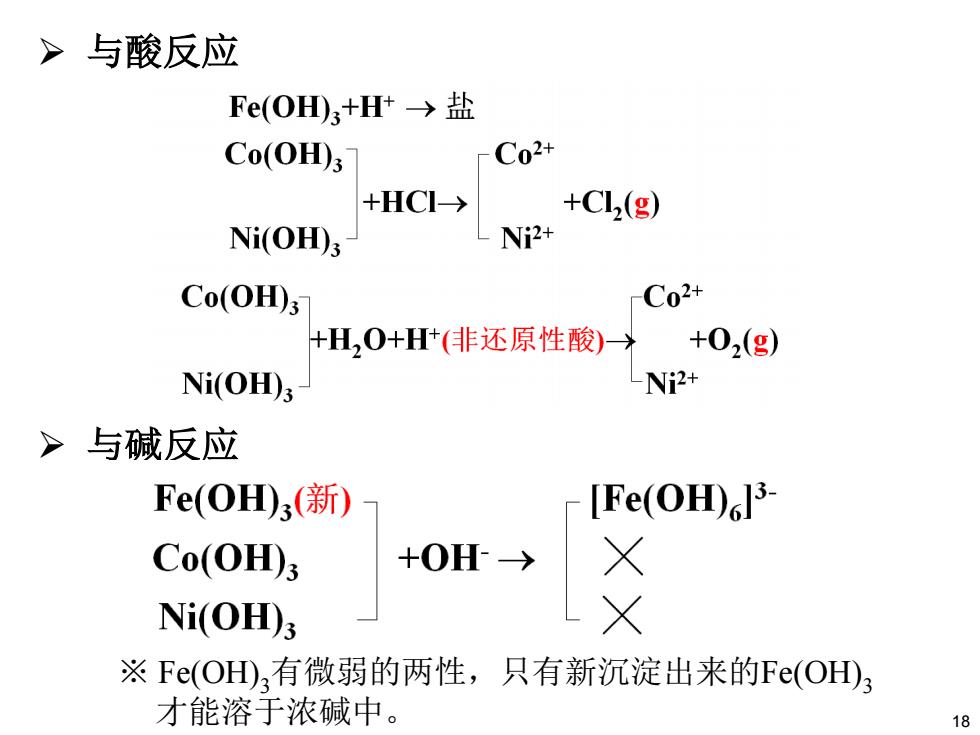
>与酸反应 Fe(OH)3+H+→盐 Co(OH); C02+ +HC→ +Cl(g) Ni(OH)3 Niz+ Co(OH)3 Co2+ +H,O+H(非还原性酸) +02(g) Ni(OH) -Ni2+ >与碱反应 Fe(OH)3(新) -[Fe(OH)3 Co(OH); Ni(OH)3 ※Fe(OH),有微弱的两性,只有新沉淀出来的Fe(OH)3 才能溶于浓碱中。 8
¾ 与酸反应 ¾ 与碱反应 ※ Fe(OH)3有微弱的两性,只有新沉淀出来的Fe(OH)3 才能溶于浓碱中。 18
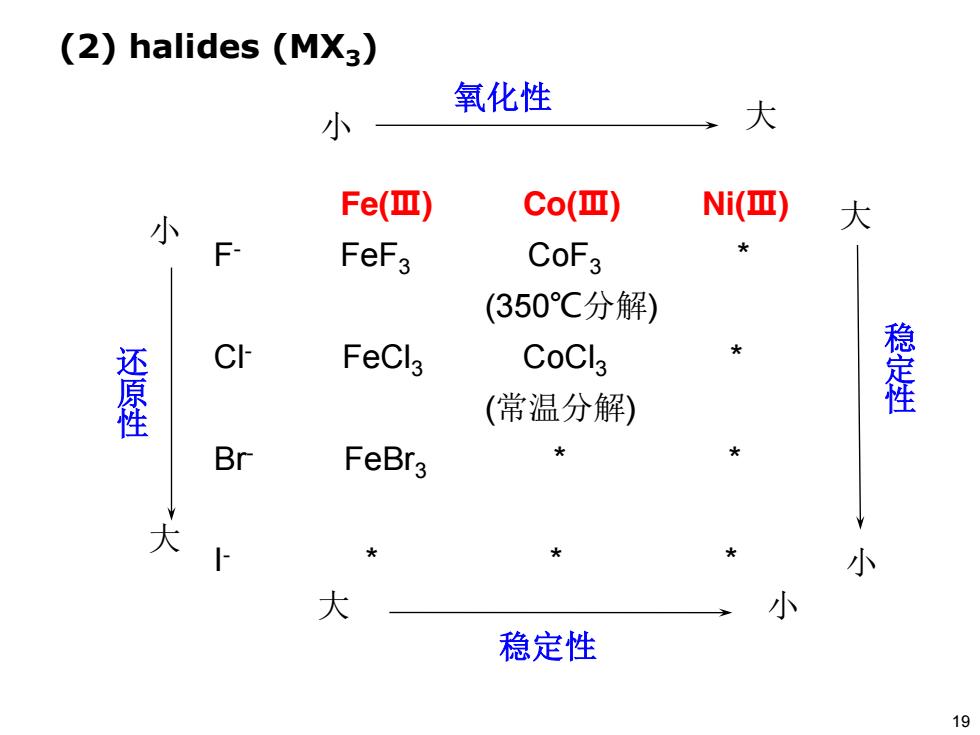
(2)halides (MX3) 氧化性 小 大 Fe(Ⅲ) Co(Ⅲ) Ni() 小 大 F- FeF3 CoF3 (350℃分解) 还原性 CI FeCl3 CoCls 稳定性 (常温分解) Br FeBr3 大 小 大 小 稳定性 19
氧化性 小 大 Fe(Ⅲ) Co(Ⅲ) Ni(Ⅲ) F- FeF3 CoF3 * (350℃分解) Cl- FeCl3 CoCl3 * (常温分解) Br- FeBr3 * * I - * * * 大 小 稳定性 大 小 大 小 还 原 性 稳 定 性 (2) halides (MX3) 19
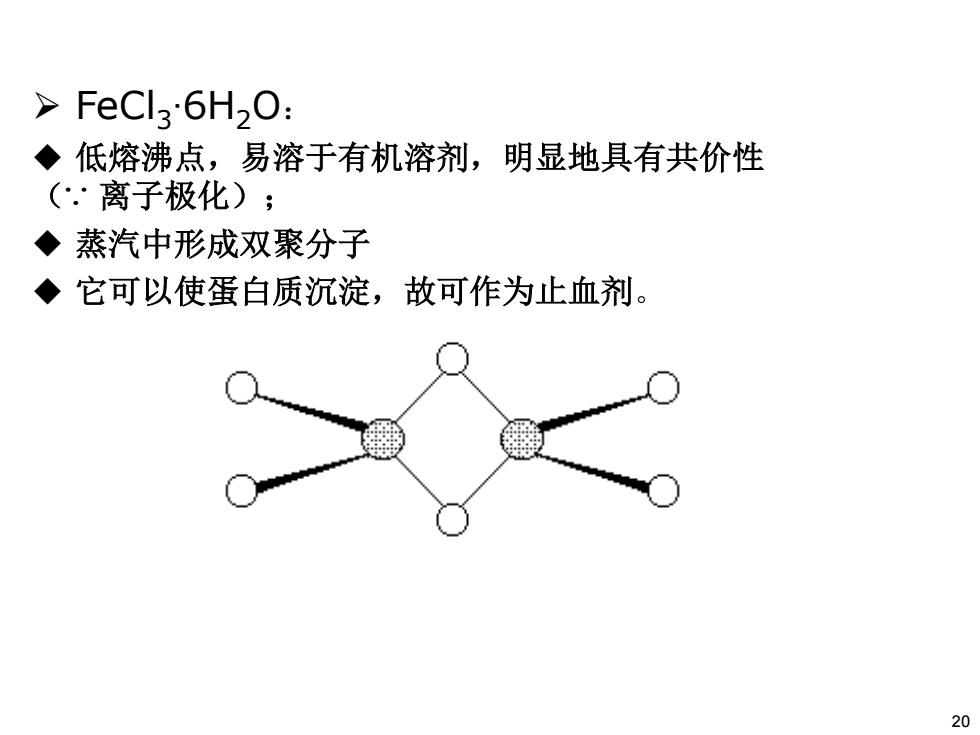
FeCl6H2O: ◆低熔沸点,易溶于有机溶剂,明显地具有共价性 (.·离子极化) ◆蒸汽中形成双聚分子 ◆它可以使蛋白质沉淀,故可作为止血剂。 20
¾ FeCl3∙6H2O: 低熔沸点,易溶于有机溶剂,明显地具有共价性 (∵ 离子极化); 蒸汽中形成双聚分子 它可以使蛋白质沉淀,故可作为止血剂。 20