
三、their compounds 1.[0]0.S羰基化合物 >由于σ配键和反馈π键两种 成键作用同时进行,使金属 羰合物 [Fe(CO)s] [【Co2(CO)sl INi(CO)4] 与一氧化碳形成的羰基化合 物具有很高稳定性。 颜色 浅黄(液) 深橙(固) 无色(液) >熔点、沸点比常见金属 化合物低,易挥发,受热 易分解为金属和一氧化碳。 熔点t/℃ -20 (51~52℃分解) -25 >羰基化合物有毒, 沸点t/℃ 103 43 Ni(CO)4吸入体内后, CO与血红素结合,胶体 镍随血液进入全身器官。 Preparation 200c Fe+5CO Fe(CO)s 制备时,必须在与外界隔绝的容器中进行。 50~200atm 150~200℃ 2Co+8C0 Co2(C0)8 2.5×107Pa Ni+4CO 60~80℃ Ni(CO)4 ※控制Ni、Co与CO的反应条件,可用此法分离Co、Ni。1
三、their compounds 1. [0]O.S 羰基化合物 ¾ Preparation : ※ 控制Ni、Co与CO的反应条件,可用此法分离Co、Ni。 ¾ 由于σ配键和反馈S键两种 成键作用同时进行,使金属 与一氧化碳形成的羰基化合 物具有很高稳定性。 ¾ 熔点、沸点比常见金属 化合物低,易挥发,受热 易分解为金属和一氧化碳。 ¾ 羰基化合物有毒, Ni(CO)4吸入体内后, CO与血红素结合,胶体 镍随血液进入全身器官。 11 200 oc 50 ~ 200 atm

(2)Structure CO Fe 3d64s2>3d8 OC-Fe Fe(CO)s dsp3杂化 co 3d 4s 4p 1业1业1业1业 Fe→C0T键 0 Fe←-COo键 Ni 3d84s2>3d10 Ni(CO)4 sp3杂化 4p 3d 1业1业1业1业1业、 T键 6键 12
Fe 3d64s2 3d8 Ni 3d84s2 3d10 (2) Structure Fe(CO)5 Ni(CO)4 12 dsp3杂化 sp3杂化
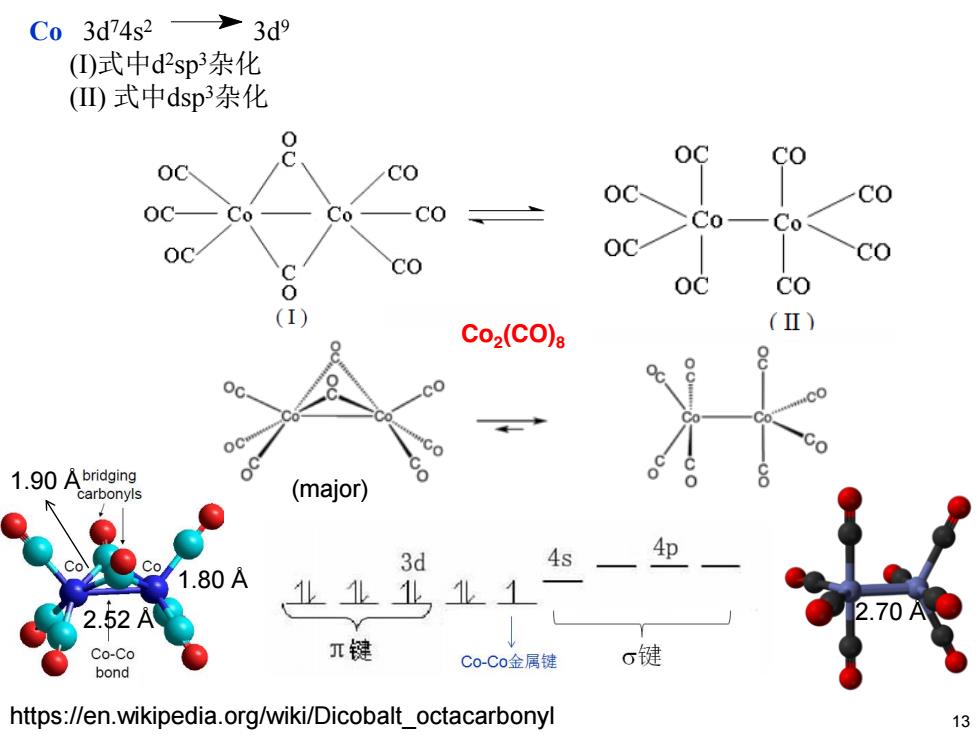
C03d74s2 3d9 (①)式中d2sp杂化 (四)式中dsp杂化 0 OC CO OC CO OC Oc- Co Co CO Co- Co OC co C 0 Co (I) Co2(CO)s (Ⅱ) oc co oc o 1.90 Abridging carbonyls (major) 3d 4s 4p Co 1.80A 2.52 业业业业1 2.70A C0-C0 T键 C0-Co金属键 6键 bond https://en.wikipedia.org/wiki/Dicobalt_octacarbonyl
Co2(CO)8 Co 3d74s2 3d9 (I)式中d2sp3杂化 (II) 式中dsp3杂化 https://en.wikipedia.org/wiki/Dicobalt_octacarbonyl 13 (major) 2.52 Å 1.80 Å 1.90 Å 2.70 Å

(3)properties: 易分解:用来提纯金属 230~330℃ Fe(CO)s Fe+5C0↑ 60℃ C02(CO)8 2Co+8C0↑ 180℃ Ni(CO)4 Ni+4CO↑ > some redox reactions: 1.在液氨中与Na的反应: Fe(CO)s +2Na Na2[Fe(CO)4]+CO 2.在乙醇中与KOH的反应: Fe(CO)5+4KOH=K2[Fe(C0)4]+K2C03+2H20 3.被I2氧化:Fe(CO)5+2=Fe(CO)42+C0 4.被H2还原:Co2C0)8+H—2H[Co(C0) ※若把H看作配体(H):Co2(CO)。+H2一2[HCo(CO),] 0 0 -1+1 H2为氧化剂: 14
(3) properties: ¾ some redox reactions: 1. 在液氨中与Na的反应: 2. 在乙醇中与KOH的反应: 3. 被I2氧化: 4. 被H2还原: ¾ 易分解:用来提纯金属 ※ 若把H看作配体(H-), H2为氧化剂: 14

2.[+2]0.S. (1)Oxides (MO),Hydroxides M(OH)2 FeO(黑色) CoO(灰绿色) NiO(暗绿色) Fe(OH)2(白色) Co(OD2(粉红色) Ni(OH)2(苹果绿色) 微弱两性 两性 碱性 ↓O2(迅速) ↓O2(缓慢) ↓NaOC1(强氧化剂) Fe203nH0(红棕色) Co203H20(棕色) Ni203nH20(黑色) ①M(OHD2+H→盐 ②Fe(OH)2 × Co(OH2+OH-→ICo(OH田)42 Ni(OH)2 × ③Fe(OH2 Fe(OH)3迅速 Co(OH田)2+0,(空气中)→Co(0D)3缓慢 Ni(OH)2 L 酸性C02++02→X;碱性Co2++02→C03 15
(1) Oxides (MO), Hydroxides M(OH)2 2. [+2]O.S. 15