
6.有机化合物的波谱分析 UV/Vis,IR,NMR and MS
6. 有机化合物的波谱分析 UV/Vis, IR, NMR and MS

6.1电磁辐射与分子运动 电磁波可以用波长入、频率v或波数来描述 光波可以看作是由具有特有的量子能量单位组成,量子能 量与频率成正比,与波长成反比: E=hy=hc/入 h Planck常数,等于6.62×10-34焦/秒 c光速,3×108米/秒 ⅴ频率表示每秒振动的次数,用Hz为单位,频率的另一表示法用波 数,它表示在1cm内波的数目,单位为cml 入波长一般用μm或nm表示1nm=10-3μm=10-9m=10A
电磁波可以用波长l、频率v或波数v来描述 光波可以看作是由具有特有的量子能量单位组成,量子能 量与频率成正比,与波长成反比: ~ E = hv = hc/l h Planck常数,等于6.62×10-34 焦/秒 c 光速,3´108 米/秒 v 频率表示每秒振动的次数,用Hz为单位,频率的另一表示法用波 数,它表示在1cm内波的数目,单位为cm-1 l 波长一般用µm或nm表示 1 nm=10-3µm=10-9m=10Å 6.1 电磁辐射与分子运动

只有光子的能量等于两个分子运动状态的能级之间的能量 时才能被吸收。对某一分子来说,它只能吸收一定波长的电 磁波,激发其某一特定的分子运动,这样就得到各种不同的 吸收光谱而用来鉴别有机分子的结构。 吸收光谱:紫外光谱(Ultraviolet spectroscopy) 红外光谱(Infrared spectroscopy) 核磁共振谱(Nuclear magnetic resonance spectroscopy). 质谱(Mass spectrometry):不是吸收光谱,是由高能电子冲击分 子生成的离子按质量数的顺序表现的谱线
吸收光谱:紫外光谱 (Ultraviolet spectroscopy) 红外光谱 (Infrared spectroscopy) 核磁共振谱 (Nuclear magnetic resonance spectroscopy) 只有光子的能量等于两个分子运动状态的能级之间的能量 时才能被吸收。对某一分子来说,它只能吸收一定波长的电 磁波,激发其某一特定的分子运动,这样就得到各种不同的 吸收光谱而用来鉴别有机分子的结构。 质谱(Mass spectrometry) :不是吸收光谱,是由高能电子冲击分 子生成的离子按质量数的顺序表现的谱线
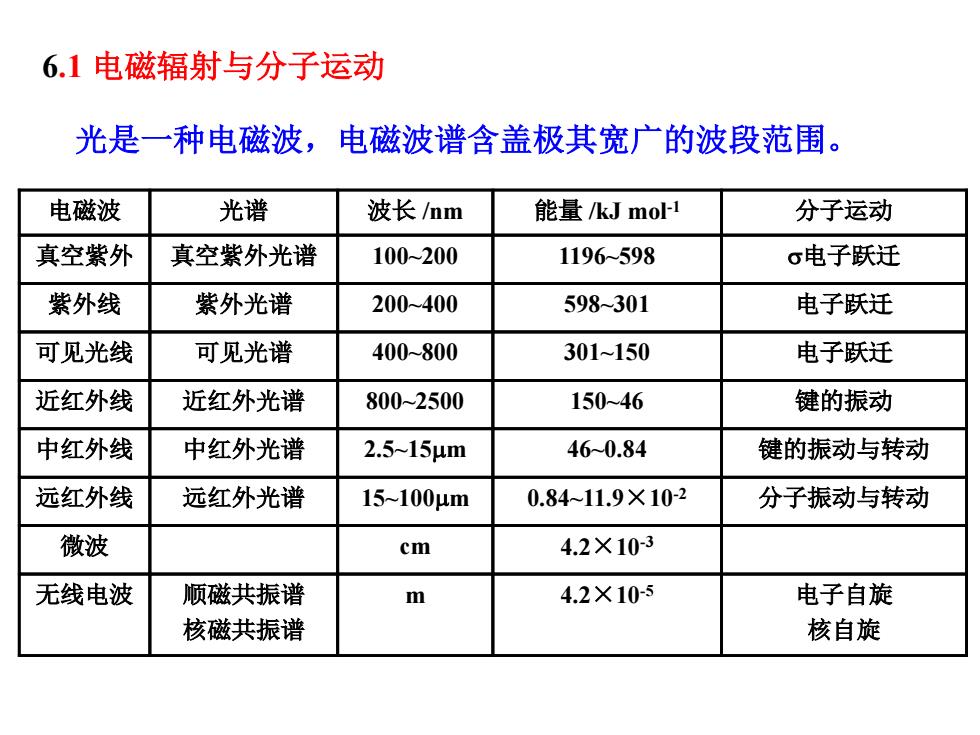
6.1电磁辐射与分子运动 光是一种电磁波,电磁波谱含盖极其宽广的波段范围。 电磁波 光谱 波长/mm 能量/kJmo1 分子运动 真空紫外 真空紫外光谱 100-200 1196598 σ电子跃迁 紫外线 紫外光谱 200-400 598-301 电子跃迁 可见光线 可见光谱 400-800 301~150 电子跃迁 近红外线 近红外光谱 800-2500 15046 键的振动 中红外线 中红外光谱 2.5~15μm 460.84 键的振动与转动 远红外线 远红外光谱 15-100μm 0.84~11.9×10-2 分子振动与转动 微波 cm 4.2×10-3 无线电波 顺磁共振谱 m 4.2×10-5 电子自旋 核磁共振谱 核自旋
6.1 电磁辐射与分子运动 电子自旋 核自旋 4.2×10 顺磁共振谱 m -5 核磁共振谱 无线电波 4.2×10-3 微波 cm 远红外线 远红外光谱 15~100µm 0.84~11.9×10-2 分子振动与转动 中红外线 中红外光谱 2.5~15µm 46~0.84 键的振动与转动 近红外线 近红外光谱 800~2500 150~46 键的振动 可见光线 可见光谱 400~800 301~150 电子跃迁 紫外线 紫外光谱 200~400 598~301 电子跃迁 真空紫外 真空紫外光谱 100~200 1196~598 s电子跃迁 电磁波 光谱 波长 /nm 能量 /kJ mol-1 分子运动 光是一种电磁波,电磁波谱含盖极其宽广的波段范围

6.2紫外光谱(UV) 1.紫外光谱的基本原理 1)紫外光谱的产生(电子跃迁) △E=hv △E=hc/λ 分子吸收紫外-可见光区(200~800nm)的电磁辐射,引起 电子能级的跃迁即成键电子或非成键电子由基态跃迁到激发态。 2)电子跃迁的类型 有机分子常见的电子跃迁: o→o",元-→π,n→o*,n→元 能量顺序: 0-→0*>n→o*>元→元*>1元*
1. 紫外光谱的基本原理 1) 紫外光谱的产生(电子跃迁) 分子吸收紫外-可见光区(200~800 nm)的电磁辐射,引起 电子能级的跃迁即成键电子或非成键电子由基态跃迁到激发态。 DE = hv DE = hc/ l 6.2 紫外光谱(UV) 2) 电子跃迁的类型 有机分子常见的电子跃迁: s®s* , p®p* , n®s* , n®p* 能量顺序: s®s* > n®s* > p®p* > n®p*