
第一类电极的电极反应 电极 电极反应(还原) M(a.)M(s) M*(a)+ze→M(s) H(a.)H,(p)]Pt 2H(a)+2e→H,p) OH(a)H,(p)Pt 2H,0+2e→H,p)+2OH(a) H(a.)O,(p)1Pt 0,p)+4H(a)+4e-→2H201) OH(a)O,(p)Pt 0,(p)+2H,0+4e->40H(a) CI(a)Cl,(p)1Pt Cl,(p)+2e-→2C1(a) Na'(a.)Na(Hg)(a)Na(a)+nHg(1)+e>Na(Hg)(a)
第一类电极的电极反应 电极 电极反应(还原) M ( ) M(s) z a + + ㅣ M ( ) e M(s) z a z + − + + → H ( ) H ( ) Pt 2 a p + + ㅣ ㅣ 2 2H ( ) 2e H ( ) a p + − + + → OH ( ) H ( ) Pt 2 a p − − ㅣ ㅣ 2 2 2H O 2e H ( ) 2OH ( ) p a − − − + → + H ( ) O ( ) Pt 2 a p + + ㅣ ㅣ O ( ) 4H ( ) 4e 2H O(l) 2 2 p a − + + + + → OH ( ) O ( ) Pt 2 a p − − ㅣ ㅣ O ( ) 2H O 4e 4OH ( ) 2 2 p a − − − + + → Cl ( ) Cl ( ) Pt 2 a p − − ㅣ ㅣ Cl ( ) 2e 2Cl ( ) 2 p a − − − + → Na ( ) Na(Hg)( ) a a + + ㅣ + Na Hg(l) e Na(Hg)( ) ( ) a n a − + + + →
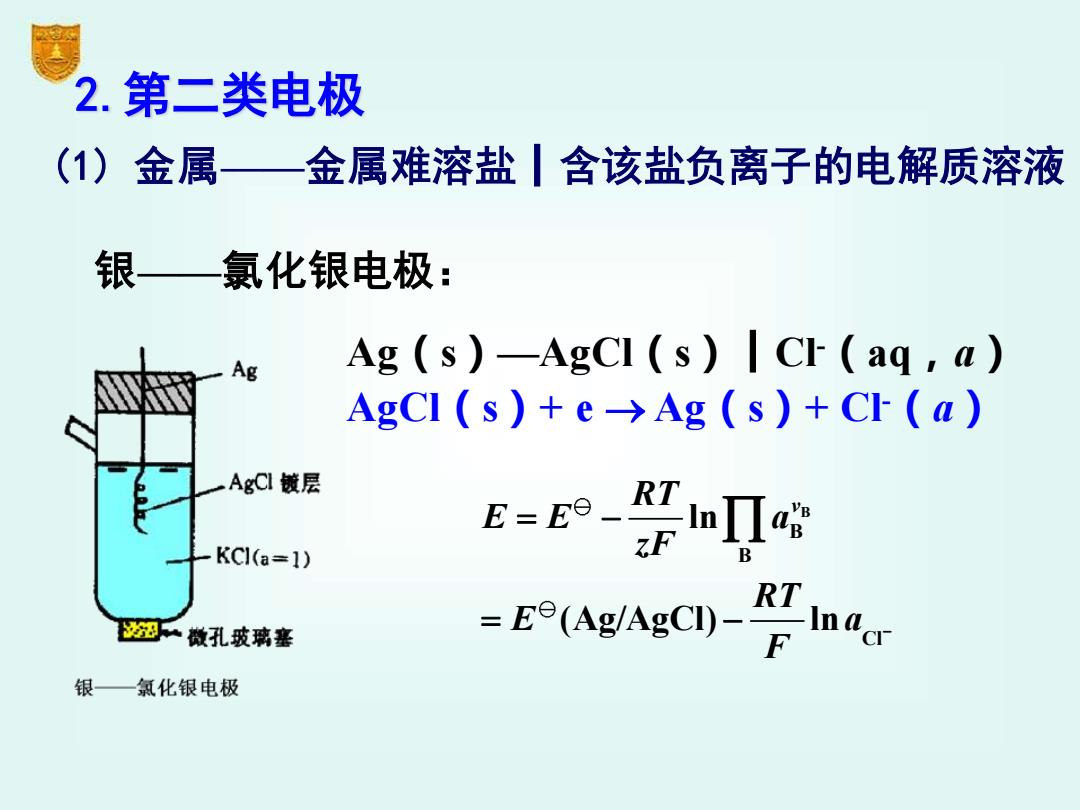
2.第二类电极 ()金属—金属难溶盐丨含该盐负离子的电解质溶液 银—氯化银电极: Ag Ag (s)-AgCI (s)CI (ag,a) AgCl(s)+e→Ag(s)+C(a) AgCl镀层 KC1(a=1) EenⅡ时 B 翅做孔玻璃塞 E(Ag/AzCD)-cr 银—氯化银电极
2.第二类电极 (1) 金属——金属难溶盐┃含该盐负离子的电解质溶液 银——氯化银电极: Ag(s)—AgCl(s)┃Cl-(aq,a) AgCl(s)+ e → Ag(s)+ Cl-(a) B B B Cl ln (Ag/AgCl) ln RT v E E a zF RT E a F − = − = −
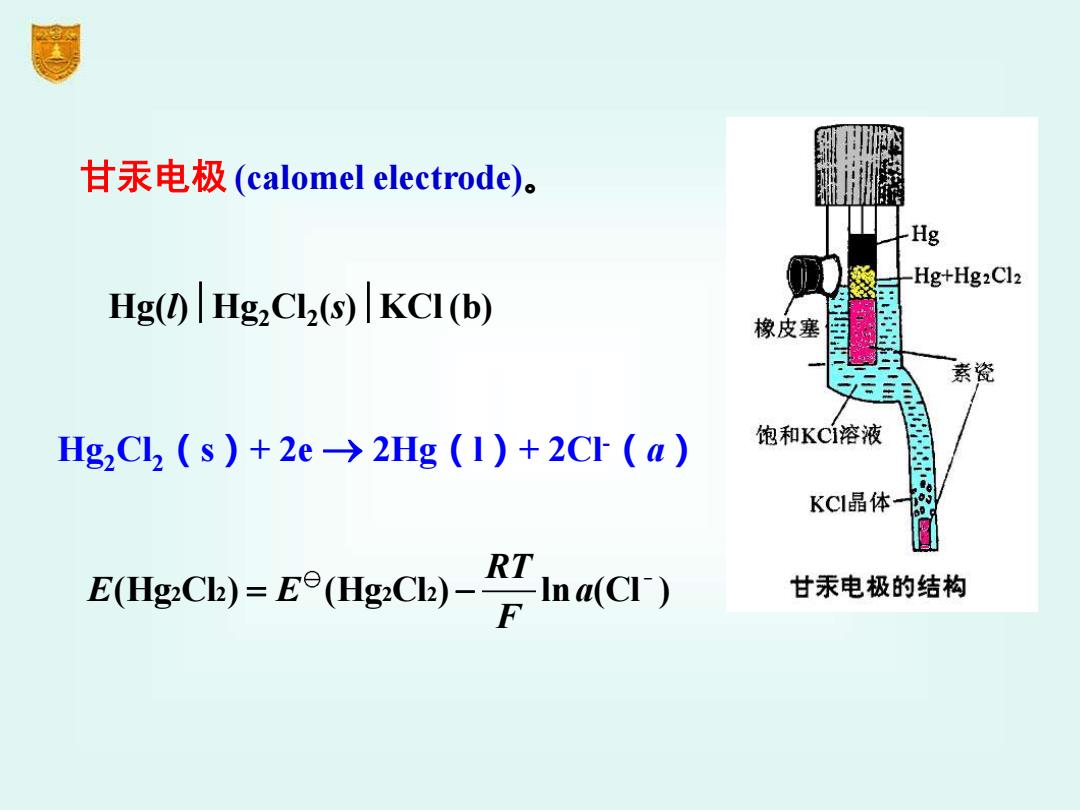
甘汞电极(calomel electrode)。 Hg Hg+Hg2Cl2 Hg(|HgzCL(s)KCI(b) 橡皮塞 无 素瓷 Hg2C2(s)+2e→2Hg(1)+2Cr(a) 饱和KC1溶液 KCI晶体 E(HgCh)(HC)-a(C) 甘汞电极的结构
甘汞电极 (calomel electrode)。 Hg(l)Hg2Cl2 (s)KCl(b) _ (Hg Cl ) (Hg Cl ) ln (Cl ) 2 2 2 2 RT E E a F = − Hg2Cl2(s)+ 2e → 2Hg(l)+ 2Cl-(a)

不同浓度KC的电极电势 CKCI (mol/dm3) E/V(25℃) 0.1 0.3335 E=03335-7×10-5(t-25) 1.0 0.2799 E=02799-2.4×10-4(t-25) 饱和saturated calomel electrode 0.2410 E=02410-7.6×10-4(t-25) (SCE) 优点:电极电势稳定,容易制备,使用方 便。电极电势稳定,受干扰小。且饱和KCI 溶液可以起到盐桥的作用
cKCl(mol/dm3) E/V(25`℃) 0.1 0.3335 E = 03335 - 7×10-5(t – 25) 1.0 0.2799 E = 02799 – 2.4×10-4(t – 25) 饱和saturated calomel electrode (SCE) 0.2410 E = 02410 – 7.6×10-4(t – 25) 优点:电极电势稳定,容易制备,使用方 便。电极电势稳定,受干扰小。且饱和KCl 溶液可以起到盐桥的作用。 不同浓度KCl的电极电势

(2)金属— 金属难溶氧化物酸或碱溶液 锑—氧化锑电极: Sb (s)I Sb2O3 (s)H(a) Sb203(s)+6H+(a)+6e→2Sb(s)+3H,0 n-00591Gpl Sb (s)I Sb,O (s)OH (a) Sb203(s)+3H0+6e→2Sb(s)+6OH(a) E-0.05916pH005916(14-PH) 6 应用一与甘汞电极组成电池,可测溶液的pH值。 优点:固体电极,使用方便 缺点:不能用于强酸溶液
(2)金属——金属难溶氧化物┃酸或碱溶液 锑——氧化锑电极: Sb(s)┃Sb2O3(s)┃H+(a) Sb2O3(s)+ 6 H+(a)+ 6e → 2 Sb(s) + 3H2O Sb(s)┃Sb2O3(s)┃OH-(a) Sb2O3(s)+ 3H2O + 6e → 2 Sb(s)+ 6 OH-(a) B B 6 B H H 1 1 ln ln ln .05916pH 6 RT RT RT v E E a E E E zF F a F a 0 + + = − = − = − = − 6 OH ln 0.05916pOH 0.05916(14 pH) 6 RT E E a E E F = − = − = + − − 应用——与甘汞电极组成电池,可测溶液的pH值。 优点:固体电极,使用方便 缺点:不能用于强酸溶液