
延安大学精品课程…物理化学 越业大学 物理化学辨稿 第十章 电解与极化作用 (6学时) 物理化学教研室 第1页共17页
延安大学精品课程 …… 物理化学 物理化学讲稿 第十章 电解与极化作用 (6 学时) 物理化学教研室 第 1 页 共 17 页
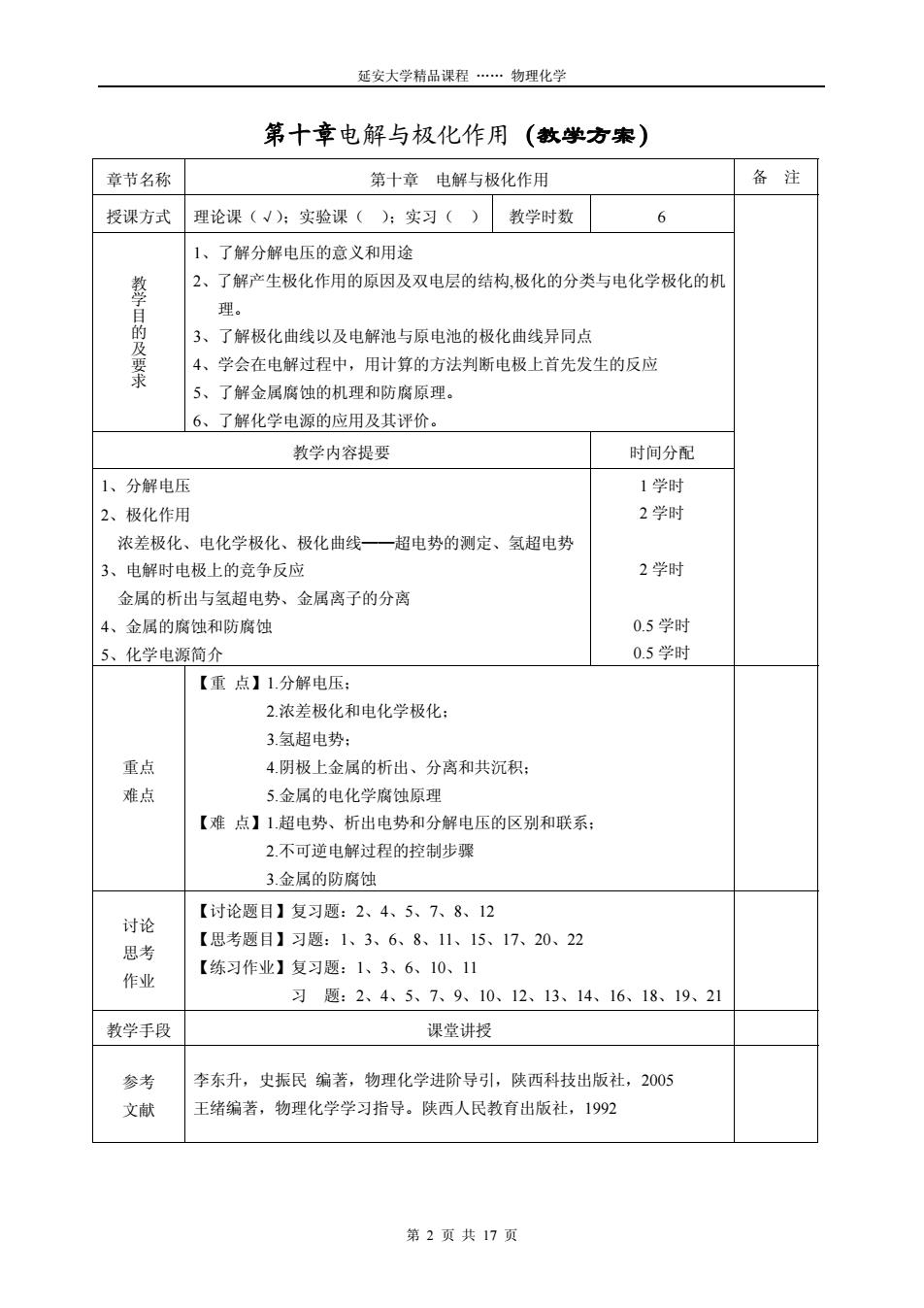
延安大学精品课程…物理化学 第十章电解与极化作用(教学方案) 章节名称 第十章电解与极化作用 备注 授课方式 理论课(√):实验课():实习() 教学时数 6 1、了解分解电压的意义和用途 2、了解产生极化作用的原因及双电层的结构,极化的分类与电化学极化的机 理。 3、了解极化曲线以及电解池与原电池的极化曲线异同点 及要求 4、学会在电解过程中,用计算的方法判断电极上首先发生的反应 5、了解金属腐蚀的机理和防腐原理。 6、 了解化学电源的应用及其评价。 教学内容提要 时间分配 1、分解电压 1学时 2、极化作用 2学时 浓差极化、电化学极化、极化曲线一一超电势的测定、氢超电势 3、电解时电极上的竞争反应 2学时 金属的析出与氢超电势、金属离子的分离 4、金属的腐蚀和防腐蚀 0.5学时 5、化学电源简介 0.5学时 【重点】1.分解电压: 2.浓差极化和电化学极化: 3.氢超电势 重点 4.阴极上金属的析出、分离和共沉积: 难点 5.金属的电化学腐蚀原理 【难点】1超电势、析出电势和分解电压的区别和联系: 2.不可逆电解过程的控制步骤 3.金属的防腐蚀 【讨论题目】复习题:2、4、5、7、8、12 讨论 【思考题目】习题:1、3、6、8、11、15、17、20、22 思考 【练习作业】复习题:1、3、6、10、11 作业 习题:2、4、5、7、9、10、12、13、14、16、18、19、21 教学手段 课堂讲授 参考 李东升,史振民编著,物理化学进阶导引,陕西科技出版社,2005 文献 王绪编著,物理化学学习指导。陕西人民教育出版社,1992 第2页共17页
延安大学精品课程 …… 物理化学 第十章电解与极化作用(教学方案) 章节名称 第十章 电解与极化作用 备 注 授课方式 理论课(√);实验课( );实习( ) 教学时数 6 教学目的及要求 1、了解分解电压的意义和用途 2、了解产生极化作用的原因及双电层的结构,极化的分类与电化学极化的机 理。 3、了解极化曲线以及电解池与原电池的极化曲线异同点 4、学会在电解过程中,用计算的方法判断电极上首先发生的反应 5、了解金属腐蚀的机理和防腐原理。 6、了解化学电源的应用及其评价。 教学内容提要 时间分配 1、分解电压 2、极化作用 浓差极化、电化学极化、极化曲线——超电势的测定、氢超电势 3、电解时电极上的竞争反应 金属的析出与氢超电势、金属离子的分离 4、金属的腐蚀和防腐蚀 5、化学电源简介 1 学时 2 学时 2 学时 0.5 学时 0.5 学时 重点 难点 【重 点】1.分解电压; 2.浓差极化和电化学极化; 3.氢超电势; 4.阴极上金属的析出、分离和共沉积; 5.金属的电化学腐蚀原理 【难 点】1.超电势、析出电势和分解电压的区别和联系; 2.不可逆电解过程的控制步骤 3.金属的防腐蚀 讨论 思考 作业 【讨论题目】复习题:2、4、5、7、8、12 【思考题目】习题:1、3、6、8、11、15、17、20、22 【练习作业】复习题:1、3、6、10、11 习 题:2、4、5、7、9、10、12、13、14、16、18、19、21 教学手段 课堂讲授 参考 文献 李东升,史振民 编著,物理化学进阶导引,陕西科技出版社,2005 王绪编著,物理化学学习指导。陕西人民教育出版社,1992 第 2 页 共 17 页

延安大学精品课程…物理化学 第十章 电解与极化 【蒸本要求】 本章主要讨论实际电化学过程的特性和规律。实用电化学过程一般都是在由净电流通过的情况下 进行的,从这个角度讲,本章主要研究不可逆情况下电极界面电荷迁移与界面电势差之间的关系以及 影响界面电荷迁移的各种因素。从另一角度看,不可逆情况下的电极反应都是一一定速率进行的,且 该速率大小受电解质浓度、电极材料和电极表面状态等因素影响。因此,也可以说本章是研究电极反 应动力学。 【本章的蒸本思路】 本章通过电解过程,电解质溶液的实际分解电压大于理论分解电压现象的分析,引出了电极极化、 析出电势和超电势的概念,接着详细分析了电极极化的原因及其类型,找出了超电势的理论计算公式。 超电势综合了电极反应的各种影响因素,是本章的最重要概念。最后利用得到的有关结论分析讨论了 金属腐蚀及防腐、电解时的电极反应规律等。下面是本章的思路框图: 【重点】 实际分解电压 理 极化作用 原因 作用 析出电势 浓差 电化学 阳极 阴极 阴极金属析出 阳极金属氧化 析出顺序 金属电化腐蚀 阴极金属 分离 和防腐 1.重点内容 分解电压 浓差极化和电化学极化 阴极上金属的析出、分离和共沉淀 金属的电化腐蚀原理 2.需熟记的公式 第3页共17页
延安大学精品课程 …… 物理化学 第十章 电解与极化 【基本要求】 本章主要讨论实际电化学过程的特性和规律。实用电化学过程一般都是在由净电流通过的情况下 进行的,从这个角度讲,本章主要研究不可逆情况下电极界面电荷迁移与界面电势差之间的关系以及 影响界面电荷迁移的各种因素。从另一角度看,不可逆情况下的电极反应都是一一定速率进行的,且 该速率大小受电解质浓度、电极材料和电极表面状态等因素影响。因此,也可以说本章是研究电极反 应动力学。 【本章的基本思路】 本章通过电解过程,电解质溶液的实际分解电压大于理论分解电压现象的分析,引出了电极极化、 析出电势和超电势的概念,接着详细分析了电极极化的原因及其类型,找出了超电势的理论计算公式。 超电势综合了电极反应的各种影响因素,是本章的最重要概念。最后利用得到的有关结论分析讨论了 金属腐蚀及防腐、电解时的电极反应规律等。下面是本章的思路框图: 【重 点】 原因 作用 析出电势 浓 差 电化学 阳极 阴 极 阴极金属析出 阳极金属氧化 实际 分解电压 理论 极化作用 ⎧ ⎨ ⎩ 析出顺序 阴极金属 分离 ⎧ ⎨ ⎩ 金属电化腐蚀 和防腐 1.重点内容 分解电压 浓差极化和电化学极化 阴极上金属的析出、分离和共沉淀 金属的电化腐蚀原理 2.需熟记的公式 第 3 页 共 17 页

延安大学精品课程…物理化学 E分解=E可递十△E不可逆+IR △E不可逆=刀阳十门例 门阴=(P年一P不可逆)用极 门阳一(p不可递一P平)用极 0阳极.析出三阳,可逆十门例 P阴极。析出三P阴,可逆-门佣 7=a+blnj 【难点】 1.超电势、析出电势和分解电压的区别和联系 超电势是指在某一反应速率下电极电势偏离平衡电势的程度。为使超电势总为正值,根据阴、阳 极反应特点给出了超电势的规定式。析电势是指以某一速率进行的电化学反应,当电极上有明显产物 生成析出时的电极电势。分解电压、析出电势都与超电势有关,但析出电势、超电势势对单个电极而 言,分解电压是对整个电解池而言。超电势、析出电势与平衡电势不同,他们随电极材料、电流密度 变化而变化。 2.不可逆电极过程的控制步骤 电极上任何一个电化学过程都必定经过扩散和界面电子迁移这两个步骤。如果扩散在整个电极过程 中速度最慢,那么整个电极过程称为受扩散控制。反之,就称为受电化学控制。纯扩散控制,纯电化 学控制的动力学热点不同,主要反映到一j极化曲线上。如果电势达到一定值后,电流密度保持不变, 在一j曲线上出现平台,表示电极过程为浓差控制,平台处的电流密度称为电极极化的极限电流j妇, 如图所示。如果7与lnj称线性关系,表示电极过程势电化学控制。通过7一nj曲线的斜率b和截距a 可求得电化学反应的重要参数一电子传递系数a和交换电流密度j妇· 3.为什么以平滑铂片为电极分别电解KOH、NaOH、NH4OH、HNO3、HSO4、HPO4水溶液时电解 产物都是H和O2?为什么氢在不同电极上的析出电势差别甚大? 上述几种电解质水溶液在阴极区阳离子有H、K、Na、NH4等,阳极区的阴离子有OH、NO、 SO4ˉ等。从电极反应规律看,阴极上首先进行电极电势较低的氧化反应。上述几种阴离子,以OH/O2,Pt, H+/O2,Pt电极电势较低,所以阴极主要发生析氢反应,阳极主要发生析氧反应。一般认为,H+在阴极 上的放电过程以H2的析出为控制步骤,其极化曲线可用塔菲尔公式中的常数a是超电势的主要影响因 素,的大小取决于电极反应的交换电流密度j。。由于H在不同电极材料上超电势也有较大差别,有时 使氢在阴极上难以析出。如用C和Hg作电解NaCI的阴极时,前者阴极产物为H2,后者阴极产物为Na一 Hg齐。所以,电极材料不同时,氢的析出电势可能有较大差别。 4.计算电化学腐蚀和防腐 金属腐蚀是金属单质发生氧化反应生成金属离子或化合物,使金属受损的现象。原则上,大多数在 热力学上都有氧化趋势。但在通常情况下,其腐蚀速率很慢,然而当金属成为原电池的阳极后,腐蚀 速度会极大提高。这时,必然存在着一个共轭的阴极反应。电化学腐蚀的特点为电化学腐蚀的特点为 第4页共17页
延安大学精品课程 …… 物理化学 ( ) ( ) a blnj E E E IR E η η η ϕϕ ηϕ ϕ ϕ ϕη ϕ ϕη η Δ + Δ = =2 分解 可逆 不可逆 不可逆 阳 阴 阴 平 不可逆 阴极 阳 不可逆 平 阳极 阳极,析出 阳,可逆 阴 阴极,析出 阴,可逆- 阴 H = + + = - = - = + = + 【难 点】 1.超电势、析出电势和分解电压的区别和联系 超电势是指在某一反应速率下电极电势偏离平衡电势的程度。为使超电势总为正值,根据阴、阳 极反应特点给出了超电势的规定式。析电势是指以某一速率进行的电化学反应,当电极上有明显产物 生成析出时的电极电势。分解电压、析出电势都与超电势有关,但析出电势、超电势势对单个电极而 言,分解电压是对整个电解池而言。超电势、析出电势与平衡电势不同,他们随电极材料、电流密度 变化而变化。 2.不可逆电极过程的控制步骤 电极上任何一个电化学过程都必定经过扩散和界面电子迁移这两个步骤。如果扩散在整个电极过程 中速度最慢,那么整个电极过程称为受扩散控制。反之,就称为受电化学控制。纯扩散控制,纯电化 学控制的动力学热点不同,主要反映到η-j极化曲线上。如果电势达到一定值后,电流密度保持不变, 在η-j曲线上出现平台,表示电极过程为浓差控制,平台处的电流密度称为电极极化的极限电流 , 如图所示。如果 d j η 与 称线性关系,表示电极过程势电化学控制。通过 lnj η-lnj曲线的斜率 b 和截距 a 可求得电化学反应的重要参数-电子传递系数 a 和交换电流密度 j d 。 3.为什么以平滑铂片为电极分别电解KOH、NaOH、NH4OH、HNO3、H2SO4、H3PO4水溶液时电解 产物都是H2和O2?为什么氢在不同电极上的析出电势差别甚大? 上述几种电解质水溶液在阴极区阳离子有H+ 、K+ 、Na+、NH4 + 等,阳极区的阴离子有OH- 、NO3 - 、 SO4 - 等。从电极反应规律看,阴极上首先进行电极电势较低的氧化反应。上述几种阴离子,以OH- /O2,Pt, H+/ O2,Pt电极电势较低,所以阴极主要发生析氢反应,阳极主要发生析氧反应。一般认为,H+在阴极 上的放电过程以H2的析出为控制步骤,其极化曲线可用塔菲尔公式中的常数a是超电势的主要影响因 素,a的大小取决于电极反应的交换电流密度 j 0 。由于H2在不同电极材料上超电势也有较大差别,有时 使氢在阴极上难以析出。如用C和Hg作电解NaCl的阴极时,前者阴极产物为H2,后者阴极产物为Na- Hg齐。所以,电极材料不同时,氢的析出电势可能有较大差别。 4.计算电化学腐蚀和防腐 金属腐蚀是金属单质发生氧化反应生成金属离子或化合物,使金属受损的现象。原则上,大多数在 热力学上都有氧化趋势。但在通常情况下,其腐蚀速率很慢,然而当金属成为原电池的阳极后,腐蚀 速度会极大提高。这时,必然存在着一个共轭的阴极反应。电化学腐蚀的特点为电化学腐蚀的特点为 第 4 页 共 17 页

延安大学精品课程…物理化学 电池自身短路,无外电流,只有内电流。电化学腐蚀主要原因是将被保护的金属置于原电池或电解池 的阴极,称为阴极保护法。也有将被保护金属置于被保护金属置于阳极,发生氧化钝化,生成致密坚 固的表面钝化膜来保护金属。 支a,)-gn-n点 一式的推导。 c F j-j 该式的推导思路如下:电解时,离子有两种方式从溶液本体(浓度为℃)迁移至电极表面附近(浓 度为℃、)发生反应。一种电迁移方式,其迁移速率为: 电=t+·jS(nF) 另一种为浓差扩散方式,其迁移速率为: I扩敢=D·S(c一c,)/δ 且有=电十扩散 即jS=+jS+Ds(c-c nF nF 在电解液中加入大量只参与导电而不参与电极反应的支持电解质时,1≈0,则有 J=i 8(c-c)=Ke-c,) 当扩散电流广逐渐怎大时,C,逐渐减小,极限情况,C,=0。此时,j达到最大值,称为极限扩散 电流ja。故 = -c=Kc I=nFD (c-c,)=Kc-Ke,=ja-Ke, 电极在电流密度广时实际电极电势仍符合能斯特方程,即: Inc nF p送=p+RT ne nF 故刀体差Oa世P不可屈=hC=R7 In-Jd "cs nF j 以上推导中,D为扩散系数,S为电极面积,6为扩散层厚度。 第5页共17页
延安大学精品课程 …… 物理化学 电池自身短路,无外电流,只有内电流。电化学腐蚀主要原因是将被保护的金属置于原电池或电解池 的阴极,称为阴极保护法。也有将被保护金属置于被保护金属置于阳极,发生氧化钝化,生成致密坚 固的表面钝化膜来保护金属。 5. ( ) d s d c j ln ln c j RT RT F F η ϕϕ 阴平 阴 =- = = 不可逆 -j / 一式的推导。 该式的推导思路如下:电解时,离子有两种方式从溶液本体(浓度为c )迁移至电极表面附近(浓 度为 )发生反应。一种电迁移方式,其迁移速率为: s c r t j /(n 电= ) + ⋅ ⋅ S F 另一种为浓差扩散方式,其迁移速率为: s r (c c ) 扩散= - D S⋅ δ 且有 rr r = +电 扩散 即 j ( t j n n S D S S c c) F F δ + ⋅ ⋅ - = + 在电解液中加入大量只参与导电而不参与电极反应的支持电解质时,t+ ≈ 0 ,则有 ( )( ) s s jFD j c c Kc c δ = −= − 当扩散电流 j 逐渐怎大时, s c 逐渐减小,极限情况, 0 s c = 。此时, j 达到最大值,称为极限扩散 电流 dj 。故 ( ) d s sd s nFD j c Kc nFD j c c Kc Kc j Kc δ δ = = = − = − =− 电极在电流密度 j 时实际电极电势仍符合能斯特方程,即: s ln c n ln c n RT F RT F θ θ ϕ ϕ ϕ ϕ 不可逆 可逆 = + = + 故 ( ) d s d c j ln ln n c n jj RT RT F F η ϕϕ 浓差,阴 可逆 不可逆 =- = = 阴 - 以上推导中, 为扩散系数, 为电极面积, D S δ 为扩散层厚度。 第 5 页 共 17 页