
丝安大字 物理化学游穑 第九章 可逆电池的电动势及其应用 (12学时) 物理化学教研室
1 物理化学讲稿 第九章 可逆电池的电动势及其应用 (12 学时) 物理化学教研室
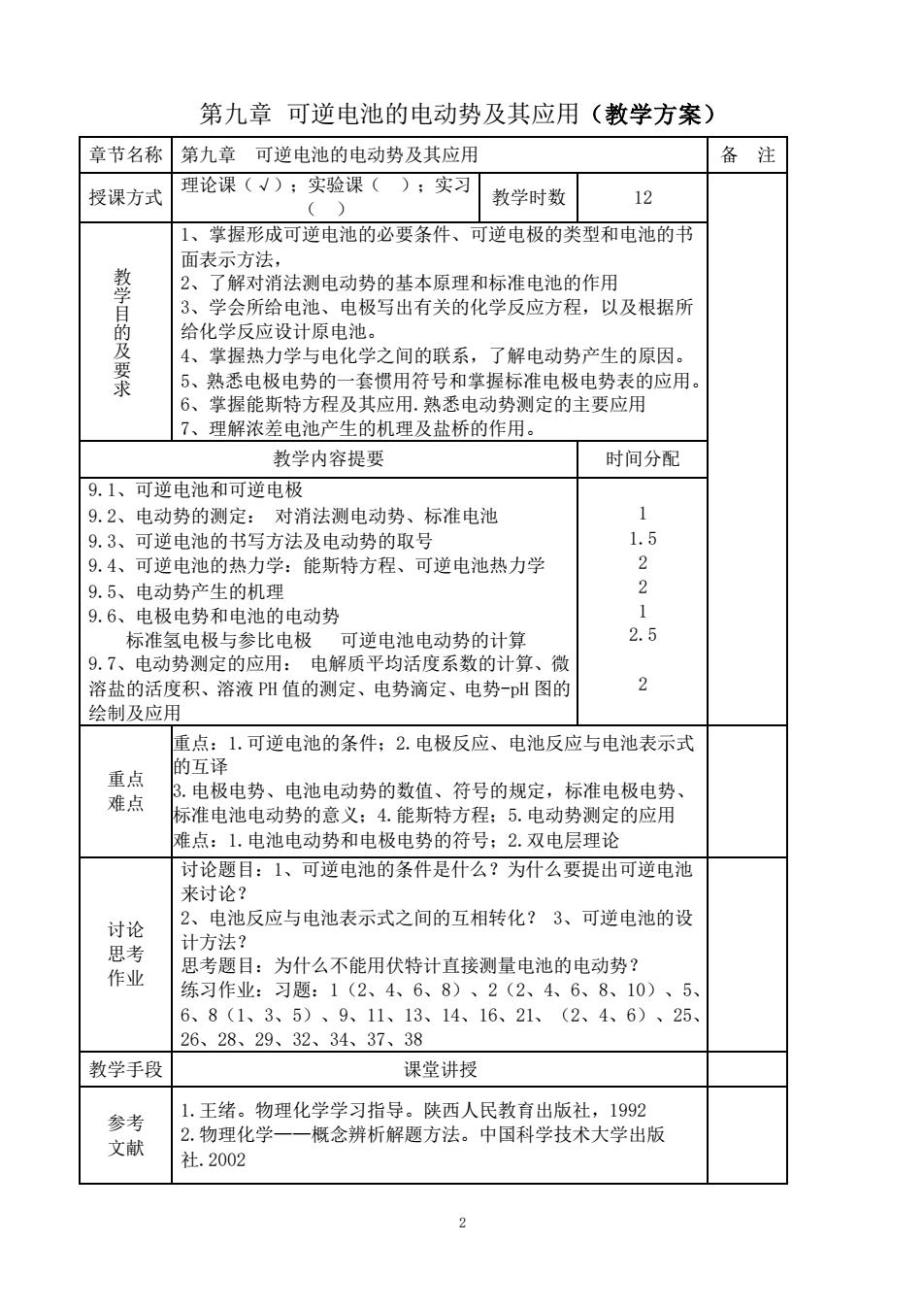
第九章可逆电池的电动势及其应用(教学方案) 章节名称 第九章 可逆电池的电动势及其应用 备注 理论课(√);实验课( 授课方式 );实习 () 教学时数 12 1、掌握形成可逆电池的必要条件、可逆电极的类型和电池的书 面表示方法, 教学目的 2、了解对消法测电动势的基本原理和标准电池的作用 3、学会所给电池、电极写出有关的化学反应方程, 以及根据所 给化学反应设计原电池。 4、掌握热力学与电化学之间的联系,了解电动势产生的原因。 求 5、熟悉电极电势的一套惯用符号和掌握标准电极电势表的应用。 6、掌握能斯特方程及其应用.熟悉电动势测定的主要应用 7、理解浓差电池产生的机理及盐桥的作用。 教学内容提要 时间分配 9.1、可逆电池和可逆电极 9.2、电动势的测定:对消法测电动势、标准电池 1 9.3、可逆电池的书写方法及电动势的取号 1.5 9.4、可逆电池的热力学:能斯特方程、可逆电池热力学 2 9.5、电动势产生的机理 2 9.6、电极电势和电池的电动势 1 标准氢电极与参比电极可逆电池电动势的计算 2.5 9.7、电动势测定的应用:电解质平均活度系数的计算、微 溶盐的活度积、溶液PH值的测定、电势滴定、电势-pH图的 2 绘制及应用 重点:1.可逆电池的条件:2.电极反应、电池反应与电池表示式 的互译 重点 难点 3.电极电势、电池电动势的数值、符号的规定,标准电极电势、 标准电池电动势的意义;4.能斯特方程:5.电动势测定的应用 难点:1.电池电动势和电极电势的符号:2.双电层理论 讨论题目:1、可逆电池的条件是什么?为什么要提出可逆电池 来讨论? 讨论 2、电池反应与电池表示式之间的互相转化?3、可逆电池的设 思考 计方法? 作业 思考题目:为什么不能用伏特计直接测量电池的电动势? 练习作业:习题:1(2、4、6、8)、2(2、4、6、8、10)、5、 6、8(1、3、5)、9、11、13、14、16、21、(2、4、6)、25、 26、28、29、32、34、37、38 教学手段 课堂讲授 参考 1.王绪。物理化学学习指导。陕西人民教育出版社,1992 文献 2.物理化学一一概念辨析解题方法。中国科学技术大学出版 社.2002
2 第九章 可逆电池的电动势及其应用(教学方案) 章节名称 第九章 可逆电池的电动势及其应用 备 注 授课方式 理论课(√);实验课( );实习 ( ) 教学时数 12 教 学 目 的 及 要 求 1、掌握形成可逆电池的必要条件、可逆电极的类型和电池的书 面表示方法, 2、了解对消法测电动势的基本原理和标准电池的作用 3、学会所给电池、电极写出有关的化学反应方程,以及根据所 给化学反应设计原电池。 4、掌握热力学与电化学之间的联系,了解电动势产生的原因。 5、熟悉电极电势的一套惯用符号和掌握标准电极电势表的应用。 6、掌握能斯特方程及其应用.熟悉电动势测定的主要应用 7、理解浓差电池产生的机理及盐桥的作用。 教学内容提要 时间分配 9.1、可逆电池和可逆电极 9.2、电动势的测定: 对消法测电动势、标准电池 9.3、可逆电池的书写方法及电动势的取号 9.4、可逆电池的热力学:能斯特方程、可逆电池热力学 9.5、电动势产生的机理 9.6、电极电势和电池的电动势 标准氢电极与参比电极 可逆电池电动势的计算 9.7、电动势测定的应用: 电解质平均活度系数的计算、微 溶盐的活度积、溶液 PH 值的测定、电势滴定、电势-pH 图的 绘制及应用 1 1.5 2 2 1 2.5 2 重点 难点 重点:1.可逆电池的条件;2.电极反应、电池反应与电池表示式 的互译 3.电极电势、电池电动势的数值、符号的规定,标准电极电势、 标准电池电动势的意义;4.能斯特方程;5.电动势测定的应用 难点:1.电池电动势和电极电势的符号;2.双电层理论 讨论 思考 作业 讨论题目:1、可逆电池的条件是什么?为什么要提出可逆电池 来讨论? 2、电池反应与电池表示式之间的互相转化? 3、可逆电池的设 计方法? 思考题目:为什么不能用伏特计直接测量电池的电动势? 练习作业:习题:1(2、4、6、8)、2(2、4、6、8、10)、5、 6、8(1、3、5)、9、11、13、14、16、21、(2、4、6)、25、 26、28、29、32、34、37、38 教学手段 课堂讲授 参考 文献 1.王绪。物理化学学习指导。陕西人民教育出版社,1992 2.物理化学——概念辨析解题方法。中国科学技术大学出版 社.2002

第九章可逆电池的电动势及其应用 引言: 在这一章中的电池指的是原电池,使电解质和电极自发的反应向外放电,如果是在等温,等压时,该 体系的吉布斯自由能的减少等于体系对外作的最大非体积功:即 <表示自发过程 (△,G)r,p,R≤W:mx=表示自发性可逆 >表示不可能发生的过程 如果该非体积功只有电功的情况下,有:(△,G)r,p≤Wmx=-nEF 当反应进度为1摩尔时:(△,Ghp≤-EF:= 5 可见:当电池中的反应为可逆过程(热力学可逆)时(△,Gm)p=-EF 当电池中的反应为不可逆过程(热力学不可逆)时(△,Gm)h,p<-EF 电化学与热力学的联系 热力学 电化学 虽然实际工作的电池并不可能是可逆的,但是只有可逆时E与△G有直接相等的关系,因此,研究可 逆电池和可逆电极是很重要的,为了从理论上弄清楚它的重要性,必须了解可逆电池,可逆电极、电动势 及产生的原理、理论计算方法和他们在实际中的应用。 重要公式:(△,G)r,pR=Wmx=-nEF 如何把化学反应转变成电能? 1、该化学反应是氧化还原反应,或包含有氧化还原的过程: 2、有适当的装置,使化学反应分别通过在电极上的反应来完成: 3、有两个电极和与电极建立电化学平衡的相应电解质: 4、有其他附属设备,组成一个完整的电路。 本章基本要求 1、明确掌电动势与△Gm的关系,掌握电极电势、电池的书面表示的一套符号: 2、熟悉标准电极电势表的应用: 3、掌握写出所给电池的电极反应和电池反应,能根据所给化学反应设计原电池: 4、熟悉热力学与电化学之间的联系: 5、熟练掌握能斯特方程及其应用以及电动势的计算: 6、明确温度对电动势的影响,了解△Hm和△rSm的计算; 7、了解电动势产生的原因及电动势测定的一些应用
3 第九章 可逆电池的电动势及其应用 引言: 在这一章中的电池指的是原电池,使电解质和电极自发的反应向外放电,如果是在等温,等压时,该 体系的吉布斯自由能的减少等于体系对外作的最大非体积功:即 r , , f,max ( ) G W T p R = 表示自发过程 表示自发性可逆 表示不可能发生的过程 < > 如果该非体积功只有电功的情况下,有: r , f,max ( ) = − G W nEF T p 当反应进度为 1 摩尔时: r , ( ) − G zEF m T p n z = 可见:当电池中的反应为可逆过程(热力学可逆)时 r , ( ) = − G zEF m T p 当电池中的反应为不可逆过程(热力学不可逆)时 r , ( ) − G zEF m T p < 电化学与热力学的联系 虽然实际工作的电池并不可能是可逆的,但是只有可逆时 E 与△G 有直接相等的关系,因此,研究可 逆电池和可逆电极是很重要的,为了从理论上弄清楚它的重要性,必须了解可逆电池,可逆电极、电动势 及产生的原理、理论计算方法和他们在实际中的应用。 重要公式:: r , , f,max ( ) = = − G W nEF T p R 如何把化学反应转变成电能? 1、该化学反应是氧化还原反应,或包含有氧化还原的过程; 2、有适当的装置,使化学反应分别通过在电极上的反应来完成; 3、有两个电极和与电极建立电化学平衡的相应电解质; 4、有其他附属设备,组成一个完整的电路。 本章基本要求 1、明确掌电动势与△rGm 的关系,掌握电极电势、电池的书面表示的一套符号; 2、熟悉标准电极电势表的应用; 3、掌握写出所给电池的电极反应和电池反应,能根据所给化学反应设计原电池; 4、熟悉热力学与电化学之间的联系; 5、熟练掌握能斯特方程及其应用以及电动势的计算; 6、明确温度对电动势的影响,了解△rHm 和△rSm 的计算; 7、了解电动势产生的原因及电动势测定的一些应用

§9.1可逆电池和可逆电极 一、可逆电池和不可逆电池 热力学指出,体系经过某一变化后,当沿着相反方向回到原来到状态,环境也同时恢复到原态,则原 过程是热力学可逆过程否则就是不可逆过程,根据这一性质,电池可分为可逆电池和不可逆电池两种。如 电池:是与一个外电源并联。 当外加电势V比电池的电动势E小8V时,电池放电,反应为: 在Zn极上:Zn-2e→Zn2+ Zn Ag 在AgC1-Ag极上:2AgCI(s)+2e→2Ag(s)+2CI AgCI 总反应:2AgCl(s)+Zn→2Ag(s)+2CT+Zn2 、 ZnCl2 当外加电势V比电池的电动势E大δV时,电池充电,反应为: 在Zn极上:Zn2++2e→Zn 在AgC1-Ag极上:2Ag(s)+2CT-2e→2AgCl(s) 总反应:2Ag(s)+2CI+Zn2+→2AgCl(s)+Zn 0.810V ZnSo 化学反应可逆 能量变化可逆 Zn(s)|ZnS0I |HCI|AgC1(s)Ag(s) 作原电池 (-)Zn(s)→Zn2++2e (+)2AgCI(s)+2e-->2Ag(s)+2CI- 净反应 Zn(s)+2AgCI(s)->2Ag(s)+2CI+Zn2 作电解池阴极:Zn2++2e→Zn(s) 阳极2Ag(s)+2CI→2AgCl(s)+2e 净反应:2Ag(s)+ZnCl2→Zn(s)+2AgCl(s)
4 §9.1 可逆电池和可逆电极 一、可逆电池和不可逆电池 热力学指出,体系经过某一变化后,当沿着相反方向回到原来到状态,环境也同时恢复到原态,则原 过程是热力学可逆过程否则就是不可逆过程,根据这一性质,电池可分为可逆电池和不可逆电池两种。如 电池:是与一个外电源并联。 当外加电势 V 比电池的电动势 E 小δV 时,电池放电,反应为: 在 Zn 极上: 2 Zn e Zn 2 + − → 在 AgCl-Ag 极上: 2 ( ) 2 2 ( ) 2 AgCl s e Ag s Cl− + → + 总反应: 2 2 ( ) 2 ( ) 2 AgCl s Zn Ag s Cl Zn − + + → + + 当外加电势 V 比电池的电动势 E 大δV 时,电池充电,反应为: 在 Zn 极上: 2 Zn e Zn 2 + + → 在 AgCl-Ag 极上: 2 ( ) 2 2 2 ( ) Ag s Cl e AgCl s − + − → 总反应: 2 2 ( ) 2 2 ( ) Ag s Cl Zn AgCl s Zn − + + + → + 化学反应可逆 能量变化可逆 Zn(s)|ZnSO4 ||HCl|AgCl(s) | Ag(s) 作原电池 2 ( ) Zn(s) Zn 2e + − − ⎯⎯→ + ( ) 2AgCl(s) 2e 2Ag(s) 2Cl − − + + ⎯⎯→ + 净反应 2 Zn(s) 2AgCl(s) 2Ag(s) 2Cl Zn − + + ⎯⎯→ + + 作电解池 阴极: 2 Zn 2e Zn(s) + − + ⎯⎯→ 阳极 2Ag(s) 2Cl 2AgCl(s) 2e − − + ⎯⎯→ + 净反应: 2 2Ag(s) ZnCl Zn(s) 2AgCl(s) + ⎯⎯→ + A Zn Ag AgCl ZnCl2

可见,该电池在充放电时的化学反应恰好相反,即电池反应重物质变化是可逆的,同时内外电压只相 差无限小的值,说明电池反应是在十分接近于平衡态下进行的,因此当电池恢复原状时,在环境中也不会 留下任何痕迹,这样的电池就符合热力学可逆的条件,故称为可逆电池。 总之,可逆电池必须具备两个基本条件: 1、电池中化学反应必须是可逆的,即电极上的化学反应可向正反两个方向进行。(物质可逆) 2、电池充放电时,必须符合E-V=±V的条件,即充放电时所通过的电流必须十分微小,电池可 以在接近平衡状态下工作,或放电时的能量全部可用来充电,使体系和环境都回到原来的状态。(能量转 化可逆)。 只有同时满足上述两个条件的电池才是可逆电池,即可逆电池在充电和放电时不仅物质转变是可逆的 (即总反应可逆),而且能量的转变也是可逆的(即电极上的正、反向反应是在平衡状态下进行的)。若 不能同时满足上述两个条件的电池均是不可逆电池。不可逆电池两电极之间的电势差E'将随具体工作条 件而变化,且恒小于该电池的电动势。 如当外加电势V比电池的电动势E小8V时,电池放电,反应为: 在Zn极上:Zn-2e→Zn2+ Zn CU 在Cu极上:2H++2e→H(g) 总反应: 2H+Zn放电→Zn2*+H,(g) 当外加电势V比电池的电动势E大8V时,电池充电,反应为: 在Zn极上:2H+2e→H2(g) 在Cu极上:Cu-2e→C2+ 总反应:Cu+2H电→H,(g)+C 可见:即使所通入的电流很小时,充放电过程的化学反应并不相同,即,不可能使电池恢复到原态而 不引起其他变化,即该电池称为不可逆电池,当然并不是所有的反应可逆的电池都是可逆电池,如上第一 个电池,如果充电时内外电压相差很大时明反应虽然可逆,但是能量不可逆,再比如,常用的铅蓄电池, 从化学反应来看符合可逆电池的条件1,但实际充放电时,内外电压相差很大,其中的部分电能或化学能 转变为热,而这部分热再转化为功时,环境中必然留下痕迹(热功转化不可逆性)所以常用的铅蓄电池是 不可逆电池。 电池还可你根据其装置分为单液电池和双液电池: Pt Zn 盐桥 ZnSO.(aq) AgCl+Ag 素瓷烧杯 CuSO,(ag) nso.(a 2双液电池 3双液电池 1单液电池 (用素烧瓷分开) (用盐桥分开) 严格的说,双液电池都是不可逆电池,因为在两种电解质之间要又扩散过程,如2电池,在放电时, Zn2会向CuS0,溶液扩散(因为放电过程中负极Zn浓度增加,而Cu"浓度降低),而在充电时,Cu会向
5 可见,该电池在充放电时的化学反应恰好相反,即电池反应重物质变化是可逆的,同时内外电压只相 差无限小的值,说明电池反应是在十分接近于平衡态下进行的,因此当电池恢复原状时,在环境中也不会 留下任何痕迹,这样的电池就符合热力学可逆的条件,故称为可逆电池。 总之,可逆电池必须具备两个基本条件: 1、电池中化学反应必须是可逆的,即电极上的化学反应可向正反两个方向进行。(物质可逆) 2、电池充放电时,必须符合 E V V − = 的条件,即充放电时所通过的电流必须十分微小,电池可 以在接近平衡状态下工作,或放电时的能量全部可用来充电,使体系和环境都回到原来的状态。(能量转 化可逆)。 只有同时满足上述两个条件的电池才是可逆电池,即可逆电池在充电和放电时不仅物质转变是可逆的 (即总反应可逆),而且能量的转变也是可逆的(即电极上的正、反向反应是在平衡状态下进行的)。若 不能同时满足上述两个条件的电池均是不可逆电池。不可逆电池两电极之间的电势差E′将随具体工作条 件而变化,且恒小于该电池的电动势。 如当外加电势V比电池的电动势E小δV时,电池放电,反应为: 在 Zn 极上: 2 Zn e Zn 2 + − → 在 Cu 极上: 2 2 2 ( ) H e H g + + → 总反应: 2 2 2H Zn Zn H + + + ⎯⎯⎯→ + 放电 (g) 当外加电势 V 比电池的电动势 E 大δV 时,电池充电,反应为: 在 Zn 极上: 2 2 2 ( ) H e H g + + → 在 Cu 极上: 2 Cu e Cu 2 + − → 总反应: 2 2 Cu H H g Cu 2 ( ) + + + ⎯⎯⎯→ + 充电 可见:即使所通入的电流很小时,充放电过程的化学反应并不相同,即,不可能使电池恢复到原态而 不引起其他变化,即该电池称为不可逆电池,当然并不是所有的反应可逆的电池都是可逆电池,如上第一 个电池,如果充电时内外电压相差很大时明反应虽然可逆,但是能量不可逆,再比如,常用的铅蓄电池, 从化学反应来看符合可逆电池的条件 1,但实际充放电时,内外电压相差很大,其中的部分电能或化学能 转变为热,而这部分热再转化为功时,环境中必然留下痕迹(热功转化不可逆性)所以常用的铅蓄电池是 不可逆电池。 电池还可你根据其装置分为单液电池和双液电池: 严格的说,双液电池都是不可逆电池,因为在两种电解质之间要又扩散过程,如 2 电池,在放电时, Zn2+会向 CuSO4 溶液扩散(因为放电过程中负极 Zn2+浓度增加,而 Cu2+浓度降低),而在充电时,Cu2+会向 A Zn Cu H2SO4 1 单液电池 2 双液电池 (用素烧瓷分开) 3 双液电池 (用盐桥分开)