
杂环化合物 在环状化合物中,组成环的原子除碳原子外,还有其他非碳原子时,这类化 合物称为杂环化合物。这些非碳原子叫做杂原子,常见的杂原子有氮、氧、硫。 杂环化合物主要分为两大类,一类是没有芳香性的杂环化合物:另一类是环 系比较稳定,并且有不同程度芳香性的杂环化合物,本章主要讨论这一类杂环化 合物。此外,内酯、环醚、环酐等也属于杂环化合物,但它们的性质与脂肪族化 合物相似,不放在这里讨论 一、杂环化合物的结构 (一)五元杂环化合物的结构与芳香性 五元杂环化合物如呋喃、噻吩、吡咯的结构和苯相类似。构成环的5个原子 均为sp杂化状态,它们各以两个s即杂化轨道通过。键相连形成一个平面的五 元环。每个碳原子余下的1个p轨道有1个电子,杂原子(N,S,O)的p轨道上 有一对未共用电子对。这5个p轨道都垂直于五元环的平面,相互平行重叠,构 成一个有6个π电子的闭合共轭体系,即组成杂环的原子都在同一平面内,而P 电子云则分布在环平面的上下方,如下图所示。 、 N-H 呋喃 噻盼 吡略 图呋哺、鏖吩和吡略的分子结构示意图 由图可看出,呋喃、噻吩、吡咯的结构和苯结构相似,都是由6个π电子组 成的闭合共轭体系。因此,它们都具有一定的芳香性,即不易氧化,不易进行加 成反应,而易发生亲电取代反应。并且由于共轭体系中的6个π电子分散在5 个原子上,使环上碳原子的电子云密度较苯大,比苯更容易发生亲电取代反应。 (二)六元杂环化合物的结构与芳香性 六元杂环的结构可以吡啶为例来说明。5个碳原子和1个氮原子都是s即杂 化状态,处于同一平面上,相互以σ键连接成环状结构。每个原子各有1个电子
杂环化合物 在环状化合物中,组成环的原子除碳原子外,还有其他非碳原子时,这类化 合物称为杂环化合物。这些非碳原子叫做杂原子,常见的杂原子有氮、氧、硫。 杂环化合物主要分为两大类,一类是没有芳香性的杂环化合物;另一类是环 系比较稳定,并且有不同程度芳香性的杂环化合物,本章主要讨论这一类杂环化 合物。此外,内酯、环醚、环酐等也属于杂环化合物,但它们的性质与脂肪族化 合物相似,不放在这里讨论。 一、杂环化合物的结构 (一)五元杂环化合物的结构与芳香性 五元杂环化合物如呋喃、噻吩、吡咯的结构和苯相类似。构成环的 5 个原子 均为 sp 2 杂化状态,它们各以两个 sp 2 杂化轨道通过 σ 键相连形成一个平面的五 元环。每个碳原子余下的 1 个 p 轨道有 1 个电子,杂原子(N,S,O)的 p 轨道上 有一对未共用电子对。这 5 个 p 轨道都垂直于五元环的平面,相互平行重叠,构 成一个有 6 个 π 电子的闭合共轭体系,即组成杂环的原子都在同一平面内,而 p 电子云则分布在环平面的上下方,如下图所示。 N O S H O S N H 呋喃 噻吩 吡咯 图 呋喃、噻吩和吡咯的分子结构示意图 由图可看出,呋喃、噻吩、吡咯的结构和苯结构相似,都是由 6 个 π 电子组 成的闭合共轭体系。因此,它们都具有一定的芳香性,即不易氧化,不易进行加 成反应,而易发生亲电取代反应。并且由于共轭体系中的 6 个 π 电子分散在 5 个原子上,使环上碳原子的电子云密度较苯大,比苯更容易发生亲电取代反应。 (二)六元杂环化合物的结构与芳香性 六元杂环的结构可以吡啶为例来说明。5 个碳原子和 1 个氮原子都是 sp 2杂 化状态,处于同一平面上,相互以 σ 键连接成环状结构。每个原子各有 1 个电子

在p轨道上,p轨道与环平面垂直,彼此“肩并肩”重叠形成6个π电子的闭合 共轭体系。但要注意氮原子上的一对未共用电子对在$即杂化轨道上,它与环共 平面,因而不参与环的共轭体系,不是6电子大π键体系的组成部分,而是以未 共用电子对形式存在,如下图12-2所示。 图吡啶的分子结构示意图 可见,吡啶也具有芳香性。然而又由于吡啶环中氮原子的电负性大于碳原子, 所以环上的电子云密度因向氮原子转移而降低,亲电取代比苯困难。 二、杂环化合物的分类和命名 (一)分类 杂环化合物可按杂环的骨架分为单杂环和稠杂环。单杂环又按环的大小分为 五元杂环和六元杂环:稠杂环按其稠合环形式分为苯稠杂环和稠杂环。如表12-1 所示。 (二)命名 1.杂环化合物的命名根据外文名称的译音,选用同音汉字,再加上“口” 字旁命名。例如:呋喃、噻吩、吡咯、毗啶,就是根据furan、thiophene、pyrrole. pyridine等英文名称音译的。 表常见杂环化合物的结构和名称 重要杂环 类 含一个杂原子的杂环 含两个以上杂原子的杂环 公 杂 喽吩 吡咯 此唑 味唑 噁唑 thiophene pyrrole pyrazole imidazole oxazole
在 p 轨道上,p 轨道与环平面垂直,彼此“肩并肩”重叠形成 6 个 π 电子的闭合 共轭体系。但要注意氮原子上的一对未共用电子对在 sp 2 杂化轨道上,它与环共 平面,因而不参与环的共轭体系,不是 6 电子大 π 键体系的组成部分,而是以未 共用电子对形式存在,如下图 12-2 所示。 N N 吡啶 图 吡啶的分子结构示意图 可见,吡啶也具有芳香性。然而又由于吡啶环中氮原子的电负性大于碳原子, 所以环上的电子云密度因向氮原子转移而降低,亲电取代比苯困难。 二、杂环化合物的分类和命名 (一)分类 杂环化合物可按杂环的骨架分为单杂环和稠杂环。单杂环又按环的大小分为 五元杂环和六元杂环;稠杂环按其稠合环形式分为苯稠杂环和稠杂环。如表 12-1 所示。 (二)命名 1.杂环化合物的命名 根据外文名称的译音,选用同音汉字,再加上“口” 字旁命名。例如:呋喃、噻吩、吡咯、吡啶,就是根据 furan、thiophene、pyrrole、 pyridine 等英文名称音译的。 表 常见杂环化合物的结构和名称 分 类 重 要 杂 环 含一个杂原子的杂环 含两个以上杂原子的杂环 五 元 杂 环 呋喃 噻吩 吡咯 furan thiophene pyrrole O S N H 吡唑 恶唑 pyrazole oxazole 2 1 N N H 1 O N 3 咪唑 imidazole 1 3 N N H
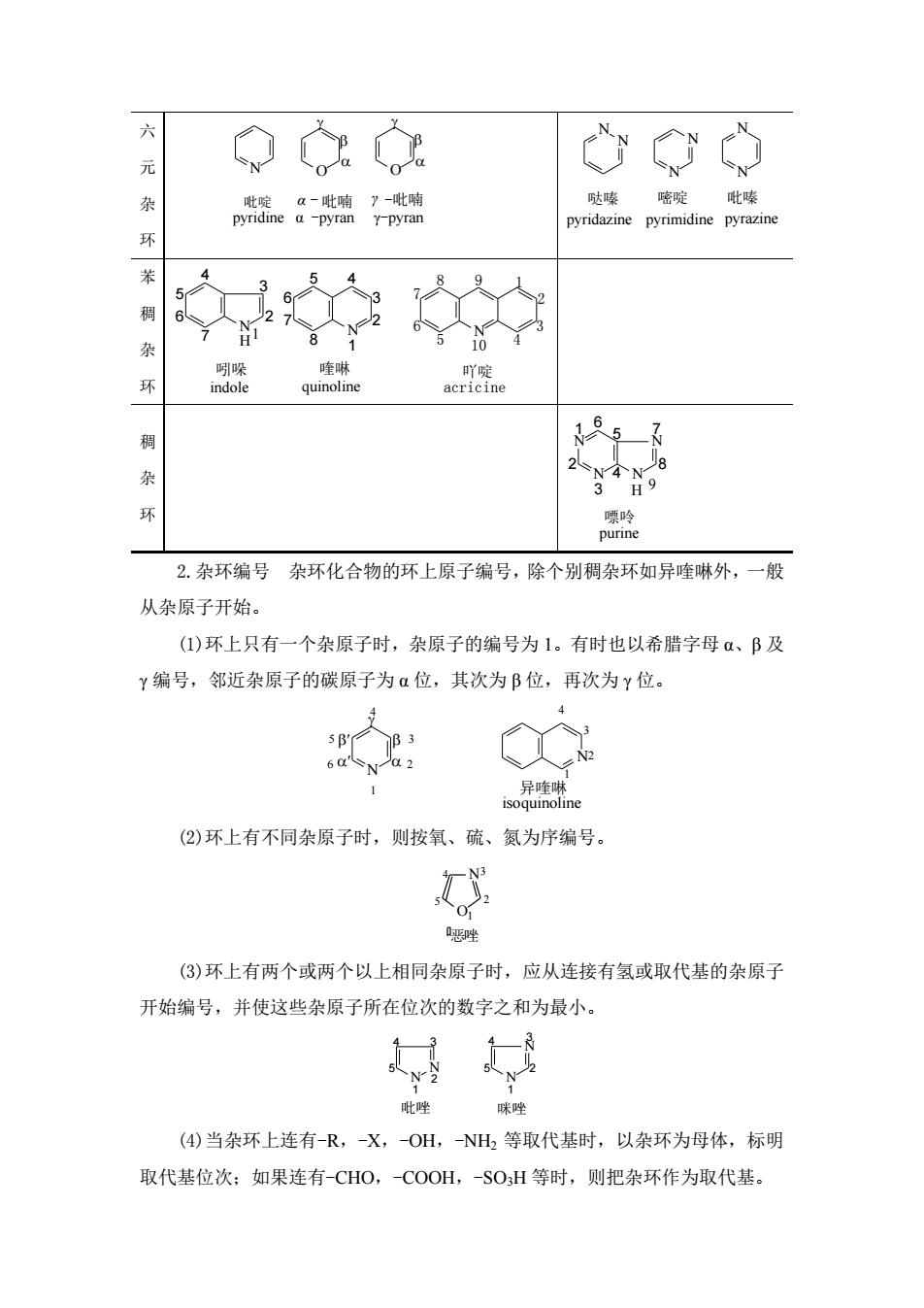
六 ◇o 月然独7 哒嗪密啶。吡嗪 pyridazine pyrimidine pyrazine 环 7义 71 杂 啉 quinoline 15 3”H9 脸 2.杂环编号 杂环化合物的环上原子编号,除个别稠杂环如异喹啉外,一般 从杂原子开始。 (1)环上只有一个杂原子时,杂原子的编号为1。有时也以希腊字母α、B及 Y编号,邻近杂原子的碳原子为α位,其次为B位,再次为Y位。 1 异ne (②)环上有不同杂原子时,则按氧、硫、氮为序编号。 思唑 (③)环上有两个或两个以上相同杂原子时,应从连接有氢或取代基的杂原子 开始编号,并使这些杂原子所在位次的数字之和为最小。 吡唑 味唑 (④)当杂环上连有-R,-X,OH,NH2等取代基时,以杂环为母体,标明 取代基位次;如果连有-CHO,-COOH,-SOH等时,则把杂环作为取代基
六 元 杂 环 N O O 吡啶 α - 吡喃 γ -吡喃 pyridine α -pyran γ-pyran N N N N N N 哒嗪 嘧啶 吡嗪 pyridazine pyrimidine pyrazine 苯 稠 杂 环 N 2 3 4 5 6 7 N 1 2 3 5 4 6 7 H 8 1 吲哚 喹啉 indole quinoline N 1 2 3 5 4 6 7 8 9 10 吖啶 acricine 稠 杂 环 N N N N 8 7 6 5 4 3 2 1 H 9 嘌呤 purine 2.杂环编号 杂环化合物的环上原子编号,除个别稠杂环如异喹啉外,一般 从杂原子开始。 (1)环上只有一个杂原子时,杂原子的编号为 1。有时也以希腊字母 α、β 及 γ 编号,邻近杂原子的碳原子为 α 位,其次为 β 位,再次为 γ 位。 N 1 2 3 4 5 6 N 1 2 3 4 异喹啉 isoquinoline (2)环上有不同杂原子时,则按氧、硫、氮为序编号。 N O1 3 恶唑 2 4 5 (3)环上有两个或两个以上相同杂原子时,应从连接有氢或取代基的杂原子 开始编号,并使这些杂原子所在位次的数字之和为最小。 N N 1 2 4 3 5 N N 1 2 3 4 5 吡唑 咪唑 (4)当杂环上连有-R,-X,-OH,-NH2 等取代基时,以杂环为母体,标明 取代基位次;如果连有-CHO,-COOH,-SO3H 等时,则把杂环作为取代基

OH 8-羟基哇琳 另有特殊编号的,如嘌呤等(见表12-1)。 三、杂环化合物的性质 (一)碱性 1.吡咯具有弱碱性和弱酸性吡咯的碱性很弱,不能与稀酸或弱酸成盐。反 而能与干燥的氢氧化钾加热生成盐,表现出弱酸性。可以看成是两性化合物。 +H0 这是因为含氮杂环化合物的碱性强弱与胺一样,取决于氮原子上未共用电子 对结合质子的能力大小。吡咯氮原子上的未共用电子对参与环的共轭体系,使其 电子云密度降低,减弱了它接受质子的能力。也可以理解为,如果氨原子与质子 结合,就会破坏闭合共轭体系的稳定结构而失去芳香性。所以吡咯的碱性很弱 2.吡啶的碱性比苯胺强吡啶环上的氯原子具有叔胺结构,有1对未参与共 轭的电子,能结合什而显碱性。但碱性比脂肪胺和氨弱,而近似芳胺。 ◇+阳一0 (仁)亲电取代反应 1.五元杂环的亲电取代反应五元杂环易于亲电取代,反应发生在α-位。 位上的电子云密度较大,因而亲电取代反应一般发生在此位置上,如果α-位已 有取代基,则发生在位。其中,吡咯的反应活性最高,噻吩最低。 (1)卤代反应激烈,可得多卤代产物。 +,旺人a
N NO2 H 2-硝基吡咯 N OH 8-羟基喹啉 O CHO 2-呋喃甲醛 α -硝基吡咯 α -呋喃甲醛 另有特殊编号的,如嘌呤等(见表 12-1)。 三、杂环化合物的性质 (一)碱性 1.吡咯具有弱碱性和弱酸性 吡咯的碱性很弱,不能与稀酸或弱酸成盐。反 而能与干燥的氢氧化钾加热生成盐,表现出弱酸性。可以看成是两性化合物。 N H + KOH (固体) N K + H2O 这是因为含氮杂环化合物的碱性强弱与胺一样,取决于氮原子上未共用电子 对结合质子的能力大小。吡咯氮原子上的未共用电子对参与环的共轭体系,使其 电子云密度降低,减弱了它接受质子的能力。也可以理解为,如果氮原子与质子 结合,就会破坏闭合共轭体系的稳定结构而失去芳香性。所以吡咯的碱性很弱。 2.吡啶的碱性比苯胺强 吡啶环上的氮原子具有叔胺结构,有 1 对未参与共 轭的电子,能结合 H +而显碱性。但碱性比脂肪胺和氨弱,而近似芳胺。 N + HCl N H Cl (二)亲电取代反应 1.五元杂环的亲电取代反应 五元杂环易于亲电取代,反应发生在 α-位。α- 位上的电子云密度较大,因而亲电取代反应一般发生在此位置上,如果 α-位已 有取代基,则发生在 β-位。其中,吡咯的反应活性最高,噻吩最低。 (1)卤代反应激烈,可得多卤代产物。 N H + Br2 乙醚 0℃ + HBr N H Br Br Br Br O + Br2 0℃ 二氧六环 + HBr O Br

+,又+m 室温 (②)硝化反应吡咯和呋喃遇酸易分解、聚合和树脂化,因此硝化试剂不用 混酸,用较缓和的硝酸乙酰酯并在低温下进行。 -10℃ NO.CH.COOH 可 CHCOONO.CHCOOM +CHCOONO,(CHCO)0 No.CH.COOH (3)磺化反应吡略与呋喃的磺化试剂也不能用浓硫酸,常用吡啶三氧化硫 了.Oor时}on yso:Toosou 了x2了o 2.吡啶的亲电取代反应吡啶比苯难以发生亲电取代,反应在阝位。 ◇品 +HBr +H,0 +H0 220℃ (三)氢化反应 杂环化合物可以催化氢化为相应的饱和杂环或脂杂环化合物。反应比苯容易, 吡咯、吡啶、噻吩、呋喃在较缓和的条件下均可催化加氢
S + Br2 室温 CH3COOH S Br + HBr (2)硝化反应 吡咯和呋喃遇酸易分解、聚合和树脂化,因此硝化试剂不用 混酸,用较缓和的硝酸乙酰酯并在低温下进行。 S + CH3COONO2 CH3COONO2 CH3COONO2 (CH3CO)2O -10℃ -5~-30℃ 2O (CH3CO)2O N NO2 H + O NO2 S NO2 + + CH3COOH CH3COOH CH3COOH N H + O + -10℃ (3)磺化反应 吡咯与呋喃的磺化试剂也不能用浓硫酸,常用吡啶三氧化硫。 N H + O + N SO3 100℃ N SO3 100℃ N SO3 H O SO3H H S 浓H2SO4 室温 S SO3H 2.吡啶的亲电取代反应 吡啶比苯难以发生亲电取代,反应在 β-位。 N Br2 300℃ N Br + HBr N 浓H2SO4,浓HNO3 300℃ 24h N NO2 + H2O N 浓H2SO4,HgSO4 220℃ N SO3H + H2O (三)氢化反应 杂环化合物可以催化氢化为相应的饱和杂环或脂杂环化合物。反应比苯容易, 吡咯、吡啶、噻吩、呋喃在较缓和的条件下均可催化加氢