
无机化学(一、二)教学大纲 (Inorganic Chemistry) 课程编号:0708600~0713170 开课学期:第一学期、第二学期。 本课程课内总学时:48+40学时。 学分:3+3 一、教学对象 四年制化学化工学院化学专业本科生。 二、教学目的 无机化学是大学络类化学专业的第一门重要的基础课在化学专业的学 习中起着承前启后的作用。师范院校的无机化学又是和中学化学教学内容 关系最为直接和密切的专业课。其教学任务和目的是: 1.让学生掌握元素周期律;初步掌握化学热力学、近代物质结构、化 学平衡以及电化学基础等基本化学原理。 2.培养学生运用上述原理掌握有关无机化学中元素的单质及其化合物 的基本知识,并具有对一般无机化学问题进行理论分析和计算的能力,利 用参考资料的能力。 3.通过教学帮助学生树立初步的辩证唯物主义和历史唯物主义的观 点;注意培养学生的科学思维能力。 4.教学中要重视讲授重要元素的单质及其化合物的性质、结构和用途 为今后学习后续课程的新理论、新实验技术打下必要的无机化学基础。 三、教学要求 1.掌握元素周期律,物质结构理论,化学平衡和溶液中的平衡理论,熟 悉化学热力学、动力学的初步知识,掌握电化学、配位化学的基础蜘识等 无机化学的基本原理,并能运用这些原理阐明化学变化的规律和现象。 2对重要元素及重要化合物的结构、组成、性质、变化规律等基本知识 能较好地掌握。并指导化学分析,掌握无机化合物的定性分析和一般分离 的原理和方法 3.掌握化学计算等基本技能,能使用化学手册查阅有关资料
无机化学(一、二)教学大纲 (Inorganic Chemistry) 课程编号:0708600~0713170 开课学期:第一学期、第二学期。 本课程课内总学时:48+40 学时。 学分:3+3 一、教学对象 四年制化学化工学院化学专业本科生。 二、教学目的 无机化学是大学各类化学专业的第一门重要的基础课,在化学专业的学 习中起着承前启后的作用。师范院校的无机化学又是和中学化学教学内容 关系最为直接和密切的专业课。其教学任务和目的是: 1.让学生掌握元素周期律;初步掌握化学热力学、近代物质结构、化 学平衡以及电化学基础等基本化学原理。 2.培养学生运用上述原理掌握有关无机化学中元素的单质及其化合物 的基本知识,并具有对一般无机化学问题进行理论分析和计算的能力,利 用参考资料的能力。 3.通过教学帮助学生树立初步的辩证唯物主义和历史唯物主义的观 点;注意培养学生的科学思维能力。 4.教学中要重视讲授重要元素的单质及其化合物的性质、结构和用途, 为今后学习后续课程的新理论、新实验技术打下必要的无机化学基础。 三、教学要求 1.掌握元素周期律,物质结构理论,化学平衡和溶液中的平衡理论,熟 悉化学热力学、动力学的初步知识,掌握电化学、配位化学的基础知识等 无机化学的基本原理,并能运用这些原理阐明化学变化的规律和现象。 2.对重要元素及重要化合物的结构、组成、性质、变化规律等基本知识 能较好地掌握。并指导化学分析,掌握无机化合物的定性分析和一般分离 的原理和方法 3.掌握化学计算等基本技能,能使用化学手册查阅有关资料
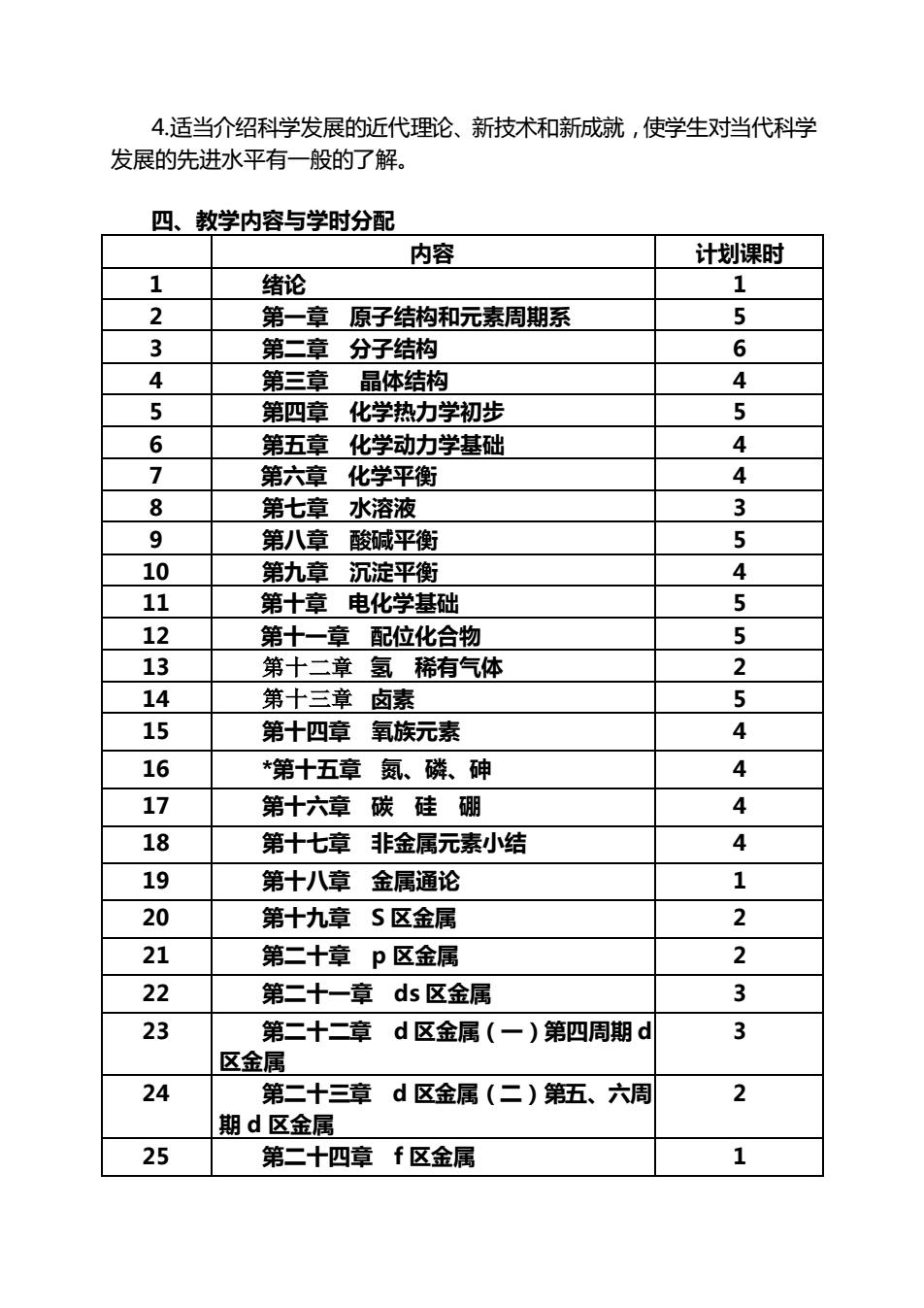
4.适当介绍科学发展的近代理论、新技术和新成就,使学生对当代科学 发展的先进水平有一般的了解。 四、教学内容与学时分配 内容 计划课时 1 绪论 1 2 第一章原子结构和元素周期系 5 3 第二章分子结构 6 4 第三章 晶体结构 4 5 第四章化学热力学初步 5 6 第五章化学动力学基础 4 7 第六章化学平衡 4 8 第七章水溶液 3 9 第八章酸碱平衡 5 10 第九章沉淀平衡 4 11 第十章电化学基础 5 12 第十一章配位化合物 5 13 第十二章氢稀有气体 2 14 第十三章卤素 5 15 第十四章氧族元素 4 16 *第十五章氮、磷、砷 4 17 第十六章碳硅硼 4 18 第十七章非金属元素小结 4 19 第十八章金属通论 1 20 第十九章S区金属 2 21 第二十章p区金属 2 22 第二十一章ds区金属 3 23 第二十二章d区金属(一)第四周期d 3 区金属 24 第二十三章d区金属(二)第五、六周 2 期d区金属 25 第二十四章f区金属 1
4.适当介绍科学发展的近代理论、新技术和新成就,使学生对当代科学 发展的先进水平有一般的了解。 四、教学内容与学时分配 内容 计划课时 1 绪论 1 2 第一章 原子结构和元素周期系 5 3 第二章 分子结构 6 4 第三章 晶体结构 4 5 第四章 化学热力学初步 5 6 第五章 化学动力学基础 4 7 第六章 化学平衡 4 8 第七章 水溶液 3 9 第八章 酸碱平衡 5 10 第九章 沉淀平衡 4 11 第十章 电化学基础 5 12 第十一章 配位化合物 5 13 第十二章 氢 稀有气体 2 14 第十三章 卤素 5 15 第十四章 氧族元素 4 16 *第十五章 氮、磷、砷 4 17 第十六章 碳 硅 硼 4 18 第十七章 非金属元素小结 4 19 第十八章 金属通论 1 20 第十九章 S 区金属 2 21 第二十章 p 区金属 2 22 第二十一章 ds 区金属 3 23 第二十二章 d 区金属(一)第四周期 d 区金属 3 24 第二十三章 d 区金属(二)第五、六周 期 d 区金属 2 25 第二十四章 f 区金属 1

绪论(1学时) 1.化学的研究对象 2.化学的主要分支 第一章原子结构和元素周期系(5学时)》 教学要求 1.掌握原子、分子;元素、核素;原子质量、平均原子质量、相对原 子质量。 2.了解核外电子运动的特殊性,波函数和电子云的图形。 3.理解四个量子数的物理竟义及其取值。 4.能够利用轨道填充顺序图,按照核外电子排布原理,写出若干常见 元素的电子构型。 5.掌握各类元素电子构型的特征;掌握92号以前元素的符号,中文名 称(正确书写及读音, 6.了解电离势、电负性等概念的意义和它们与原子结构的关系。 教学内容 1.道尔顿原子论 2.相对原子质量 3.原子结构的玻尔行星模型。 4.氢原子结构的量子力学模型:波粒二象性、德布罗意的预言、测不 准原理、核外电子运动运动状态的描述(波函数和原子轨道、波函数的径向 部分和角度部分、几率密度和电子云、四个量子数 5.多电子原子基态电子组态:屏蔽效应和钻穿效应、近似能级图、核 外电子排布原理和电子排布。 6.元素周期系:元素周期律、元素周期表、元素性质呈现周期性的内 在原因,原子的电子层结构与周期、族的战划分,原子的电子层结构和元素的 分区,元素周期表中族序的新标准 7.元素周期性:原子半径、电离能、电子亲合能、电负性、氧化态。 第二章分子结构(6学时) 教学要求 1.掌握共价键基本特性及它们的区别。 2.掌握杂化轨道理论(sp、sp2、sp3型索化),每一类型各能举出2-3 个实例 3.掌握价层电子对互斥理论的基本内容及其应用。 4.了解分子间力的概念,分清化学键与分子间力的区别
绪论 (1 学时) 1.化学的研究对象。 2.化学的主要分支。 第一章 原子结构和元素周期系(5 学时) 教学要求 1.掌握原子、分子;元素、核素;原子质量、平均原子质量、相对原 子质量。 2.了解核外电子运动的特殊性,波函数和电子云的图形。 3.理解四个量子数的物理意义及其取值。 4.能够利用轨道填充顺序图,按照核外电子排布原理,写出若干常见 元素的电子构型。 5.掌握各类元素电子构型的特征;掌握 92 号以前元素的符号,中文名 称(正确书写及读音)。 6.了解电离势、电负性等概念的意义和它们与原子结构的关系。 教学内容 1.道尔顿原子论 2.相对原子质量 3.原子结构的玻尔行星模型。 4.氢原子结构的量子力学模型:波粒二象性、德布罗意的预言、测不 准原理、核外电子运动运动状态的描述(波函数和原子轨道、波函数的径向 部分和角度部分、几率密度和电子云、四个量子数)。 5.多电子原子基态电子组态:屏蔽效应和钻穿效应、近似能级图、核 外电子排布原理和电子排布。 6.元素周期系:元素周期律、元素周期表、元素性质呈现周期性的内 在原因,原子的电子层结构与周期、族的划分,原子的电子层结构和元素的 分区,元素周期表中族序的新标准。 7.元素周期性:原子半径、电离能、电子亲合能、电负性、氧化态。 第二章 分子结构(6 学时) 教学要求 1.掌握共价键基本特性及它们的区别。 2.掌握杂化轨道理论(sp、sp2、sp3型杂化),每一类型各能举出 2-3 个实例。 3.掌握价层电子对互斥理论的基本内容及其应用。 4.了解分子间力的概念,分清化学键与分子间力的区别

5.掌握氢键的特征和形成条件及其对于物质的物理性质的影响。 6.了解物质的性质与分子结构和键参数的关系。 7.了解第二周期同核双原子分子(如N2、O2等人异核双原子分子(如 CO、HF)等的分子轨道理论。 教学内容 1.共价键的形成和本质,现代价键理论的要点和优缺点,共价键的方 向性和饱和性,σ键和π键。 2.杂化轨道理论 3.价层电子互斥模型。 4.共轭大π键。 5.等电子体原理 6.分子轨道理论简介:分子轨道的含义和形成,分子轨道中电子的排 布,键级。 7共价分子的性质:共价半径、键能、键长、键角、键的极性与分子的 极性和磁性。 8.分子间的作用力和氢键。 第三章晶体结构(4学时) 教学要求 1.掌握晶胞的概念。 2.了解金属键理论。 3.掌握离子键和离子晶体的基本特性、了解离子极化的概念及其作用。 4.掌握四种晶体类型的特征,特别是质点间相互作用力的状况。 5,掌握晶体的类型与物质性质的关系: 6.掌握原子半径和离子半径的定义及其对化合物性质的影响。 教学内容 1.晶体 2.晶胞 3.金属晶体 4.离子晶体 5.原子晶体和分子晶体。 第四章化学热力学初步(5学时) 教学要求 1.掌握理想气体状态方程式、分压定律,并能熟练进行有关计算。 2.掌握“物质的量”的意义及其单位—摩尔的定义,达到能熟练应 用并进行有关计算
5.掌握氢键的特征和形成条件及其对于物质的物理性质的影响。 6.了解物质的性质与分子结构和键参数的关系。 7.了解第二周期同核双原子分子(如 N2、O2等)、异核双原子分子(如 CO、HF)等的分子轨道理论。 教学内容 1.共价键的形成和本质,现代价键理论的要点和优缺点,共价键的方 向性和饱和性,σ 键和π 键。 2.杂化轨道理论。 3.价层电子互斥模型。 4.共轭大π 键。 5.等电子体原理。 6.分子轨道理论简介:分子轨道的含义和形成,分子轨道中电子的排 布,键级。 7 共价分子的性质:共价半径、键能、键长、键角、键的极性与分子的 极性和磁性。 8.分子间的作用力和氢键。 第三章 晶体结构(4 学时) 教学要求 1.掌握晶胞的概念。 2.了解金属键理论。 3.掌握离子键和离子晶体的基本特性、了解离子极化的概念及其作用。 4.掌握四种晶体类型的特征,特别是质点间相互作用力的状况。 5.掌握晶体的类型与物质性质的关系。 6.掌握原子半径和离子半径的定义及其对化合物性质的影响。 教学内容 1.晶体。 2.晶胞。 3.金属晶体。 4.离子晶体。 5.原子晶体和分子晶体。 第四章 化学热力学初步(5 学时) 教学要求 1.掌握理想气体状态方程式、分压定律,并能熟练进行有关计算。 2.掌握“物质的量”的意义及其单位——摩尔的定义,达到能熟练应 用并进行有关计算

3.理解状态函数的特性 4.掌握焓和焓变的概念、吉布斯自由能和熵及它们的变化的初步概念 5,掌握盖斯定律,能运用有关数据进行标准状态下反应的焓变、熵变 和自由能变的计算及初步应用。 6.学会用吉布斯自由能变化去判断化学反应方向。 7.根据吉布斯 一亥姆霍兹公式理解△rGm与△rHm及△rSm的关 系,并会用于分析温度对化学反应自发性的影响。 教学内容 1.化学热力学的研究对像。 2.基本概念。 3.化学热力学的四个重要状态函数:热力学能焓、自由能、熵。 3.化学热力学的应用:盖斯定律及其应用、生成焓与生成自由能及其 应用、吉布斯 亥姆霍兹公式。 第五章化学动力学基础(4学时) 教学要求 1.了解化学反应速率的概念及反应速率的实验测定 2,了解基元反应、复杂反应、反应级数、反应分子数的概念。 3.掌握浓度、温度及催化剂对化学反应速率的影响。 4.了解速度方程的实验测定和阿累尼乌斯公式的有关计算 5.了解化学反应速率理论和反应历程 教学内容 1,化学反应速率的表示方法及实验测定:平均速率和瞬时速率 2,浓度对化学反应速率影响:速度方程和速率常数,反应级数。 3.温度对化学反应速度的影响一阿累尼乌斯公式与活化能。 4.反应历程。 5.反应速率理论。 6.催化剂对化学反应速度的影响 第六章化学平衡(4学时) 教学要求 1.了解化学平衡的概念,理解平衡常数的意义。 2.掌握化学平衡原理及其有关化学平衡的计算。 3.掌握化学平衡移动原理及其有关计算。 教学内容 1.可逆反应和化学平衡。 2.平衡常数:化学平衡定律,平衡常数的物理意义
3.理解状态函数的特性。 4.掌握焓和焓变的概念、吉布斯自由能和熵及它们的变化的初步概念。 5.掌握盖斯定律,能运用有关数据进行标准状态下反应的焓变、熵变 和自由能变的计算及初步应用。 6.学会用吉布斯自由能变化去判断化学反应方向。 7.根据吉布斯——亥姆霍兹公式理解Δ rGm 与Δ rHm 及Δ rSm 的关 系,并会用于分析温度对化学反应自发性的影响。 教学内容 1.化学热力学的研究对象。 2.基本概念。 3.化学热力学的四个重要状态函数:热力学能、焓、自由能、熵。 3.化学热力学的应用:盖斯定律及其应用、生成焓与生成自由能及其 应用、吉布斯——亥姆霍兹公式。 第五章 化学动力学基础(4 学时) 教学要求 1.了解化学反应速率的概念及反应速率的实验测定。 2.了解基元反应、复杂反应、反应级数、反应分子数的概念。 3.掌握浓度、温度及催化剂对化学反应速率的影响。 4.了解速度方程的实验测定和阿累尼乌斯公式的有关计算。 5.了解化学反应速率理论和反应历程。 教学内容 1.化学反应速率的表示方法及实验测定:平均速率和瞬时速率。 2.浓度对化学反应速率影响:速度方程和速率常数,反应级数。 3.温度对化学反应速度的影响——阿累尼乌斯公式与活化能。 4.反应历程。 5.反应速率理论。 6.催化剂对化学反应速度的影响。 第六章 化学平衡(4 学时) 教学要求 1.了解化学平衡的概念,理解平衡常数的意义。 2.掌握化学平衡原理及其有关化学平衡的计算。 3.掌握化学平衡移动原理及其有关计算。 教学内容 1.可逆反应和化学平衡。 2.平衡常数:化学平衡定律,平衡常数的物理意义