
第九章羧酸和取代羧酸 知识要点 1教酸和取代羧酸的定义、结构、分美、命名和理化性质。 2.甲酸的结构特性及其与性质的关系。 3重要的羧酸和取代羧酸在医药学上的应用。 烃分子中的氢原子被羧基(一COOH)取代而形成的化合物称为羧酸,其通式 为RCOOH(甲酸为HCOOH),羧基是羧酸的官能团. 羧酸分子中烃基上的氢原子被其他原子或基团取代而形成的化合物称为取 代羧酸。常见的取代羧酸有卤代酸、羟基酸、羰基酸和氨基酸等。本章主要讨论 羟基酸和羰基酸。 羧酸和取代羧酸广泛存在于中草药或其他动植物中。它们与医药关系十分密 切,在有机合成、生物代谢及药物中起着十分重要的作用。 第一节羧酸 一、羧酸的结构 羧酸的官能团是羧基(一C0OH),它是由羰基和羟基相连而成的。现代物理 方法测定证明,甲酸分子中碳氧双键的键长为123m,比普通羰基的碳氧双键 键长120pm要长,而羧基中的碳氧单键键长为136pm,比醇中相应的碳氧单键 键长143pm又短得多,这说明羧基中羰基与羟基间存在着相互作用。 杂化轨道理论认为,羧酸分子中羧基碳原子采取s即杂化,形成的3个sp 杂化轨道分别与1个碳原子和2个氧原子形成3个。键,成键的4个原子处于 同一平面,未参与杂化的p轨道与羰基氧原子的p轨道形成π键(即羧基中C-0 的π键),该π键又与羟基氧原子上含孤对电子的p轨道平行,故可以进行肩并 肩的部分重叠,形成Pπ共轭体系。Pπ共轭的存在,使碳氧间的健长发生了平 均化,如图9-1所示。 图91a图9-16 图91羧酸的结构示意图 当羧基解离成负离子时,由于电子的离域,氧上的负电荷不是集中在1个氧 原子上,而是平均分散在2个氧原子上。因此2个碳氧键的键长相等,都为127pm 没有单键和双键的区别
第九章 羧酸和取代羧酸 知识要点 1.羧酸和取代羧酸的定义、结构、分类、命名和理化性质。 2.甲酸的结构特性及其与性质的关系。 3.重要的羧酸和取代羧酸在医药学上的应用。 烃分子中的氢原子被羧基(-COOH)取代而形成的化合物称为羧酸,其通式 为 RCOOH(甲酸为 HCOOH),羧基是羧酸的官能团。 羧酸分子中烃基上的氢原子被其他原子或基团取代而形成的化合物称为取 代羧酸。常见的取代羧酸有卤代酸、羟基酸、羰基酸和氨基酸等。本章主要讨论 羟基酸和羰基酸。 羧酸和取代羧酸广泛存在于中草药或其他动植物中。它们与医药关系十分密 切,在有机合成、生物代谢及药物中起着十分重要的作用。 第一节 羧酸 一、羧酸的结构 羧酸的官能团是羧基(-COOH),它是由羰基和羟基相连而成的。现代物理 方法测定证明,甲酸分子中碳氧双键的键长为 123pm,比普通羰基的碳氧双键 键长 120pm 要长,而羧基中的碳氧单键键长为 136pm,比醇中相应的碳氧单键 键长 143pm 又短得多,这说明羧基中羰基与羟基间存在着相互作用。 杂化轨道理论认为,羧酸分子中羧基碳原子采取 sp 2 杂化,形成的 3 个 sp 2 杂化轨道分别与 1 个碳原子和 2 个氧原子形成 3 个 σ 键,成键的 4 个原子处于 同一平面,未参与杂化的 p 轨道与羰基氧原子的 p 轨道形成 π 键(即羧基中 C=O 的 π 键),该 π 键又与羟基氧原子上含孤对电子的 p 轨道平行,故可以进行肩并 肩的部分重叠,形成 p-π 共轭体系。p-π 共轭的存在,使碳氧间的键长发生了平 均化,如图 9-1 所示。 图 9-1a 图 9-1b 图 9-1 羧酸的结构示意图 当羧基解离成负离子时,由于电子的离域,氧上的负电荷不是集中在 1 个氧 原子上,而是平均分散在2个氧原子上。因此2个碳氧键的键长相等,都为127pm, 没有单键和双键的区别
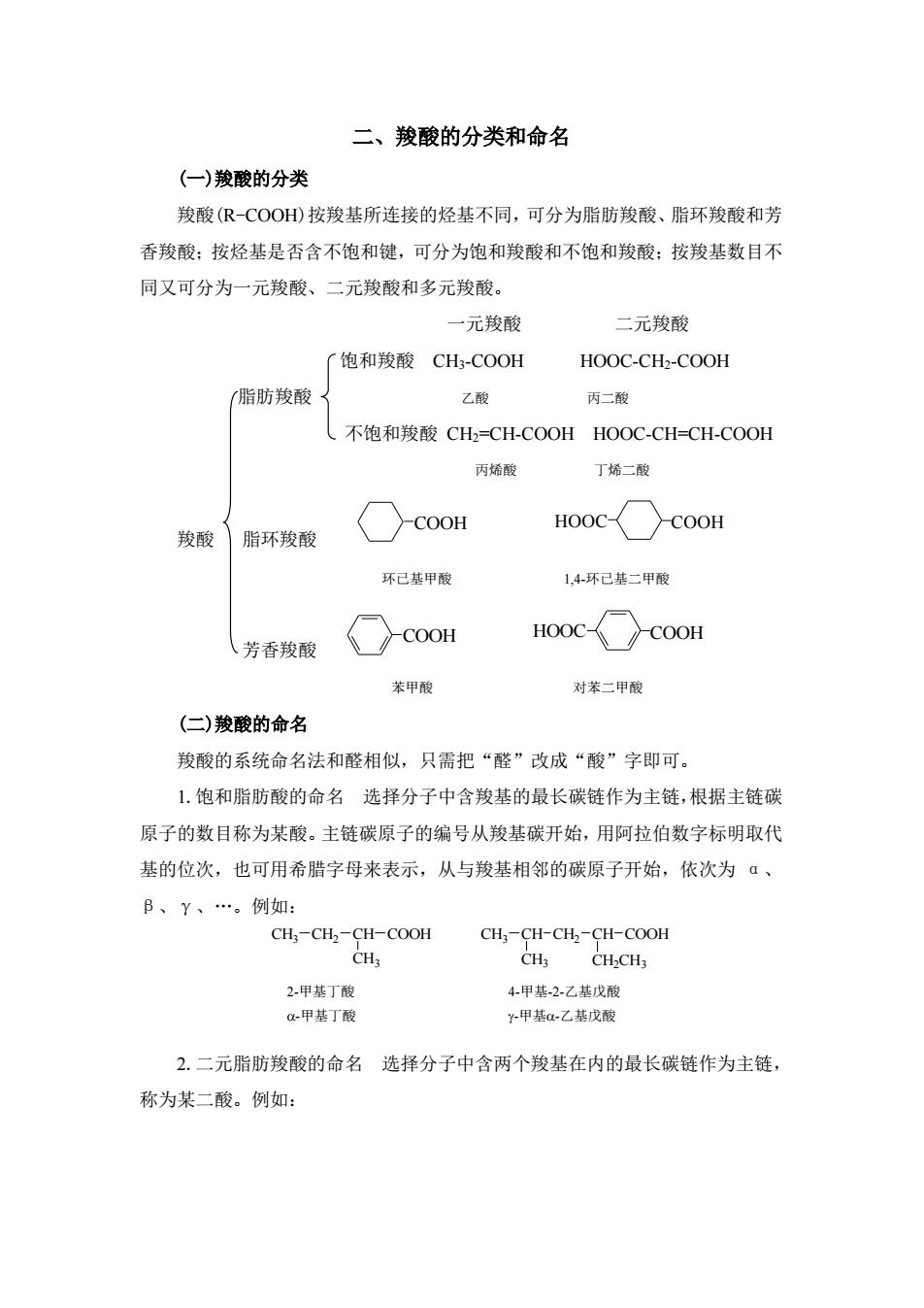
二、羧酸的分类和命名 ((一)羧酸的分类 羧酸(R-COOH)按羧基所连接的烃基不同,可分为脂肪羧酸、脂环羧酸和芳 香羧酸:按烃基是否含不饱和键,可分为饱和羧酸和不饱和羧酸:按羧基数目不 同又可分为一元羧酸、二元羧酸和多元羧酸。 一元羧酸 二元酸弱 饱和羧酸CH3-COOH HOOC-CH2-COOH 脂肪羧酸 乙酸 丙二酸 (不饱和羧酸CH2=CH-COOH HOOC-CH=CH-COOH 丙烯酸 丁烯二酸 HOOCCOOH 羧酸 脂环羧酸 ○cooH 环已基甲酸 1,4环己基二甲酸 、芳香羧酸 COOH HOOCCOOH 苯甲酸 对苯二甲酸 (二)羧酸的命名 羧酸的系统命名法和醛相似,只需把“醛”改成“酸”字即可。 1,饱和脂肪酸的命名选择分子中含羧基的最长碳链作为主链,根据主链碳 原子的数目称为某酸。主链碳原子的编号从羧基碳开始,用阿拉伯数字标明取代 基的位次,也可用希腊字母来表示,从与羧基相邻的碳原子开始,依次为ā、 B、Y、.。例如: CH,-CH,-CH-COOH CH3-CH-CH2-CH-COOH CH-CHs 2.甲基丁酸 4.甲基.2.乙基戊酸 a-甲基丁酸 y甲基a-乙基戊酸 2.二元脂肪羧酸的命名选择分子中含两个羧基在内的最长碳链作为主链, 称为某二酸。例如:
二、羧酸的分类和命名 (一)羧酸的分类 羧酸(R-COOH)按羧基所连接的烃基不同,可分为脂肪羧酸、脂环羧酸和芳 香羧酸;按烃基是否含不饱和键,可分为饱和羧酸和不饱和羧酸;按羧基数目不 同又可分为一元羧酸、二元羧酸和多元羧酸。 一元羧酸 二元羧酸 饱和羧酸 CH3-COOH HOOC-CH2-COOH 脂肪羧酸 乙酸 丙二酸 不饱和羧酸 CH2=CH-COOH HOOC-CH=CH-COOH 丙烯酸 丁烯二酸 羧酸 脂环羧酸 COOH HOOC COOH 环已基甲酸 1,4-环已基二甲酸 芳香羧酸 COOH HOOC COOH 苯甲酸 对苯二甲酸 (二)羧酸的命名 羧酸的系统命名法和醛相似,只需把“醛”改成“酸”字即可。 1.饱和脂肪酸的命名 选择分子中含羧基的最长碳链作为主链,根据主链碳 原子的数目称为某酸。主链碳原子的编号从羧基碳开始,用阿拉伯数字标明取代 基的位次,也可用希腊字母来表示,从与羧基相邻的碳原子开始,依次为 α、 β、γ、„。例如: CH3 CH2 CH COOH CH3 CH3 CH CH2 CH CH3 COOH CH2CH3 2.二元脂肪羧酸的命名 选择分子中含两个羧基在内的最长碳链作为主链, 称为某二酸。例如: 2-甲基丁酸 -甲基丁酸 4-甲基-2-乙基戊酸 -甲基-乙基戊酸

HOC-COOH HcCHcOOH CHCHCHCoO COOH 乙二酸 丁二酸 乙基丙二酸 3.不饱和脂肪酸的命名选择含羧基和不饱和键在内的最长碳链作为主链 称为某烯酸或某炔酸。主链碳原子的编号仍用阿拉伯数字或希腊字母来表示,把 双键和叁键的位次写在母体名称的前面。例如: CH3-CH=CH-COOH CH;-CH-C -COOH CH3 2-丁烯酸(巴豆酸) 2.甲基.2.丁桥酸 a丁烯酸 a甲基-a丁烯酸 当主链碳原子数目多于10个时,母体名称用“某碳烯酸”来表示,加一个 “碳”字是为了避免主链碳原子数目和双键数目的两个数字混淆。不饱和羧酸的 双键也可用“△”来表示,双键的位次写在“△”的右上角。例如: CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH 9,12-十八碳二烯酸(△912-十八碳二烯酸) 4.芳香羧酸和脂环羧酸的命名 以脂肪羧酸为母体,芳香烃基、脂环烃基为 取代基。例如: COOH COOH CH=CH-COOH CH; 苯甲酸 间甲基苯甲酸 3-苯基丙烯酸 CO CH2-COOH 邻装一甲酸 环戊基乙酸 另外,羧酸还常根据其天然来源或性质用俗名,如蚁酸HCOOH、醋酸 CHC00、草酸H00c-(00H、安息香酸o 等。 三、羧酸的物理性质 饱和一元羧酸中,甲酸、乙酸、丙酸是具有刺激性气味的液体:C4~C,的羧 酸是有恶臭气味的液体:C10以上的羧酸是无味的蜡状固体。脂肪族二元羧酸和 芳香羧酸都是结晶固体
乙二酸 丁二酸 乙基丙二酸 HOOC COOH HOOC CH2 CH2 COOH CH3 CH2 CH COOH COOH 3.不饱和脂肪酸的命名 选择含羧基和不饱和键在内的最长碳链作为主链, 称为某烯酸或某炔酸。主链碳原子的编号仍用阿拉伯数字或希腊字母来表示,把 双键和叁键的位次写在母体名称的前面。例如: CH3 CH C COOH CH3 CH3 CH CH COOH 当主链碳原子数目多于 10 个时,母体名称用“某碳烯酸”来表示,加一个 “碳”字是为了避免主链碳原子数目和双键数目的两个数字混淆。不饱和羧酸的 双键也可用“△”来表示,双键的位次写在“△”的右上角。例如: CH3 (CH2 )4 CH = CH CH2 CH = CH (CH2 )7 COOH 9,12 十八碳二烯酸( △9,12 十八碳二烯酸 ) 4.芳香羧酸和脂环羧酸的命名 以脂肪羧酸为母体,芳香烃基、脂环烃基为 取代基。例如: 苯甲酸 间甲基苯甲酸 3 -苯基丙烯酸 CH=CH COOH CH3 COOH COOH 邻苯二甲酸 环戊基乙酸 COOH COOH CH2 COOH 另外,羧酸还常根据其天然来源或性质用俗名,如蚁酸 HCOOH、醋酸 CH3COOH、草酸 HOOC-COOH、安息香酸 COOH 等。 三、羧酸的物理性质 饱和一元羧酸中,甲酸、乙酸、丙酸是具有刺激性气味的液体;C4~C9 的羧 酸是有恶臭气味的液体;C10 以上的羧酸是无味的蜡状固体。脂肪族二元羧酸和 芳香羧酸都是结晶固体。 2-丁烯酸(巴豆酸) 2-甲基-2-丁烯酸 -丁烯酸 -甲基--丁烯酸

羧酸能与水分子形成氢键,低级脂肪酸易溶于水,但随着分子量的增高,在 水中的溶解度逐渐降低。高级脂肪酸几乎不溶于水,但能溶于乙醇、乙醚、苯等 有机溶剂。 饱和一元羧酸的沸点比分子量相近的醇高,如甲酸和乙醇的分子量相同,甲 酸的沸点100.5℃,乙醇的沸点78.3℃。这是因为羧酸分子之间可以形成两个比 较稳定的氢键而相互缔合成双分子二聚体,如图9-2所示。 图9-2 图9-2搬酸分子的二聚体 饱和一元羧酸和二元羧酸的熔点,随分子中碳原子数目的增加呈锯齿状的变 化,即含偶数碳原子的羧酸,比相邻的2个含奇数碳原子的羧酸熔点高,这种现 象被认为与分子的对称性有关。例如乙酸的熔点比甲酸和丙酸的熔点要高;丁二 酸的熔点比丙二酸和戊二酸的熔点要高。常见羧酸的物理常数见表9-1。 表91常见羧酸的物理常数 名称 沸点(℃)熔点(℃) 甲酸(蚁酸) 100.5 8.4 3.77 乙酸(醋酸) 118 16.6 4.76 丙酸(初油酸) 141 -22 4.88 丁酸(酪酸) 162.5 4.7 4.82 十六酸(软脂酸) 一 62.9 十八酸(硬脂酸) 69.9 丙烯酸(败脂酸) 141 426 乙二酸(草酸) 189.5 1.27 4.27 丙二酸(缩苹果 135.6 2.85 5.70 酸) 丁二酸(琥珀酸) 185 421 .6 戊二酸(胶酸) 97.5 4.3 5.41 顺丁烯二酸(马来 130 192 6.59 酸) 反丁烯二酸(富马 287 3.03 4.54
羧酸能与水分子形成氢键,低级脂肪酸易溶于水,但随着分子量的增高,在 水中的溶解度逐渐降低。高级脂肪酸几乎不溶于水,但能溶于乙醇、乙醚、苯等 有机溶剂。 饱和一元羧酸的沸点比分子量相近的醇高,如甲酸和乙醇的分子量相同,甲 酸的沸点 100.5℃,乙醇的沸点 78.3℃。这是因为羧酸分子之间可以形成两个比 较稳定的氢键而相互缔合成双分子二聚体,如图 9-2 所示。 图 9-2 图 9-2 羧酸分子的二聚体 饱和一元羧酸和二元羧酸的熔点,随分子中碳原子数目的增加呈锯齿状的变 化,即含偶数碳原子的羧酸,比相邻的 2 个含奇数碳原子的羧酸熔点高,这种现 象被认为与分子的对称性有关。例如乙酸的熔点比甲酸和丙酸的熔点要高;丁二 酸的熔点比丙二酸和戊二酸的熔点要高。常见羧酸的物理常数见表 9-1。 表 9-1 常见羧酸的物理常数 名 称 沸点(℃) 熔点(℃) 1 pKa 2 pKa 甲酸(蚁酸) 100.5 8.4 3.77 - 乙酸(醋酸) 118 16.6 4.76 - 丙酸(初油酸) 141 -22 4.88 - 丁酸(酪酸) 162.5 -4.7 4.82 - 十六酸(软脂酸) - 62.9 - - 十八酸(硬脂酸) - 69.9 - - 丙烯酸(败脂酸) 141 13 4.26 - 乙二酸(草酸) - 189.5 1.27 4.27 丙二酸 ( 缩苹果 酸) - 135.6 2.85 5.70 丁二酸(琥珀酸) - 185 4.21 5.64 戊二酸(胶酸) - 97.5 4.34 5.41 顺丁烯二酸(马来 酸) - 130 1.92 6.59 反丁烯二酸(富马 - 287 3.03 4.54

酸) 苯甲酸(安息香 249 121.7 酸) 4.17 邻苯二甲酸(酞 231 2.89 5.57 酸) 四、羧酸的化学性质 羧酸的化学性质主要表现在官能团羧基上。羧基在形式上由羰基和羟基组 成,但由于它们通过pπ共轭构成了一个整体,使羧酸在性质上有别于羰基化合 物和醇类,而具有特殊性质。 ,脱羧反应 H 0 酸性 C , a-H被取代 ^0-H OH被取代后 生成羧酸衍生物 (一)酸性 由于羧基中的pπ共轭体系,使羟基氧原子上的电子云密度降低,导致氢氧 键极性增强,易于解离出质子,表现酸性。一般的羧酸都属弱酸,它们在水中只 是部分解离: 8-om一R8-0+r 羧酸的酸性强弱可以用电离常数K或其负对数pK表示。K愈大或pK愈 小,酸性愈强。羧酸的pK。一般都在3~5。饱和一元羧酸中,甲酸的酸性比同 系列中其他羧酸的酸性强,这是由于烷基的给电子诱导效应,降低了氢氧键的极 性,使氢较难解离,因此酸性减弱。如甲酸的pK为3.77,乙酸的pKa为4.76。 烷基越大,给电子能力越强,酸性越弱。所以,随着碳原子数目的增加,一元羧 酸的酸性逐渐减弱。见表9-1。 芳香酸比甲酸的酸性弱,但比其他饱和一元羧酸酸性强(如苯甲酸的pK为
酸) 苯甲酸 ( 安息香 酸) 249 121.7 4.17 - 邻苯二甲酸 ( 酞 酸) - 231 2.89 5.51 四、羧酸的化学性质 羧酸的化学性质主要表现在官能团羧基上。羧基在形式上由羰基和羟基组 成,但由于它们通过 p-π 共轭构成了一个整体,使羧酸在性质上有别于羰基化合 物和醇类,而具有特殊性质。 R C H H C O O H 酸性 脱羧反应 生成羧酸衍生物 -OH 被取代后 α-H 被取代 α (一)酸性 由于羧基中的 p-π 共轭体系,使羟基氧原子上的电子云密度降低,导致氢氧 键极性增强,易于解离出质子,表现酸性。一般的羧酸都属弱酸,它们在水中只 是部分解离: R C OH R C O + H O O = = 羧酸的酸性强弱可以用电离常数 Ka 或其负对数 pKa表示。Ka愈大或 pKa愈 小,酸性愈强。羧酸的 pKa 一般都在 3~5。饱和一元羧酸中,甲酸的酸性比同 系列中其他羧酸的酸性强,这是由于烷基的给电子诱导效应,降低了氢氧键的极 性,使氢较难解离,因此酸性减弱。如甲酸的 pKa 为 3.77,乙酸的 pKa 为 4.76。 烷基越大,给电子能力越强,酸性越弱。所以,随着碳原子数目的增加,一元羧 酸的酸性逐渐减弱。见表 9-1。 芳香酸比甲酸的酸性弱,但比其他饱和一元羧酸酸性强(如苯甲酸的 pKa 为