
第六章卤代烃 知识要点 1.卤代经的定义、分类、命名和理化性质。 2.扎伊采夫(Saytzef们规则;卤代烃中双键位置对卤素活泼性的影响。 卤代烃是指烃分子中的氢原子被卤原子取代得到的化合物。一般用R-X表 示。其中R代表烃基,X代表卤原子。卤原子X是卤代烃的官能团,常见的卤 代烃是氯代烃、溴代烃和碘代烃。 第一节卤代烃的分类和命名 一、卤代烃的分类 根据烃基的不同,卤代烃可分为饱和卤代烃、不饱和卤代烃和芳香族卤代烃 等。如: R-CH,-X R-CH=CH-X ◇ 卤代烷 卤代烯烃 卤代芳烃 (饱和卤代烃) (不饱和卤代烃) (芳香族卤代烃) 根据分子中所含卤原子数目的不同,可分为一卤代烃、二卤代烃和多卤代烃。 如: CHCI CH-Cl CHCI 一肉代经 二卤代烃 三卤代烃 根据卤原子连接的饱和碳原子的类型不同,可分为伯卤代烃(1°卤代烃)、 仲卤代烃(2°卤代烃)和叔卤代烃(3°卤代烃)。如: RCH2-X RCH-X 伯卤代烃(1°卤代烃)仲卤代烃(2卤代烃))叔卤代烃(3卤代烃) 此外,根据卤代烃分子中卤原子的不同,可分为氟代烃、氯代烃、溴代烃和 碘代烃。 二、卤代烃的命名 (一)普通命名法 对于简单的卤代烃,可用普通命名法命名。即按卤原子相连的烃基来命名
RCH2 X 第六章 卤 代 烃 知识要点 1.卤代烃的定义、分类、命名和理化性质。 2.扎伊采夫(Saytzeff)规则;卤代烃中双键位置对卤素活泼性的影响。 卤代烃是指烃分子中的氢原子被卤原子取代得到的化合物。一般用 R-X 表 示。其中 R 代表烃基,X 代表卤原子。卤原子 X 是卤代烃的官能团,常见的卤 代烃是氯代烃、溴代烃和碘代烃。 第一节 卤代烃的分类和命名 一、卤代烃的分类 根据烃基的不同,卤代烃可分为饱和卤代烃、不饱和卤代烃和芳香族卤代烃 等。如: 卤代烷 卤代烯烃 卤代芳烃 (饱和卤代烃) (不饱和卤代烃) (芳香族卤代烃) R-CH2-X R-CH=CH-X X 根据分子中所含卤原子数目的不同,可分为一卤代烃、二卤代烃和多卤代烃。 如: CH3Cl CH2Cl2 CHCl3 一卤代烃 二卤代烃 三卤代烃 根据卤原子连接的饱和碳原子的类型不同,可分为伯卤代烃(1°卤代烃)、 仲卤代烃(2°卤代烃)和叔卤代烃(3°卤代烃)。如: 伯卤代烃(1o卤代烃) 仲卤代烃(2o卤代烃) 叔卤代烃(3o卤代烃) 此外,根据卤代烃分子中卤原子的不同,可分为氟代烃、氯代烃、溴代烃和 碘代烃。 二、卤代烃的命名 (一)普通命名法 对于简单的卤代烃,可用普通命名法命名。即按卤原子相连的烃基来命名, CH R' R'' X C X R' R'' R

称为肉某烃,或某基卤。如: CH CH-CH-CH2 CH;CH-CH2-CI CH:-C -CI 溴甲烷 氯代正丁烷 氯代异丁烷 氯代叔丁烷 (甲基溴》 (正丁基氯) (异丁基氯) (叔丁基氯) Br CH2=CH-CH2-Br CoHs-CHz-Br CH3-CH-CH3 CH2=CH-CI 烯丙基溴 苄基溴(溴苄) 异丙基溴 氯乙烯 (二)系统命名法 对于较复杂的卤代烃,应采用系统命名法,以相应的烃为母体,将卤原子当 作取代基,命名的基本原则与烃类似。选择连有卤原子的碳在内的最长碳链作为 主链,编号则采用位次和最小原则。取代基的位次和名称按“次序规则”优先基 团在后的原则排列在烃名称前面。如: CH.CH: CH,-CH-CH-CH3 CH3-CH-CH-CH3 CH,CHC-CH2-CHCH, CH CI B CI 2-甲基-3-氯丁烷 2-氯-3-溴丁烷 4-乙基-2,4二氯已烷 不饱和卤代烃应选含有不饱和键和连有卤原子的碳在内的最长碳链作为主 链,编号时,使不饱和键的位次最小。如 CH=CHCHCI CH2=CH-CHz-CH2Br 3-氯-1-丙烯(烯丙基氯) 4-澳-1-丁烯 芳香族卤代烃一般以芳烃为母体,卤原子作为取代基。如: ○yr 工, 溴苯 2-溴甲苯 有些卤代烃还有常用的俗名:如氯仿、碘仿等。 第二节卤代烃的物理性质 常温下,除氯甲烷、氯乙烷、溴甲烷等低级卤代烃为气体外,一般为液体, 而C以上的高级卤代烃为固体。卤代烃的蒸气有毒,应避免吸入。卤代烃难溶 于水,可溶于醇、醚、烃等有机溶剂。氯仿、四氯化碳等卤代烃本身就是常用的
称为卤某烃,或某基卤。如: 溴甲烷 氯代正丁烷 氯代异丁烷 (甲基溴) (正丁基氯) (异丁基氯) (叔丁基氯) CH3Br CH3CH2CH2CH2 Cl CH3CH CH3 CH3 CH3 氯代叔丁烷 CH2 Cl CH3 C Cl 烯丙基溴 苄基溴(溴苄) 异丙基溴 氯乙烯 Br CH2=CH CH2 Br C6H5 CH2 Br CH3 CH CH3 CH2=CH Cl (二)系统命名法 对于较复杂的卤代烃,应采用系统命名法,以相应的烃为母体,将卤原子当 作取代基,命名的基本原则与烃类似。选择连有卤原子的碳在内的最长碳链作为 主链,编号则采用位次和最小原则。取代基的位次和名称按“次序规则”优先基 团在后的原则排列在烃名称前面。如: CH2CH3 Cl 4-乙基-2,4-二氯己烷 CH3 Cl Br Cl 2-甲基-3-氯丁烷 2-氯-3-溴丁烷 Cl CH3 CH CH CH3 CH3 CH CH CH3 CH3CH2C CH2 CHCH3 不饱和卤代烃应选含有不饱和键和连有卤原子的碳在内的最长碳链作为主 链,编号时,使不饱和键的位次最小。如: 3-氯-1-丙烯(烯丙基氯) 4-溴 -1-丁烯 CH2 =CH CH2 Cl CH2=CH CH2 CH2Br 芳香族卤代烃一般以芳烃为母体,卤原子作为取代基。如: Br 溴苯 2-溴甲苯 Br CH3 有些卤代烃还有常用的俗名:如氯仿、碘仿等。 第二节 卤代烃的物理性质 常温下,除氯甲烷、氯乙烷、溴甲烷等低级卤代烃为气体外,一般为液体, 而 C15 以上的高级卤代烃为固体。卤代烃的蒸气有毒,应避免吸入。卤代烃难溶 于水,可溶于醇、醚、烃等有机溶剂。氯仿、四氯化碳等卤代烃本身就是常用的
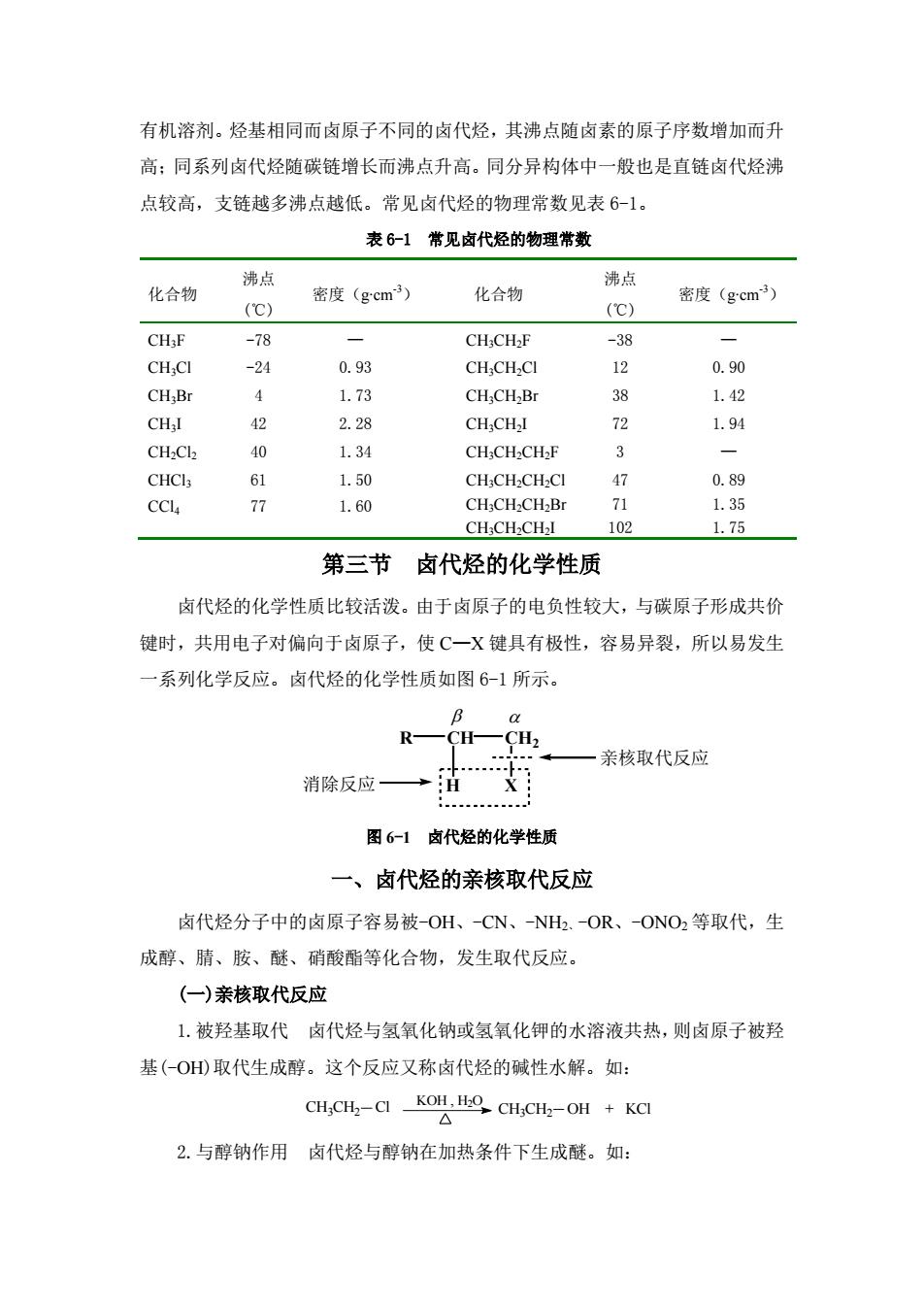
有机溶剂。烃基相同而肉原子不同的卤代烃,其沸点随卤素的原子序数增加而升 高:同系列卤代烃随碳链增长而沸点升高。同分异构体中一般也是直链卤代烃沸 点较高,支链越多沸点越低。常见卤代烃的物理常数见表6-1。 表6-1常见卤代烃的物理常数 沸点 沸点 化合物 (C) 密度(gcm3) 化合物 密度(gcm3) (C) -78 CHCH:F -38 CH:CI -24 0.93 CHCHCI 12 0.90 CH;B 1.73 CHCH2Br 1.42 CHI 42 2.28 CHCHI e 1.94 CH:Cl 1.34 CH;CH.CH2F 3 CHCI 61 1.50 CHCH-CH-CI 公 0.89 CCL 77 1.60 1.35 CH-CH2CH2l 102 1.75 第三节卤代烃的化学性质 卤代烃的化学性质比较活泼。由于卤原子的电负性较大,与碳原子形成共价 键时,共用电子对偏向于卤原子,使C一X键具有极性,容易异裂,所以易发生 一系列化学反应。卤代烃的化学性质如图61所示。 R CH一CH 一亲核取代反应 消除反应 H 图6-1卤代烃的化学性质 一、卤代烃的亲核取代反应 卤代烃分子中的卤原子容易被-OH、-CN、-NH.OR、ONO2等取代,生 成醇、腈、胺、醚、硝酸酯等化合物,发生取代反应。 (一)亲核取代反应 1.被羟基取代卤代烃与氢氧化钠或氢氧化钾的水溶液共热,则卤原子被羟 基(-OH取代生成醇。这个反应又称卤代烃的碱性水解。如: CH,CH-CIKO CHCH.-OH +KCI △ 2.与醇钠作用卤代烃与醇钠在加热条件下生成醚。如:
有机溶剂。烃基相同而卤原子不同的卤代烃,其沸点随卤素的原子序数增加而升 高;同系列卤代烃随碳链增长而沸点升高。同分异构体中一般也是直链卤代烃沸 点较高,支链越多沸点越低。常见卤代烃的物理常数见表 6-1。 表 6-1 常见卤代烃的物理常数 化合物 沸点 (℃) 密度(g∙cm -3) 化合物 沸点 (℃) 密度(g∙cm -3) CH3F -78 — CH3CH2F -38 — CH3Cl -24 0.93 CH3CH2Cl 12 0.90 CH3Br 4 1.73 CH3CH2Br 38 1.42 CH3I 42 2.28 CH3CH2I 72 1.94 CH2Cl2 40 1.34 CH3CH2CH2F 3 — CHCl3 61 1.50 CH3CH2CH2Cl 47 0.89 CCl4 77 1.60 CH3CH2CH2Br CH3CH2CH2I 71 102 1.35 1.75 第三节 卤代烃的化学性质 卤代烃的化学性质比较活泼。由于卤原子的电负性较大,与碳原子形成共价 键时,共用电子对偏向于卤原子,使 C—X 键具有极性,容易异裂,所以易发生 一系列化学反应。卤代烃的化学性质如图 6-1 所示。 R CH CH2 H X 亲核取代反应 消除反应 图 6-1 卤代烃的化学性质 一、卤代烃的亲核取代反应 卤代烃分子中的卤原子容易被-OH、-CN、-NH2、-OR、-ONO2 等取代,生 成醇、腈、胺、醚、硝酸酯等化合物,发生取代反应。 (一)亲核取代反应 1.被羟基取代 卤代烃与氢氧化钠或氢氧化钾的水溶液共热,则卤原子被羟 基(-OH)取代生成醇。这个反应又称卤代烃的碱性水解。如: KOH , H2O CH3CH2 Cl CH3CH2 OH + KCl 2.与醇钠作用 卤代烃与醇钠在加热条件下生成醚。如:

甲醇钠 甲乙速 3.被氰基取代卤代烃与氰化钾(钠)在乙醇溶液中回流,则生成腈。如: (CH)CH-1+NaCN (CH2).CH-CN+Nal 产物比原来的卤代烃分子增加了1个碳原子,这在有机合成中,是增长碳链 的方法之一。如: CHjI NaCN- →CH,CNHQ→CH COOH 4.被氨基取代卤代烃和氨在乙醇溶液中加热加压,卤原子被氨基取代生成 胺。如: CH,CH,CHC+NHnm热m正CH,CH,CHNH,+HC 丙胺 5.与硝酸银的反应肉代烃和硝酸银的醇溶液反应,生成硝酸和卤化银沉 淀。各种卤代烃与硝酸银的反应活性不同:若烃基相同卤原子不同时,卤代烃活 性顺序为:RI>RB>RCI>RF:若卤原子相同而烃基结构不同时,卤代烃活性 顺序为:叔卤代烃(3)>仲卤代烃(2)>伯卤代烃(1),因此可用此反应鉴别各 类卤代烃。如: (CH,C-B+AgNO,壁→(CH,C-O-NO+AgBr 硝酸酯溴化银 上述反应有一个共同特点,即都是由试剂的负离子(OH、CN、RO、ONO2) 或具有未共用电子对的分子(NH、RNH)进攻卤代经分子中&及电子云密 度较低的αC原子而引起的反应。这种带有负电荷或未共用电子对的试剂,称 为亲核试剂,常用Nu表示。由亲核试剂进攻带部分正电荷的碳原子而引起的取 代反应称为亲核取代反应,用SN表示。亲核取代反应可用通式表示如下: →R-CH2-Nu+X 卤代烃亲核试剂 产物离去基 (仁)亲核取代反应历程 1937年,英国伦敦大学休斯(Hughes)和英果尔德(Ingold)教授通过对卤代烃
甲醇钠 甲乙醚 CH3CH2Cl + CH3ONa CH3CH2OCH3 + NaCl 3.被氰基取代 卤代烃与氰化钾(钠)在乙醇溶液中回流,则生成腈。如: (CH 乙醇 3 )2CH I + NaCN (CH3 )2CH CN + NaI 产物比原来的卤代烃分子增加了 1 个碳原子,这在有机合成中,是增长碳链 的方法之一。如: CH3 I N aCN CH3CN H2O/H + CH3COOH + 4.被氨基取代 卤代烃和氨在乙醇溶液中加热加压,卤原子被氨基取代生成 胺。如: CH3CH2CH2Cl + NH3 乙醇 加热加压 CH3CH2CH2NH2 + HCl 丙胺 5.与硝酸银的反应 卤代烃和硝酸银的醇溶液反应,生成硝酸酯和卤化银沉 淀。各种卤代烃与硝酸银的反应活性不同:若烃基相同卤原子不同时,卤代烃活 性顺序为:RI>RBr>RCl>RF;若卤原子相同而烃基结构不同时,卤代烃活性 顺序为:叔卤代烃(3º)>仲卤代烃(2º)>伯卤代烃(1º),因此可用此反应鉴别各 类卤代烃。如: (CH3 )3C + Ag NO3 (CH3 )3C O NO2 + Ag Br 醇 硝酸酯 溴化银 Br 上述反应有一个共同特点,即都是由试剂的负离子(OH-、CN-、RO-、ONO2 - ) 或具有未共用电子对的分子( NH3、RNH2 )进攻卤代烃分子中 C X δ+ δ - 电子云密 度较低的 α-C 原子而引起的反应。这种带有负电荷或未共用电子对的试剂,称 为亲核试剂,常用 Nu-表示。由亲核试剂进攻带部分正电荷的碳原子而引起的取 代反应称为亲核取代反应,用 SN表示。亲核取代反应可用通式表示如下: R CH2 X + Nu - R CH2 Nu + X - 卤代烃 亲核试剂 产物 离去基 (二)亲核取代反应历程 1937 年,英国伦敦大学休斯(Hughes)和英果尔德(Ingold)教授通过对卤代烃

水解反应进行系统的研究发现,卤代烃的水解反应是按两种不同的反应历程进行 的。即单分子亲核取代反应(Sx1)和双分子亲核取代反应(S2)历程。 1.单分子亲核取代反应(S)实验证明,叔卤代烃在碱性溶液中水解反应 的历程为S1,反应分两步进行。如叔丁基溴的水解反应历程为 第一步:叔丁基溴的碳溴键发生异裂,生成叔丁基碳正离子和溴负离子,这 步的反应速率较慢。 (CH-Br慢,(CH,C+Br 叔丁基碳正离子(活性中间体) 第二步:生成的叔丁基碳正离子很快地与亲核试剂结合生成叔丁醇。 (CH3)3C++OH快,(CH)3C-OH 叔丁醇 该反应在动力学上属于一级反应,决定整个反应速率的是第一步。叔丁基溴 在碱性溶液中的水解反应速率仅与叔丁基溴的浓度有关,而与亲核试剂(O)的 浓度无关。其反应速率的表达式为:v=M(CHCB小,其中k为速率常数。故称 单分子亲核取代反应。 S1反应历程的特点为:①单分子反应,反应速率仅与卤代烃的浓度有关, 而与亲核试剂的浓度无关:②反应是分步进行的:③决定反应速率的第一步中有 碳正离子活性中间体生成。 2.双分子亲核取代反应(S2)实验证明,溴甲烷的碱性水解反应的历程为 S2,反应一步完成。 →CH,OH+Br 溴甲烷在碱性溶液中的反应速率不仅与卤代烃[CH,B]的浓度成正比,也与 碱[OH]的浓度成正比,在反应动力学上为二级反应。该反应的速率表达式为: v=k[CH;Br][OH],所以称为双分子亲核取代反应。 在该反应过程中,亲核试剂OH从溴的背面进攻aC原子,形成一个过渡 状态。C-O键逐渐形成,C-Br键逐渐变弱:
水解反应进行系统的研究发现,卤代烃的水解反应是按两种不同的反应历程进行 的。即单分子亲核取代反应(SN1)和双分子亲核取代反应(SN2)历程。 1.单分子亲核取代反应(SN1) 实验证明,叔卤代烃在碱性溶液中水解反应 的历程为 SN1,反应分两步进行。如叔丁基溴的水解反应历程为: 第一步:叔丁基溴的碳溴键发生异裂,生成叔丁基碳正离子和溴负离子,这 一步的反应速率较慢。 (CH3 )3C+ + Br 慢 - 叔丁基碳正离子(活性中间体) (CH3 )3 Br 第二步:生成的叔丁基碳正离子很快地与亲核试剂结合生成叔丁醇。 (CH3 )3C+ + OH- 快 (CH3 )3C-OH 叔丁醇 该反应在动力学上属于一级反应,决定整个反应速率的是第一步。叔丁基溴 在碱性溶液中的水解反应速率仅与叔丁基溴的浓度有关,而与亲核试剂(OH- )的 浓度无关。其反应速率的表达式为:υ = k[(CH3)3CBr],其中 k 为速率常数。故称 单分子亲核取代反应。 SN1 反应历程的特点为:①单分子反应,反应速率仅与卤代烃的浓度有关, 而与亲核试剂的浓度无关;②反应是分步进行的;③决定反应速率的第一步中有 碳正离子活性中间体生成。 2.双分子亲核取代反应(SN2) 实验证明,溴甲烷的碱性水解反应的历程为 SN2,反应一步完成。 CH3Br + OH- CH3OH + Br - 溴甲烷在碱性溶液中的反应速率不仅与卤代烃[CH3Br]的浓度成正比,也与 碱[OH- ]的浓度成正比,在反应动力学上为二级反应。该反应的速率表达式为: υ = k[CH3Br][OH- ],所以称为双分子亲核取代反应。 在该反应过程中,亲核试剂 OH-从溴的背面进攻 α-C 原子,形成一个过渡 状态。C-O 键逐渐形成,C-Br 键逐渐变弱: