
延安大学精品课程…物理化学 表面功 y(表面张力) d4(面积的改变) ydA 7.常用的徽分公式 ①全微分方程:设H=f(T,p),丽=识】 dT+ dp (2)设:Z=f(T,p),则dZ= dT+ ap (3)判断状态函数的原则:二阶偏导与求导顺序无关(全微分性质) )- ④倒数关系 9福环关系:设:U=f,n,)〔部)〔),=- (6)链关系:严-少(引入第三个变量) dt dy dt 2.4 热力学第一定律 一、热功当量 焦耳(Joule)和迈耶尔(Mayer)自1840年起,历经20多年,用各种实验求证热和功的转换关系, 得到的结果是一致的。 即:1cal=4.1840J 这就是著名的热功当量,为能量守恒原理提供了科学的实验证明。 现在,国际单位制中已不用cl,热功当量这个词将逐渐被废除。 二、能量守恒定律 到1850年,科学界公认能量守恒定律是自然界的普遍规律之一。能量守恒与转化定律可表述为: 自然界的一切物质都具有能量,能量有各种不同形式,能够从一种形式转化为另一种形式,但在转 化过程中,能量的总值不变。 三、体系的能量 体系的能量由下列三部分组成 (1)系统整体运动的动能(T): (2)系统在外力场中的位能(V): (3)热力学能(U),也称内能: 第11页共75页
延安大学精品课程 …… 物理化学 第 11 页 共 75 页 表面功 γ(表面张力) dA(面积的改变) γdA 7. 常用的微分公式 dp p H dT T H H f T p dH p T + (1)全微分方程:设 = ( , ), = p T Z Z Z = f T p dZ = dT dp T p + (2)设: ( , ),则 (3)判断状态函数的原则:二阶偏导与求导顺序无关(全微分性质) p T T p Z Z Z Z p T T p = 4 = 1 V V p T T p ()倒数关系: 5 = −1 = V U U T V V T T U ()循环关系:设:U f(T,V),则 6 dZ dZ dy dt dy dt ( )链关系: = (引入第三个变量) 2.4 热力学第一定律 一、热功当量 焦耳(Joule)和迈耶尔(Mayer)自 1840 年起,历经 20 多年,用各种实验求证热和功的转换关系, 得到的结果是一致的。 即: 1 cal = 4.1840 J 这就是著名的热功当量,为能量守恒原理提供了科学的实验证明。 现在,国际单位制中已不用 cal,热功当量这个词将逐渐被废除。 二、能量守恒定律 到 1850 年,科学界公认能量守恒定律是自然界的普遍规律之一。能量守恒与转化定律可表述为: 自然界的一切物质都具有能量,能量有各种不同形式,能够从一种形式转化为另一种形式,但在转 化过程中,能量的总值不变。 三、体系的能量 体系的能量由下列三部分组成 (1)系统整体运动的动能(T); (2)系统在外力场中的位能(V); (3)热力学能(U),也称内能;

延安大学精品课程…物理化学 即:E=T+V+UU 热力学研究的对象:宏观静止、无整体运动的系统,并且一般不存在特殊的外力场,故只考虑热 力学能。 四、热力学能 热力学能(thermodynamic energy)以前称为内能(internal energy),它是指体系内部能量的总和, 包括分子运动的平动能、转动能、振动能、电子能、核能以及各种粒子之间的相互作用位能等。 热力学能是状态函数,用符号U表示,是系统的自身性质,只决定于其状态,是系统状态的单值函 数,在定态下有定值。它的绝对值尚无法测定,只能求出它的变化值。 对纯物质的均相系统,U是P、V、T中任意两个独立变量再加上物质的量n的函数。即U=∫(T, V,n) 五、热力学第一定律 文字表述:是能量守恒与转化定律在热现象领域内所具有的特殊形式,说明热力学能、热和功之间 可以相互转化,但总的能量不变。 热力学第一定律表述:第一类永动机是不可能制成的。 第一类永动机:一种既不靠外界提供能量,本身也不减少能量,却可以不断对外作功的机器称为第 一类永动机,它显然与能量守恒定律矛盾。 历史上曾一度热衷于制造这种机器,均以失败告终,也就证明了能量守恒定律的正确性。 第一定律的数学表达式△U=Q+W 对微小变化:dU=6Q+8W 因为热力学能是状态函数,数学上具有全微分性质,微小变化可用dU表示:Q和W不是状态函数, 微小变化用8表示,以示区别。 说明:(1)适用于封闭体系,也可适用于孤立系统 (2)W总功,W=W。+W, (3)虽然Q与W是过程变量,但Q一W只决定于始终态。 补充:证明U是状态函数(反证法) 2.5准备静态过程与可逆过程 一、功与过程 设在定温下,一定量理想气体在活塞筒中克服外压,经4种不同途径,体积从1膨胀到2所作 的功。 1.自由膨胀(向真空膨胀) 6W1=-p.dV=0因为ps=0,所以,W=0。 2.等外压膨胀(P。保持不变) W2=-P2(V2-) 第12页共75页 P 阴形面积代表用
延安大学精品课程 …… 物理化学 第 12 页 共 75 页 即:E=T+V+U 热力学研究的对象:宏观静止、无整体运动的系统,并且一般不存在特殊的外力场,故只考虑热 力学能。 四、热力学能 热力学能(thermodynamic energy)以前称为内能(internal energy),它是指体系内部能量的总和, 包括分子运动的平动能、转动能、振动能、电子能、核能以及各种粒子之间的相互作用位能等。 热力学能是状态函数,用符号 U 表示,是系统的自身性质,只决定于其状态,是系统状态的单值函 数,在定态下有定值。它的绝对值尚无法测定,只能求出它的变化值。 对纯物质的均相系统, U 是 P、V、T 中任意两个独立变量再加上物质的量 n 的函数。即 U=f(T, V,n) 五、热力学第一定律 文字表述:是能量守恒与转化定律在热现象领域内所具有的特殊形式,说明热力学能、热和功之间 可以相互转化,但总的能量不变。 热力学第一定律表述:第一类永动机是不可能制成的。 第一类永动机:一种既不靠外界提供能量,本身也不减少能量,却可以不断对外作功的机器称为第 一类永动机,它显然与能量守恒定律矛盾。 历史上曾一度热衷于制造这种机器,均以失败告终,也就证明了能量守恒定律的正确性。 第一定律的数学表达式 U = Q + W 对微小变化: dU =Q +W 因为热力学能是状态函数,数学上具有全微分性质,微小变化可用 dU 表示;Q 和 W 不是状态函数, 微小变化用 表示,以示区别。 说明:(1)适用于封闭体系,也可适用于孤立系统 (2)W 总功,W=We + W f (3)虽然 Q 与 W 是过程变量,但 Q-W 只决定于始终态。 补充:证明 U 是状态函数(反证法) 2.5 准备静态过程与可逆过程 一、功与过程 设在定温下,一定量理想气体在活塞筒中克服外压 ,经 4 种不同途径,体积从 V1 膨胀到 V2 所作 的功。 1.自由膨胀 (向真空膨胀) 因为 pe =0,所以,W=0。 2.等外压膨胀(pe保持不变) δ d 0 W p V e,1 e = − = e,2 2 2 1 W p V V = − − ( ) pV1 1 p2 V1 V2 V p pV2 2 We,2
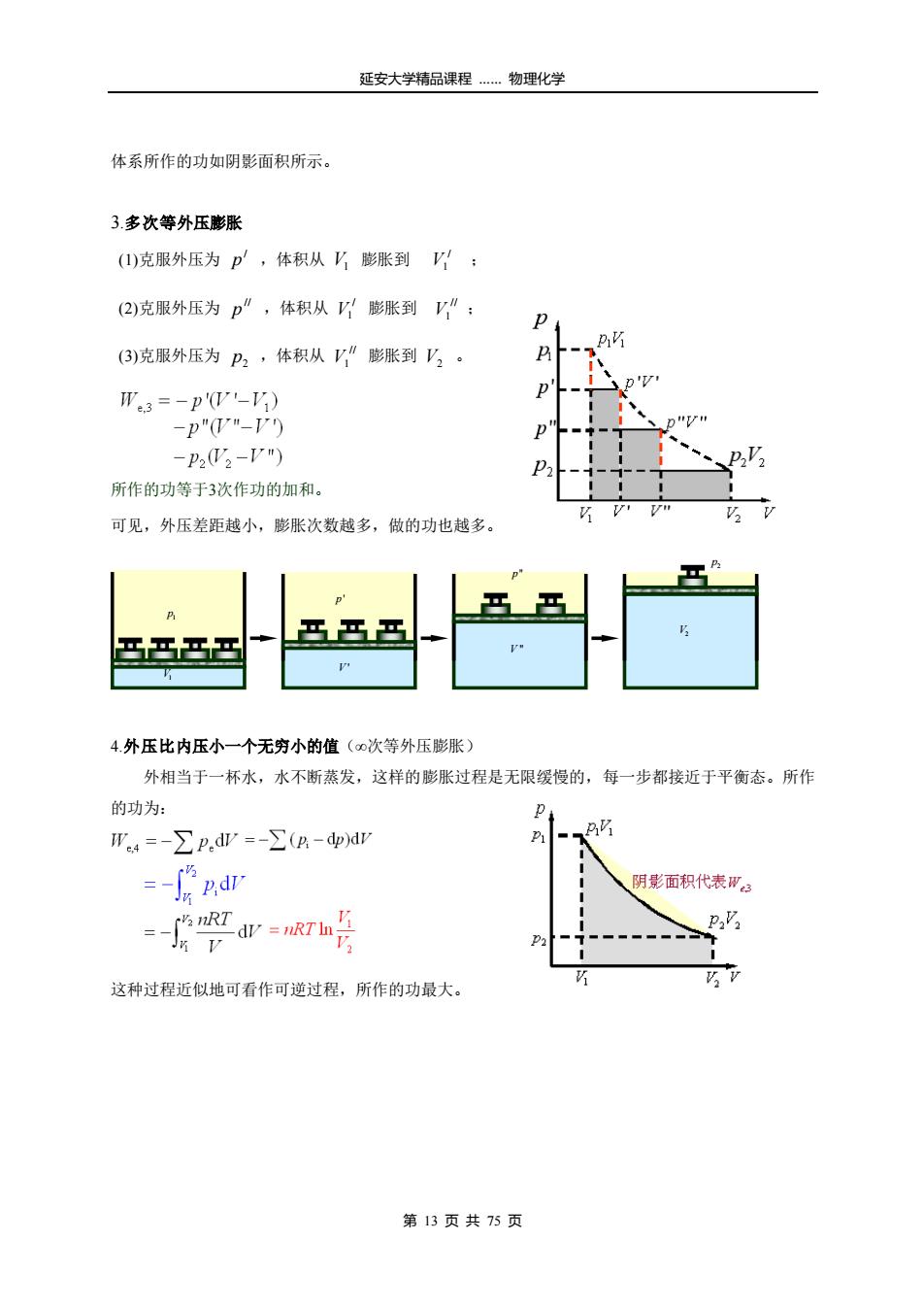
延安大学精品课程…物理化学 体系所作的功如阴影面积所示。 3.多次等外压膨胀 (1)克服外压为p,体积从V膨胀到V: (2)克服外压为p”,体积从膨胀到V”: P 巧 (3)克服外压为P2,体积从V”膨胀到V2。 W3=-p'W-') -p"W"-V) -P22-V") 所作的功等于3次作功的加和。 可见,外压差距越小,膨胀次数越多,做的功也越多。 D 马马马马 4.外压比内压小一个无穷小的值(0次等外压膨胀) 外相当于一杯水,水不断蒸发,这样的膨胀过程是无限缓慢的,每一步都接近于平衡态。所作 的功为: p We4=-∑p.dr=-∑(g-dp)dr hndr 阴影面积代表W RT =T 三JV 这种过程近似地可看作可逆过程,所作的功最大。 第13页共75页
延安大学精品课程 …… 物理化学 第 13 页 共 75 页 体系所作的功如阴影面积所示。 3.多次等外压膨胀 (1)克服外压为 / p ,体积从 V1 膨胀到 / V1 ; (2)克服外压为 // p ,体积从 / V1 膨胀到 // V1 ; (3)克服外压为 2 p ,体积从 // V1 膨胀到 V2 。 所作的功等于3次作功的加和。 可见,外压差距越小,膨胀次数越多,做的功也越多。 4.外压比内压小一个无穷小的值(∞次等外压膨胀) 外相当于一杯水,水不断蒸发,这样的膨胀过程是无限缓慢的,每一步都接近于平衡态。所作 的功为: 这种过程近似地可看作可逆过程,所作的功最大。 1 p V1 p ' V ' p " V " p2 V2
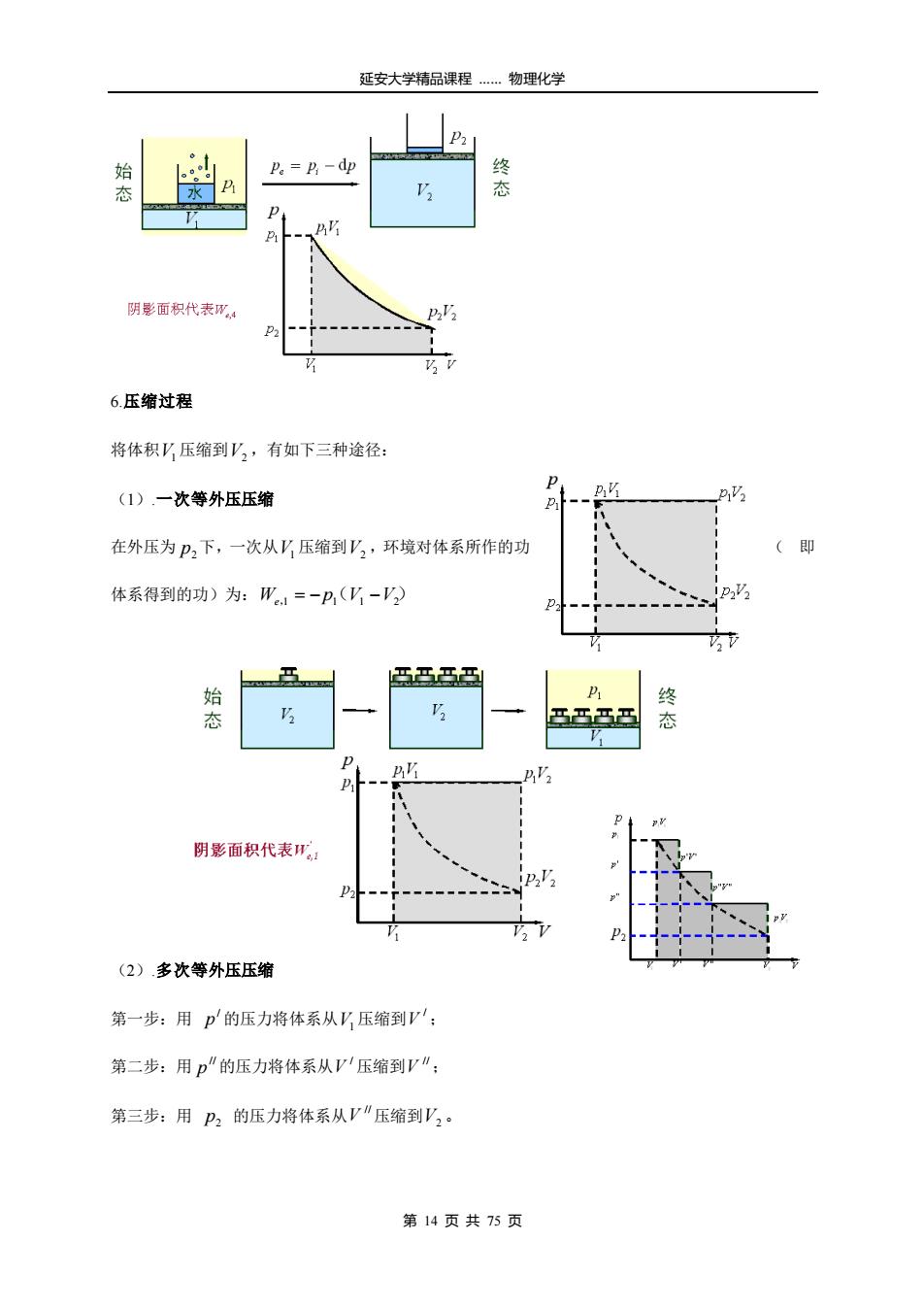
延安大学精品课程…物理化学 始 P。=-dp 水 态 B P 阴影面积代表W4 6.压缩过程 将体积V压缩到V,,有如下三种途径: P (1).一次等外压压缩 2 在外压为P2下,一次从?压缩到'2,环境对体系所作的功 (即 体系得到的功)为:W=-P,(V,-V) P23 臣马马臣 终 态 马马马马 态 P 阴影面积代表Ha (2)多次等外压压缩 第一步:用p的压力将体系从V压缩到V': 第二步:用p"的压力将体系从V压缩到V": 第三步:用P2的压力将体系从V"压缩到V2。 第14页共75页
延安大学精品课程 …… 物理化学 第 14 页 共 75 页 6.压缩过程 将体积 V1 压缩到 V2 ,有如下三种途径: (1).一次等外压压缩 在外压为 p2 下,一次从 V1 压缩到 V2 ,环境对体系所作的功 ( 即 体系得到的功)为: We,1 = −p(1 V1 −V2) (2).多次等外压压缩 第一步:用 / p 的压力将体系从 V1 压缩到 / V ; 第二步:用 // p 的压力将体系从 / V 压缩到 // V ; 第三步:用 2 p 的压力将体系从 // V 压缩到 V2

延安大学精品课程…物理化学 W1=-p(W'-T2) -p(V'-V') AD' D -h(-V) 整个过程所作的功为三步加和。 (3)可逆压缩 如果将蒸发掉的水气慢慢在杯中凝聚,使压力缓 慢增加, 阴影面积代表W4 恢复到原状,所作的功为: W=- p,dy nRT I 则体系和环境都能恢复到原状。 P。=P,+dp 态 D 终 P 阴影面积代表W 功与过程小结: 从以上的膨胀与压缩过程看出,功与变化的途径有关。虽然始终态相同,但途径不同,所作的功也 大不相同。显然,可逆膨胀,体系对环境作最大功:可逆压缩,环境对体系作最小功。 第15页共75页
延安大学精品课程 …… 物理化学 第 15 页 共 75 页 整个过程所作的功为三步加和。 (3)可逆压缩 如果将蒸发掉的水气慢慢在杯中凝聚,使压力缓 慢增加, 恢复到原状,所作的功为: 1 / 2 ,3 ln 1 2 V V W p dV nRT V V e = − i = 则体系和环境都能恢复到原状。 功与过程小结: 从以上的膨胀与压缩过程看出,功与变化的途径有关。虽然始终态相同,但途径不同,所作的功也 大不相同。显然,可逆膨胀,体系对环境作最大功;可逆压缩,环境对体系作最小功