
2)两性物质的类型: 电离理论的多元弱酸的酸式酸根离子; 电离理论的弱酸弱碱盐; 两性溶剂; 氨基酸类。 3、共轭酸碱对和酸碱半反应: 1)共轭酸碱对:组成仅相差一个质子的两种酸碱 如:NH4-NH3,HAc-Ac等 2)酸碱半反应:共轭酸碱对相互转化的反应 HAc =Ac-+H+ 酸=碱+H+
6 3、共轭酸碱对和酸碱半反应: 1) 共轭酸碱对: 组成仅相差一个质子的两种酸碱 如: NH4 +-NH3 , HAc-Ac -等 2) 酸碱半反应:共轭酸碱对相互转化的反应 HAc =Ac -+H+ 酸 =碱 + H+ 2) 两性物质的类型: ——电离理论的多元弱酸的酸式酸根离子; ——电离理论的弱酸弱碱盐; ——两性溶剂; ——氨基酸类

同一物质在不同的共轭酸碱对中,可表 现出不同的酸碱性 酸碱是相对的: HPO4≌H++HPO H3POH*+H2PO
7 同一物质在不同的共轭酸碱对中,可表 现出不同的酸碱性 v酸碱是相对的:
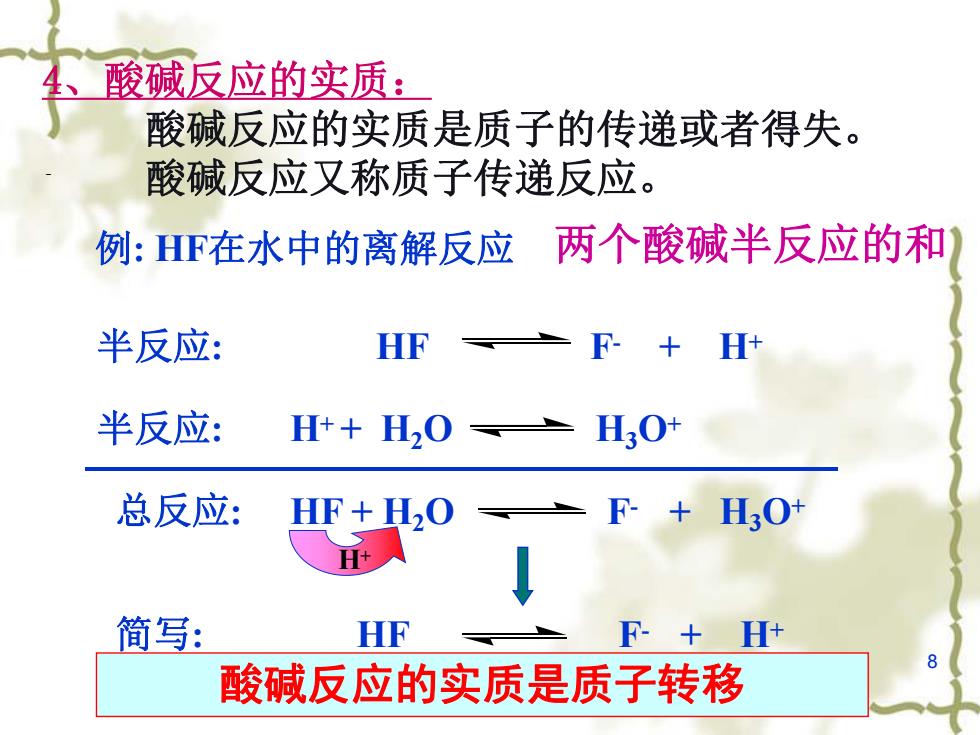
4、酸碱反应的实质: 酸碱反应的实质是质子的传递或者得失。 酸碱反应又称质子传递反应。 例:F在水中的离解反应 两个酸碱半反应的和 半反应: HF 半反应: H++H2O L30 总反应: HF+H,O F+H3O+ + 简写: HF F-+H+ 酸碱反应的实质是质子转移
8 4、酸碱反应的实质: 酸碱反应的实质是质子的传递或者得失。 酸碱反应又称质子传递反应。 酸碱反应的实质是质子转移 H+ 例: HF在水中的离解反应 半反应: HF F- + H+ 半反应: H+ + H2O H3O+ 总反应: HF + H2O F- + H3O+ 简写: HF F- + H+ 两个酸碱半反应的和
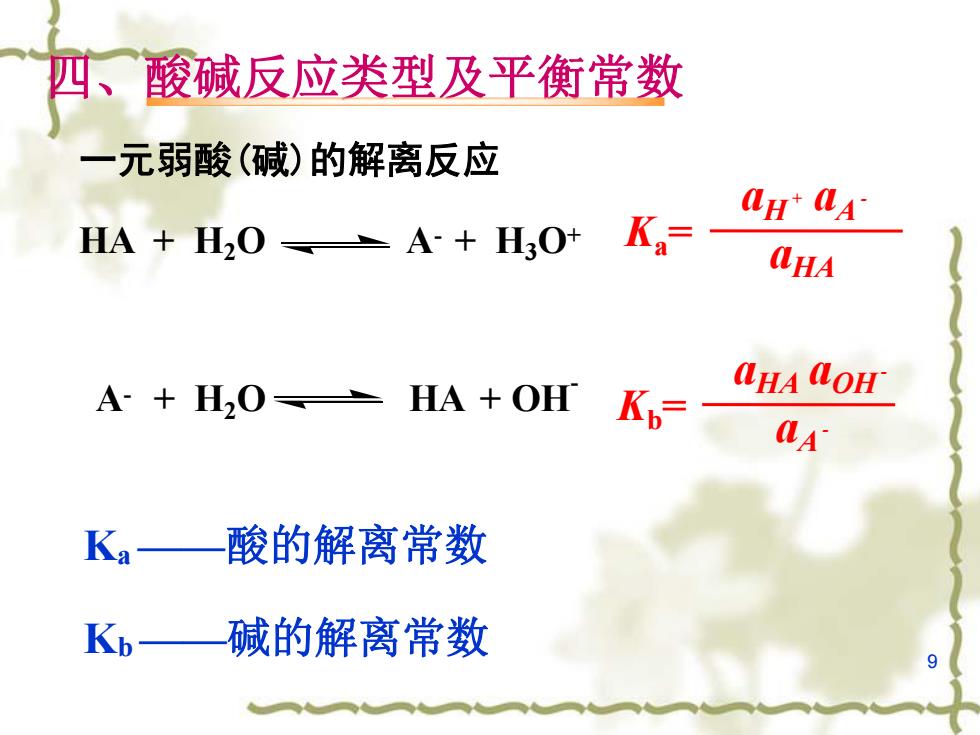
四、酸碱反应类型及平衡常数 一元弱酸(碱)的解离反应 HA H2OA+H;O+ K 4HA A+H20 HA OH Kp= CHA QOH A Ka— 酸的解离常数 Kb 碱的解离常数 9
9 四、酸碱反应类型及平衡常数 一元弱酸(碱)的解离反应 HA + H2O A- + H3O+ A- + H2O HA + OH - aH + aA - Ka = aHA aHA aOH - Kb= aA - Ka——酸的解离常数 Kb——碱的解离常数
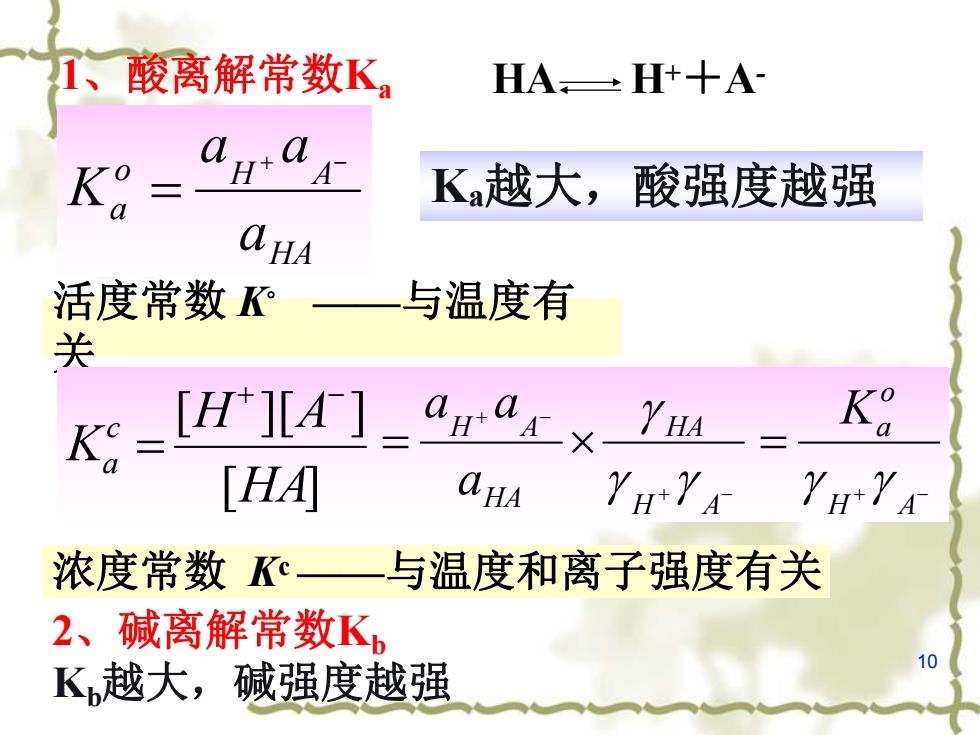
1、 酸离解常数K HA,±H+十A K K越大,酸强度越强 HA 活度常数 与温度有 关 K=HJ[A-“ga1x YHA Ko 「HAI CHA 浓度常数K一与温度和离子强度有关 2、碱离解常数Kb K越大,碱强度越强 10
10 HA o H A a a a a K 1、酸离解常数Ka HA H++A- 活度常数 K◦ ——与温度有 关 浓度常数 Kc——与温度和离子强度有关 [ ] [ ][ ] HA H A K c a H A HA HA H A a a a g g g H A o Ka g g Ka越大,酸强度越强 2、碱离解常数Kb Kb越大,碱强度越强