
3、共轭酸碱对的酸碱强度关系 HAc+H,O台Ac+H,O*Ka= [H+][A] [HAc] Ac+H,O→HAC+OH [HACJOH pKa+pKp =pKw=14.00 [Ac K。K=Hy.LHACHOH] [H]·[OH] HAc网 TAc] -Kw 酸越强,其共轭碱则越弱 =1.0×10-14
11 3、共轭酸碱对的酸碱强度关系 HAc H2O Ac H3O [ ] [ ][ ] C C HA H A Ka Ac H2O HAc OH [ ] [ ][ ] Ac HA OH K C b [Ac ] [HAc][OH ] [HAc] [H ][Ac ] K K - - - a b [H ] [OH ] - Kw 14 1.0 10 酸越强,其共轭碱则越弱 pKa pKb pKw 14.00
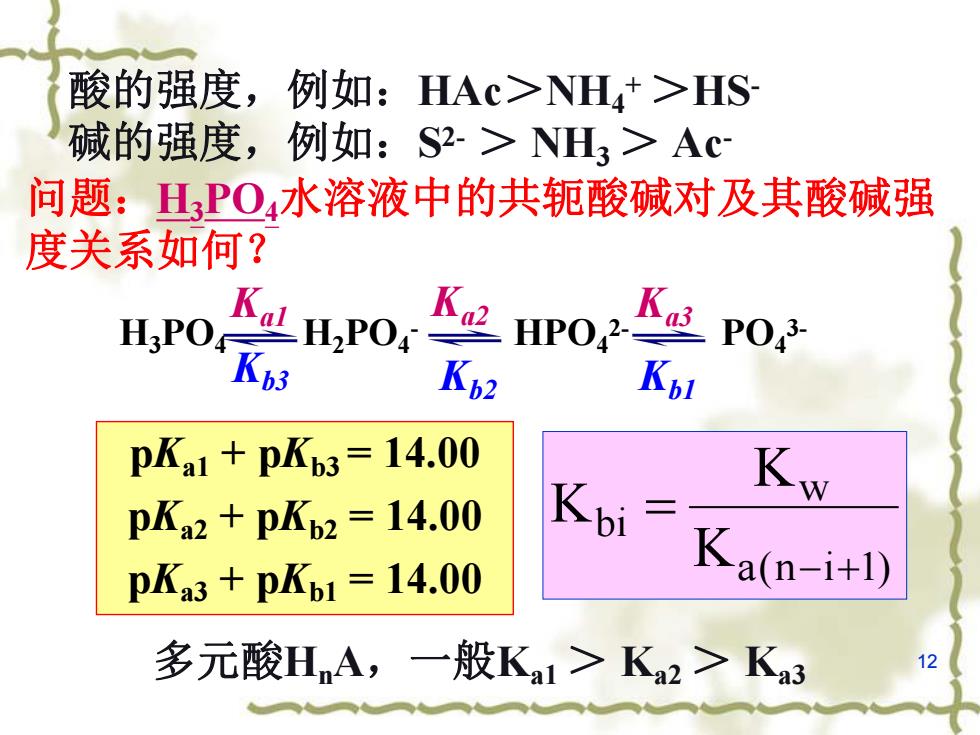
酸的强度,例如:HAc>NH4+>HS 碱的强度,例如:S2->NL3>Ac 问题:PO4水溶液中的共轭酸碱对及其酸碱强 度关系如何? H:PO Ka2 HP042 Ka3 P043 Kb3 Kp2 Kbl pKa1+pKb3=14.00 pKa2+pKb2=14.00 Kbi Kw pKa3+pKb1=14.00 Ka(p-i+1) 多元酸HnA,一般Ka>K2>Ka3 12
12 酸的强度,例如:HAc>NH4 +>HS- 碱的强度,例如:S2- > NH3> Ac - 多元酸HnA,一般Ka1> Ka2> Ka3 问题:H3PO4水溶液中的共轭酸碱对及其酸碱强 度关系如何? H3PO4 H2PO4 - HPO4 2- PO4 3- Kb2 Kb1 Kb3 Ka1 Ka2 Ka3 pKa1 + pKb3 = 14.00 pKa2 + pKb2 = 14.00 pKa3 + pKb1 = 14.00 a(n i 1) w bi K K K

[HPOm]·[H+] HPO4+2O=→H3O++H2PO4 [H;PO4] H2PO4+H20一H3O*+PO1 K,=HOg1·H】 [H2PO HPO房+H20一H0++PO8 K,-o星Hy [HPO] PO3+H202HPO号+OH K-031·OHj [PO好] HPO+H20一HPO+OH K-6030H] [HPO保] HPO +H2O-HsPO+OH K-西01o] [HPO K4×K6=K3,XK,=K%×K,=KW 13
13

五、酸碱反应平衡常数 1、强碱和强酸的反应 OH+H+=H2O K- =1014 反应十分完全 [H]·[OH]Kw 2、强碱(酸) 和弱酸(碱)的反应 [A] Ka OH-+HA=H,O+A- Kt= [HA][OH Kw 同理,强酸和弱碱反应 Kt= Kb Kw 酸(碱)越弱,KK)越小,K越小,反应越不完全
14 五、酸碱反应平衡常数 1、强碱和强酸的反应 OH-+ H+ = H2O 14 w t 10 K 1 [H ] [OH ] 1 K 反应十分完全 2、强碱(酸)和弱酸(碱)的反应 w a t K K [HA] [OH ] [A ] K w b t K K 同理,强酸和弱碱反应 K 酸 (碱) 越弱,Ka(Kb ) 越小,Kt越小,反应越不完全 OH- + HA = H2O + A –

3、弱碱和弱酸的反应 K,=K。Ka Kw 反应完全程度最小 由k可表示反应的完全程度,判断滴定的可行性 15
15 3、弱碱和弱酸的反应 w a b t K K K K 反应完全程度最小 由kt可表示反应的完全程度,判断滴定的可行性