
E:表示活化分子的 最低能量,它是 发生化学时,反 应分子所必需的 最低能量,即只 有当气体中那些 能量大于或等于 E,的分子的互 相碰撞后,才能 发生有效碰撞, 才能引起化学反应。 螺 E 能量(E) 气体分子能量分布曲线 有效碰撞:能发生化学反应的碰撞称为有效碰撞 活化分子: 能发生有效碰撞的分子称为活化分子
气体分子能量分布曲线 具有一定能量的分子所占的百分比 / % E1 能量 (E) E1:表示活化分子的 最低能量,它是 发生化学时,反 应分子所必需的 最低能量,即只 有当气体中那些 能量大于或等于 E1的分子的互 相碰撞后,才能 发生有效碰撞, 才能引起化学反应。 有效碰撞: 能发生化学反应的碰撞称为有效碰撞 活化分子: 能发生有效碰撞的分子称为活化分子

阿雷尼乌斯(S.A.Arrhenius,.1889) 活化能:1mol活化分子比非活化分子所高出的能量值。 塔尔曼(Tolman) 活化能:活化分子的平均能量(E*)与反应 物分子的平均能量(E)之差。 有一定能量 分子百分数 E=EE E 能量 E E活化
阿雷尼乌斯(S.A.Arrhenius,1889) 活化能:1mol活化分子比非活化分子所高出的能量值。 塔尔曼(Tolman) 活化能:活化分子的平均能量(E*)与反应 物分子的平均能量(E)之差。 Ea =E * -E

2过渡态理论 ■由反应物到产物的反应过程,必须通过一种过渡 状态,即反应物分子活化形成活化配合物的中间 状态。 如:C一A+B台CA.B]=C+A—B 反应物 活化配合物产物
2 过渡态理论 ◼由反应物到产物的反应过程,必须通过一种过渡 状态,即反应物分子活化形成活化配合物的中间 状态。 如:C—A+B[C.A.B] = C+A—B 反应物 活化配合物 产物
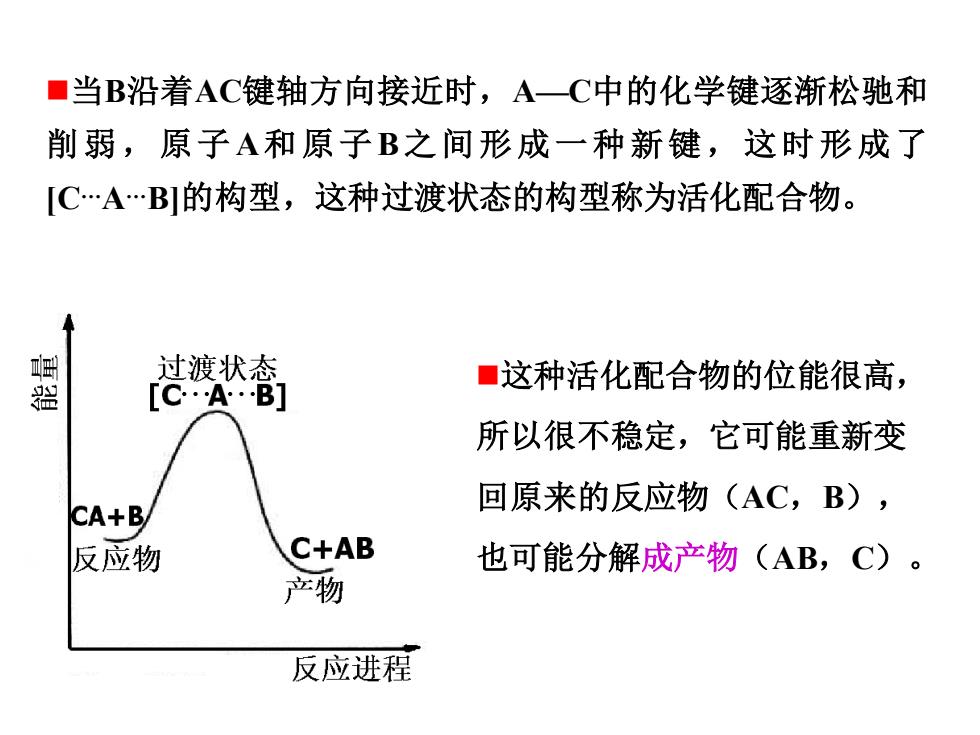
■当B沿着AC键轴方向接近时,A一C中的化学键逐渐松驰和 削弱,原子A和原子B之间形成一种新键,这时形成了 [C·AB的构型,这种过渡状态的构型称为活化配合物。 器 过渡状态 ■这种活化配合物的位能很高, [CAB] 所以很不稳定,它可能重新变 回原来的反应物(AC,B), CA+B/ 反应物 C+AB 也可能分解成产物(AB,C)。 产物 反应进程
◼当B沿着AC键轴方向接近时,A—C中的化学键逐渐松驰和 削弱,原子 A和原子B之间形成一种新键,这时形成了 [C.A.B]的构型,这种过渡状态的构型称为活化配合物。 ◼这种活化配合物的位能很高, 所以很不稳定,它可能重新变 回原来的反应物(AC,B), 也可能分解成产物(AB,C)

(2)过渡状态理论 NO,(g)+CO(g)=NO(g)+CO2(g) 活化配合物 高能量的反应物分子接 触后,会形成一个能量较高、 不稳定的中间产物,叫做适 (管大) B 化配合物,活化配合物是一 种能量较高的过渡态,不稳 △EI 定,极易分解,根据化学键 器 △E 断裂的位置不同,既可形成 产物,也可形成反应物。 NO,+CO) △H △E,为正反应活化能 N0+C02) △E2为逆反应活化能 反应进程
( ) ( ) ( ) ( ) 2 2 NO g + CO g = NO g + CO g (2)过渡状态理论 反应进程 势能(反应体系) 高能量的反应物分子 接 触后,会形成一个能量较高、 不稳定的中间产物,叫做 活 化配合物,活化配合物是一 种能量较高的过渡态,不稳 定,极易分解,根据化学键 断裂的位置不同,既可形成 产物,也可形成反应物 。 活化配合物 ΔE 1 为正反应活化能 ΔE2 为逆反应活化能