
3四配位化合物 四配位是常见的配位,包括 平面正方形和四面体 两种构型。 一般非过渡元素的四配位化合物都是四面体构型。这 是因为采取四面体空间排列,配体间能尽量远离,静电排斥 作用最小能量最低。 在用于成键的四对电子外还多余两对电子时,也能形 成平面正方形构型,此时,两对电子分别位于平面的上下方, 如XeF4就是这样
一般非过渡元素的四配位化合物都是四面体构型。这 是因为采取四面体空间排列, 配体间能尽量远离, 静电排斥 作用最小能量最低。 在用于成键的四对电子外还多余两对电子时, 也能形 成平面正方形构型, 此时, 两对电子分别位于平面的上下方, 如XeF4就是这样。 3 四配位化合物 四配位是常见的配位, 包括 平面正方形 和 四面体 两种构型

过渡金属的四配位化合物既有四面体形,也有平 面正方形,究竟采用哪种构型需考虑下列两种因素的 影响。 (1)配体之间的相互静电排斥作用 (2)配位场稳定化能的影响(见后)。 一般地,当4个配体与不含有8电子构型的过渡 金属离子或原子配位时可形成四面体构型配合物。 而8组态的过渡金属离子或原子一般是形成平面 正方形配合物,但具有d8组态的金属若因原子太小,或 配位体原子太大,以致不可能形成平面正方形时,也 可能形成四面体的构型
过渡金属的四配位化合物既有四面体形, 也有平 面正方形, 究竟采用哪种构型需考虑下列两种因素的 影响。 (1) 配体之间的相互静电排斥作用; (2) 配位场稳定化能的影响(见后)。 一般地,当4个配体与不含有d 8电子构型的过渡 金属离子或原子配位时可形成四面体构型配合物。 而d 8组态的过渡金属离子或原子一般是形成平面 正方形配合物, 但具有d 8组态的金属若因原子太小, 或 配位体原子太大, 以致不可能形成平面正方形时, 也 可能形成四面体的构型
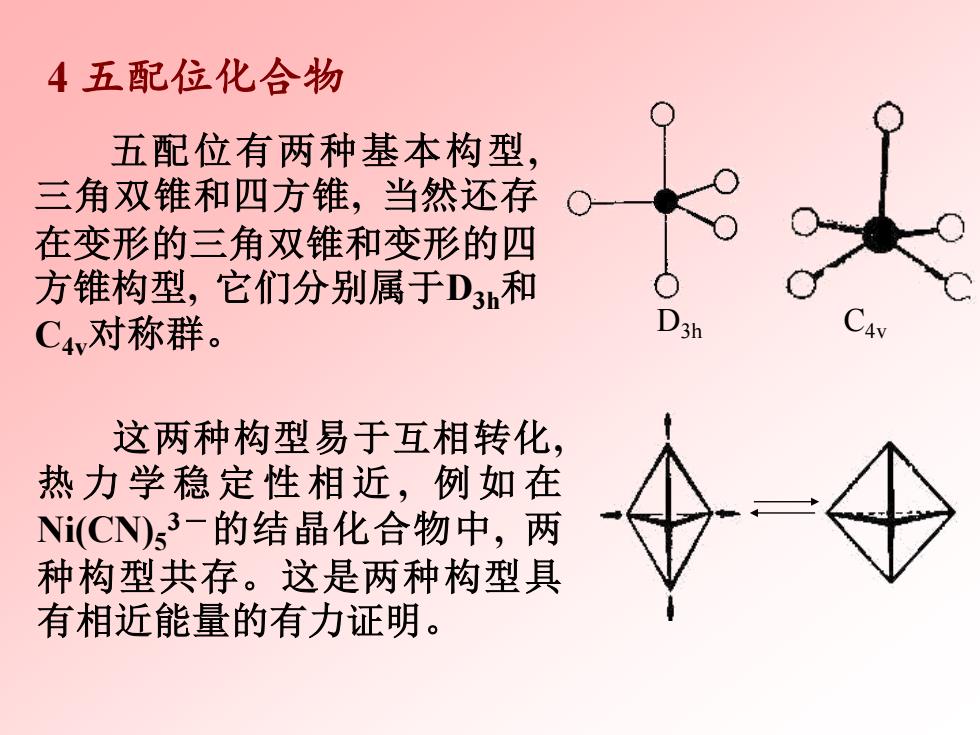
4五配位化合物 五配位有两种基本构型, 三角双锥和四方锥,当然还存 在变形的三角双锥和变形的四 方锥构型,它们分别属于D3和 C4v对称群。 这两种构型易于互相转化, 热力学稳定性相近,例如在 N(CN)s3-的结晶化合物中,两 种构型共存。这是两种构型具 有相近能量的有力证明
4 五配位化合物 五配位有两种基本构型, 三角双锥和四方锥, 当然还存 在变形的三角双锥和变形的四 方锥构型, 它们分别属于D3h和 C4v对称群。 D3h C4v 这两种构型易于互相转化, 热 力 学 稳 定 性 相 近 , 例 如 在 Ni(CN)5 3-的结晶化合物中, 两 种构型共存。这是两种构型具 有相近能量的有力证明

◆应当指出,虽然有相当数目的配位数为5的分 子已被确证,但呈现这种奇配位数的化合物要比配 位数为4和6的化合物要少得多。如PCL,在气相中 是以三角双锥的形式存在,但在固态中则是以四面 体的PCL4+离子和八面体的PCl一离子存在的。因此 ,在根据化学式写出空间构型时,要了解实验测定 的结果,以免判断失误
◆应当指出,虽然有相当数目的配位数为5的分 子已被确证,但呈现这种奇配位数的化合物要比配 位数为4和6的化合物要少得多。如PCl5,在气相中 是以三角双锥的形式存在,但在固态中则是以四面 体的PCl4 +离子和八面体的PCl6 -离子存在的。因此 ,在根据化学式写出空间构型时,要了解实验测定 的结果,以免判断失误
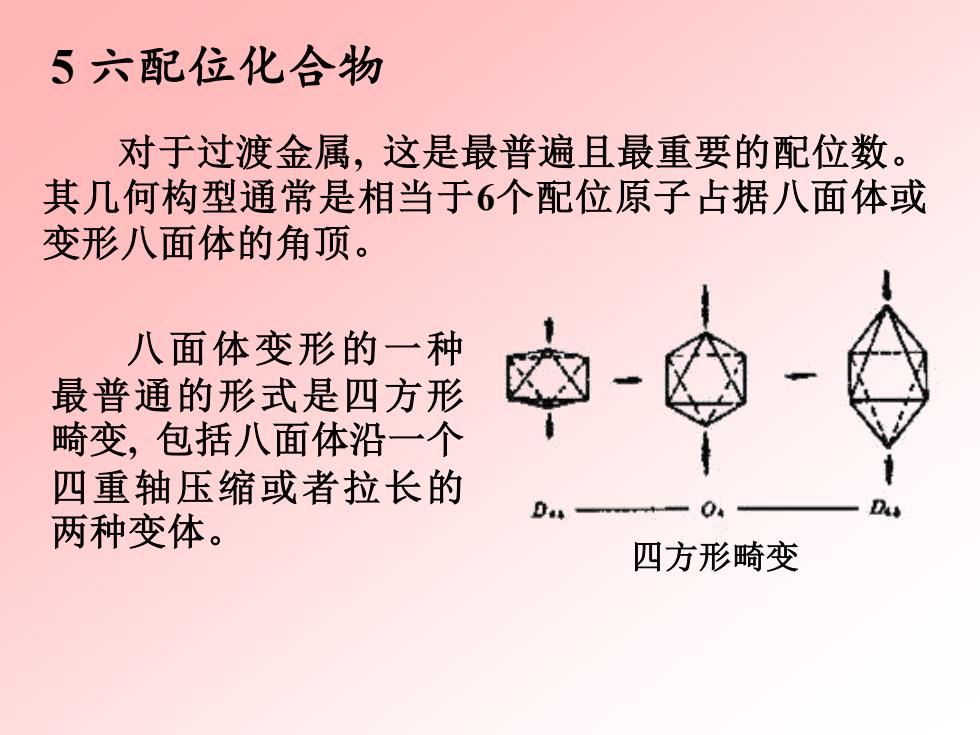
5六配位化合物 对于过渡金属,这是最普遍且最重要的配位数。 其几何构型通常是相当于6个配位原子占据八面体或 变形八面体的角项。 八面体变形的一种 最普通的形式是四方形 畸变,包括八面体沿一个 四重轴压缩或者拉长的 04 D 两种变体。 四方形畸变
5 六配位化合物 对于过渡金属, 这是最普遍且最重要的配位数。 其几何构型通常是相当于6个配位原子占据八面体或 变形八面体的角顶。 八面体变形的一种 最普通的形式是四方形 畸变, 包括八面体沿一个 四重轴压缩或者拉长的 两种变体。 四方形畸变