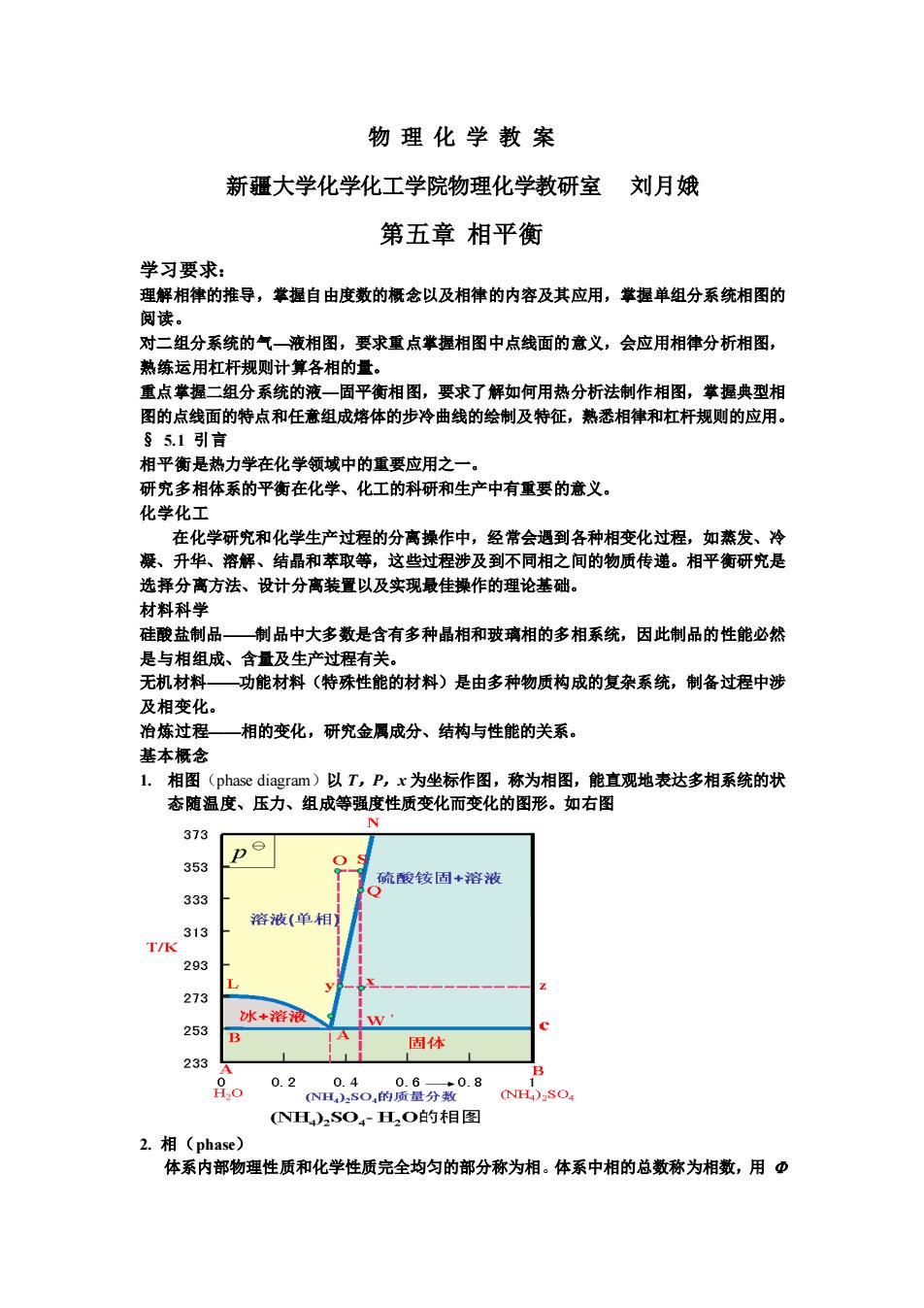
物理化学教案 新疆大学化学化工学院物理化学教研室刘月娥 第五章相平衡 学习要求: 理解相律的推导,举握自由度数的概念以及相律的内容及其应用,肇握单组分系统相图的 阅读。 对二组分系统的气一液相图,要求重点掌握相图中点线面的意义,会应用相律分析相图, 熟练运用杠杆规则计算各相的量。 重点掌握二组分系统的液一固平衡相图,要求了解如何用热分析法制作相图,掌握典型相 图的点梦的带点剂任意这培体的步冷曲线的绘制及特在,恭委相律鬼虹狂规则的应用。 相平衡是热力学在化学领域中的重婴应用之一。 研究多相体系的平衡在化学、化工的科研和生产中有重要的意义。 化学化工 在化学研究和化学生产过程的分高操作中,经常会通到各种相变化过程,如燕发、冷 凝、升华 溶解 过程涉及到不同相之 间的物质传递。相平衡研究是 选择分离方法、设计分高装置以及实现最佳操作的理论基础 材料科学 硅酸盐制品制品中大多数是含有多种晶相和玻璃相的多相系统,因此制品的性能必然 是与相组成、含量乃生产时程有关 无机材料 功能材料(特殊性能的材料)是由多种物质构成的复杂系统,制备过程中涉 及相变化。 治炼过程 —相的变化,研究金属成分、结构与性能的关系。 基本概念 L.相图(phase diagram)以T,P,x为坐标作图,称为相图,能直观地表达多相系统的状 态随温度、压力、组成等强度性质变化而变化的图形。如右图 373 353 硫酸铵固+溶液 333 313 溶液(单相】 T/k 293 273 253 冰+溶液 固体 233 o 0.2 NH)2SO4H,O的相图 2.相(phase) 体系内部物理性质和化学性质完全均匀的部分称为相。体系中相的总数称为相数,用币
物 理 化 学 教 案 新疆大学化学化工学院物理化学教研室 刘月娥 第五章 相平衡 学习要求: 理解相律的推导,掌握自由度数的概念以及相律的内容及其应用,掌握单组分系统相图的 阅读。 对二组分系统的气—液相图,要求重点掌握相图中点线面的意义,会应用相律分析相图, 熟练运用杠杆规则计算各相的量。 重点掌握二组分系统的液—固平衡相图,要求了解如何用热分析法制作相图,掌握典型相 图的点线面的特点和任意组成熔体的步冷曲线的绘制及特征,熟悉相律和杠杆规则的应用。 § 5.1 引言 相平衡是热力学在化学领域中的重要应用之一。 研究多相体系的平衡在化学、化工的科研和生产中有重要的意义。 化学化工 在化学研究和化学生产过程的分离操作中,经常会遇到各种相变化过程,如蒸发、冷 凝、升华、溶解、结晶和萃取等,这些过程涉及到不同相之间的物质传递。相平衡研究是 选择分离方法、设计分离装置以及实现最佳操作的理论基础。 材料科学 硅酸盐制品——制品中大多数是含有多种晶相和玻璃相的多相系统,因此制品的性能必然 是与相组成、含量及生产过程有关。 无机材料——功能材料(特殊性能的材料)是由多种物质构成的复杂系统,制备过程中涉 及相变化。 冶炼过程——相的变化,研究金属成分、结构与性能的关系。 基本概念 1. 相图(phase diagram)以 T,P,x 为坐标作图,称为相图,能直观地表达多相系统的状 态随温度、压力、组成等强度性质变化而变化的图形。如右图 2. 相(phase) 体系内部物理性质和化学性质完全均匀的部分称为相。体系中相的总数称为相数,用

表示。 相与相之间在指定条件下有明显的界面,在界面上宏观性质的改变是飞跃式的。 例如 冰两相平衡 冰与水之间有明显界面,越过这个截面,物理性质发生突变,冰与水 可以用物理方法分开 同一种物质的固体颗粒之间尽管有界面,但由于物理性质和化学性质完全相同,仍核一个相 对待。 3三种相态 :不论有多少种气 只有 相 液体:按其互溶程 可以组成一相、两相或三相共存。 固体:一般有一种固体便有一个相。两种固体粉末无论混合得多么均匀,仍是两个相(固体 溶液除外,它是单相)。 4相平衡:是指在一定条件下一个多相体系内各相 内的物质的种类和数量不随时间 变化的状岁 5,自由度 of freedom) 确定平衡体系的状态所必须的独立强度变量的数目称为自由度,用字母∫表示。这些强 度变量通常是压力、温度和浓度等。 这说明影响体系内相数的因素是强度性质而不是容量性质。例如水常温常压下是液体,与数 量无关若压力或温度改变则会引起相变。 如果已指定某个强度变量,除该变量以外的其它强度变量数称为条件自由度,用表示。 例如:指定了压力, 指定了压力和温度, 如水与水蒸气两相平衡:若指定了温度,水蒸气的压力使确定了:或者指定了水蒸气的压力, 温度便确定了,所以水与水蒸气两相平衡体系的自由度=1(温度或压): 若指定了水蒸气的压力或温度=0 §5.2多相系统平衡的一般条件 在一个封闭的多相体系中,相与相之间可以有热的交换、功的传递和物质的交流。对具有个 相体系的热力学平衡,实际上包含了如下四个平衡条件: (1)热平衡条件:设体系有α,B,.,F个相,达到平衡时,各相具有相同温度 Ta=TB=.=Th (2)压力平衡条件:达到平衡时各相的压力相等 D=p=.=p (3)相平衡条件:任一物质B在各相中的化学势相等,相变达到平衡 哈=唱==唱 (4)化学平衡条件:化学变化达到平衡 4B=0 B §5.3相律 l、相律(phase rule):
表示。 相与相之间在指定条件下有明显的界面,在界面上宏观性质的改变是飞跃式的。 例如水—冰两相平衡,冰与水之间有明显界面,越过这个截面,物理性质发生突变,冰与水 可以用物理方法分开。 同一种物质的固体颗粒之间尽管有界面,但由于物理性质和化学性质完全相同,仍按一个相 对待。 3.三种相态 气体:不论有多少种气体混合,只有一个气相。 液体:按其互溶程度可以组成一相、两相或三相共存。 固体:一般有一种固体便有一个相。两种固体粉末无论混合得多么均匀,仍是两个相(固体 溶液除外,它是单相)。 4.相平衡:是指在一定条件下一个多相体系内各相 内的物质的种类和数量不随时间 变化的状态 5.自由度(degrees of freedom) 确定平衡体系的状态所必须的独立强度变量的数目称为自由度,用字母 f 表示。这些强 度变量通常是压力、温度和浓度等。 这说明影响体系内相数的因素是强度性质而不是容量性质。例如水常温常压下是液体,与数 量无关,若压力或温度改变则会引起相变。 如果已指定某个强度变量,除该变量以外的其它强度变量数称为条件自由度,用 表示。 例如:指定了压力, 指定了压力和温度, 如水与水蒸气两相平衡:若指定了温度,水蒸气的压力便确定了;或者指定了水蒸气的压力, 温度便确定了,所以水与水蒸气两相平衡体系的自由度 f* =1(温度或压力); 若指定了水蒸气的压力或温度,f*=0 § 5.2 多相系统平衡的一般条件 在一个封闭的多相体系中,相与相之间可以有热的交换、功的传递和物质的交流。对具有 个 相体系的热力学平衡,实际上包含了如下四个平衡条件: (1)热平衡条件:设体系有 个相,达到平衡时,各相具有相同温度 (2)压力平衡条件:达到平衡时各相的压力相等 (3) 相平衡条件: 任一物质 B 在各相中的化学势相等,相变达到平衡 (4) 化学平衡条件:化学变化达到平衡 § 5.3 相律 1、相律(phase rule): , , ,F T T T = = = F p p p = = = F B B B = = = F B B B = 0

是表述平衡体系中相数、独立组分 、自由度数和影响物质性质的外界因素(如温度、压力 电场、磁场、重力场等)之间关系的规律 2.相律的推导 依据:自由度数=总变量数一方程式数 个多相多组分系统中,有S种物质1、2、3.S)分布在中个相(a、B、y.)中。 对于 相 必须知 、x口才能确定其状态 。所以 决定。相状态的变量共有(S+2)个。系统中共有中个相,则整个系统的变量数为 Φ(S+2) 但这些变量不是完全独立的,相互之间有联系 f=中(S+2)平衡时变量间的关系式数 (1)系统处于热力学平衡态,有 热平衡 Ta= (中1) 个等式 力平衡pa=.=p中 (中-1)个等式 相平衡4a1=.=4中1S(中-1)个等式 as=.=中 (2)每个相中有S种物质,2xB=1 xS =/-x1-x2-xs-1 中个浓度关系式。 (3)独立化学平衡数为R,独立浓度关系数为R'。 fS+2)-(-l)-(中-)-1)-中-R-R =S-R-R-Φ+2=C-+2 f=S-R-R-+2 相律是相平衡体系中揭示相数D,独立组分数C和自由度了之间关系的规律。式中2通常 指T,p两个变量。相律最早由Gibbs提出,所以又称为Gibbs相律。如果除T,p外,还受 其它力场影响,则2改用n表示,即: f+F=C+n 例如:盐溶液与纯溶剂达渗透平衡, Φ=2,S=2,=3温度和压力(渗透平衡时有两个压) R=0,R'-=0,C=2 f=C+3=2-2+3=3 3.物种数和独立组分数 (1)物种数 number of substance 一系统中所包含的可以单独分离出来、并能独立存在的化学物质的数目,称为系统的物 种敷”,记作S 如:NaC的水溶液中 Na 和OH.但只能算两种物质,S=2 处于不同相态的同种化学物质,只能算一个物种。如:液态水和水蒸气。 (2)独立组分数 (number ofindependent component
是表述平衡体系中相数、独立组分、自由度数和影响物质性质的外界因素(如温度、压力、 电场、磁场、重力场等)之间关系的规律。 2.相律的推导 依据:自由度数=总变量数-方程式数 设一个多相多组分系统中,有 S 种物质 1、2、3.S)分布在φ个相(α、β、γ.φ)中。 对于其中任意一相α相,必须知道 Tα、pα、xα1、.、xαs,才能确定其状态。所以, 决定α相状态的变量共有(S + 2)个。系统中共有φ个相,则整个系统的变量数为 Φ(S + 2) 但这些变量不是完全独立的,相互之间有联系 f = φ (S + 2)-平衡时变量间的关系式数 (1)系统处于热力学平衡态,有 热平衡 Tα= . = T φ (φ -1) 个等式 力平衡 pα = . = p φ (φ -1) 个等式 相平衡 μα1 = . = μφ 1 S(φ -1) 个等式 ┊ ┊ μαs = . = μφ s (2)每个相中有 S 种物质,ΣxB = 1, xS =1- x1 – x2-xs-1 φ个浓度关系式。 (3)独立化学平衡数为 R,独立浓度关系数为 R'。 f = φ(S + 2) –(φ–1) –(φ–1) –S(φ–1)- φ – R –R' = S – R – R` –φ+ 2 = C –φ + 2 f = S – R – R` –φ+ 2 = C –φ + 2 相律是相平衡体系中揭示相数 ,独立组分数 C 和自由度 f 之间关系的规律。式中 2 通常 指 T,p 两个变量。相律最早由 Gibbs 提出,所以又称为 Gibbs 相律。如果除 T,p 外,还受 其它力场影响,则 2 改用 n 表示,即: 例如:盐溶液与纯溶剂达渗透平衡, =2,S=2,n=3 温度和压力(渗透平衡时有两个压力) R=0,R’=0,C=2 f =C- +3=2-2+3=3 3.物种数和独立组分数 (1)物种数 ( number of substance ) ——系统中所包含的可以单独分离出来、并能独立存在的化学物质的数目,称为系统的“物 种数”,记作 S。 如:NaCl 的水溶液中,有 Na+、Cl-、H+和 OH- 但只能算两种物质,S = 2。 处于不同相态的同种化学物质,只能算一个物种。如:液态水和水蒸气。 (2)独立组分数 (number of independent component ) f C n + = + F

一足以确定平衡体系中的所有各相组成所需要的最少的物质的数目,记作C. S≥C C-S-R-R R是独立化学平衡数, R是独立浓度关系数。 (A)对于独立化学平衡数,要注意独立”两个字。 例如:系统中含有C(s以、C0(g、H20(g、C02(g、H2(g等五种物质,可能存 在的反应有 (1)C(s)+H20(g)=C0(g)+H2(g) (2)C(s)+C02(g)=2C0(g) 个反应 开 不是独立的,反应(3)可以由()和(2)得到,所以真正独立的平 衡数只有R=2. (B)对于浓度关数R”,要注意应限于在同一相中应用。假如分解产物(反应产物)分别 处于不同相中,则不能计算浓度关系数。 例如:CCO3(s) Cao (s)+co2 (g 这个分解反应,产物是固相,C02是气相,所以虽然两者的量之比是1:1, 因而,无浓度限制关系,所以 R=0,S=3,R=1.C=2。 例题 ()、冰水共存 C-1,D=2(冰、水),f=1-2+2=1(T或p) (2、NH4CI(S部分分解为NH3g和HC1(g S-3,R1,R=l,Φ2(NH4C固相、气相) f=3-1-1-2+2=1 (TP、xNH3或xHCI其中之一) (3)1000K下,NH3、H2、N2三气平衡 S=3,R=1(2NH3=3H2+N2),D=1 f=CD+1=2(p、xNH3、xH2或xN2其中之二) 4.相律的几点说明 一般情况下,只考虑温度T和压力p这两个因素时,式中的广2,于是相律为 f=C-Φ+2 若指定了温度或压力则 f*=CΦ+1 ∫*一条件自由度 若温度和压力同时固定,则 f齿*=CΦ
——足以确定平衡体系中的所有各相组成所需要的最少的物质的数目,记作 C。 S≥C C = S – R – R` R 是独立化学平衡数, R'是独立浓度关系数。 (A)对于独立化学平衡数,要注意“独立” 两个字。 例如:系统中含有 C(s)、CO(g)、H2O(g)、CO2(g)、H2(g)等五种物质,可能存 在的反应有 (1) C(s)+H2O(g)=CO(g)+H2(g) (2) C(s)+CO2(g)=2CO(g) (3)CO(g)+H2O(g)=CO2(g)+ H2(g) 但这三个反应并不是独立的,反应(3)可以由(1)和(2)得到,所以真正独立的平 衡数只有 R=2。 (B)对于浓度关数 R’,要注意应限于在同一相中应用。假如分解产物(反应产物)分别 处于不同相中,则不能计算浓度关系数。 例如:CaCO3(s)=CaO(s)+CO2(g) 这个分解反应,产物是固相,CO2 是气相,所以虽然两者的量之比是 1:1, 但 , , 因而,无浓度限制关系, 所以 R’=0,S=3,R=1, C=2。 例题 (1)、冰水共存 C=1, =2 (冰、水), f = 1-2+2=1 (T 或 p) (2)、NH4Cl(s)部分分解为 NH3(g)和 HCl(g) S=3,R=1,R’=1, =2 (NH4Cl 固相、气相) f = 3 – 1 – 1 – 2 + 2 = 1 (T、p、 x NH3 或 xHCl 其中之一) (3) 1000K 下,NH3、H2、N2 三气平衡 S=3,R=1 (2NH3=3H2+N2), =1 f = C- +1=2 (p、xNH3、x H2 或 x N2 其中之二) 4. 相律的几点说明 一般情况下,只考虑温度 T 和压力 p 这两个因素时,式中的 n=2,于是相律为 f =C- +2 若指定了温度或压力,则 f * =C- +1 f *—条件自由度; 若温度和压力同时固定,则 f ** = C-

5.相律的意义 多组分多相系统是十分复杂的,但借助相律可以确定研究的方向。相律表明了相平衡系统 中有几个独立变量,当独立变量选定了之后,相律还表明其他的变量必为这几个独立变量 的函数(但是相律不能告诉我们这些函数的具体形式)。 §5.4单组分体系的相平衡 单组分体系的相数与自由度 C=1,F=C-Φ+2=3-Φ (1)D1时,单相,双变量系统(T、p) (2)D=2时,两相共存,F=1,单变量系统 (T)—克克方程 (3)D-3时,三相共存,F=0,无变量系统 表示某个相状态(如相态、组成、温度等)的点称为相点。 物系点: 相图中表示体系总状态的点称为物系点。在下x图上,物系点可以沿着与温度坐标平 行的垂线上 下移动:在水盐体系图上,随着含水量的变化,物系点可沿着与组成坐标平 移 在单相区,物系点与相点重合:在两相区中,只有物系点,它对应的两个相的组成由对应 的相点表示。 一、单组分体系两相平衡一克拉贝龙方程 若原来在一定条件下建立了两相平衡,如果温度改变T,则燕气压必改变P,在新的条件下 建立新的平衡可表示为 1.克拉佩龙方程 B(a)K¥D→B(B) dG (a)=dG (B) dG(a) dG(B) dG.(a)=-S.(a)dT+V_(a)dp B(a←¥+中→B(B)dG.()=-S.(BaT+K.B dT-△y △2S。=A2Hn/T dT_T△y dp△gSn dp△2H 即克拉佩龙(Clapeyron BP E)方程 2.固液平衡,固固平衡积分式 3液气、固气平衡的蒸气压方程一克劳修斯-克拉佩龙方程 dT TAV
5. 相律的意义 多组分多相系统是十分复杂的,但借助相律可以确定研究的方向。相律表明了相平衡系统 中有几个独立变量,当独立变量选定了之后,相律还表明其他的变量必为这几个独立变量 的函数(但是相律不能告诉我们这些函数的具体形式)。 § 5.4 单组分体系的相平衡 单组分体系的相数与自由度 C = 1,F = C - + 2 = 3 – (1)=1 时,单相,双变量系统(T、p) (2)=2 时,两相共存,F=1,单变量系统 p=f(T)——克-克方程 (3)=3 时,三相共存,F=0,无变量系统 max=3, f max=2,双变量体系的相图可用平面图表示。 相点 : 表示某个相状态(如相态、组成、温度等)的点称为相点。 物系点 : 相图中表示体系总状态的点称为物系点。在 T-x 图上,物系点可以沿着与温度坐标平 行的垂线上、下移动;在水盐体系图上,随着含水量的变化,物系点可沿着与组成坐标平 行的直线左右移动。 在单相区,物系点与相点重合;在两相区中,只有物系点,它对应的两个相的组成由对应 的相点表示。 一、单组分体系两相平衡—克拉贝龙方程 若原来在一定条件下建立了两相平衡,如果温度改变 dT,则蒸气压必改变 dP,在新的条件下 建立新的平衡,可表示为 1. 克拉佩龙方程 即克拉佩龙(Clapeyron B P E)方程 2.固-液平衡,固-固平衡积分式 3.液-气、固-气平衡的蒸气压方程——克劳修斯-克拉佩龙方程 , B( ) B( ) T p ⎯⎯⎯→ 平衡 B( ) B( ) T T p p ⎯⎯⎯⎯⎯→ 平衡 + d , + d d ( ) Gm d ( ) Gm d ( ) d ( ) G G m m = d ( ) ( )d ( )d G S T V p m m m = − + d ( ) ( )d ( )d G S T V p m m m = − + = m m d d T V p S S H T m m = / = m m d d T T V p H = 1 fus m 2 fus m ln d T V p T H = fus m 1 fus m V T T p H = vap m vap m d d p H T T V