
四)质子平衡(质子条件) 酸碱反应的实质是质子转移过程, 当反应达到平衡时,其共轭酸碱对得 到与失去的质子数必然相等,表示这 种数量关系的数学表达式便称为质子 条件式。 质子平衡(Proton Balance Equation,PBE): 溶液中酸失去质子数目等于碱得到质子数目
31 四)质子平衡(质子条件) 质子平衡 (Proton Balance Equation,PBE): 溶液中酸失去质子数目等于碱得到质子数目 酸碱反应的实质是质子转移过程, 当反应达到平衡时,其共轭酸碱对得 到与失去的质子数必然相等,表示这 种数量关系的数学表达式便称为质子 条件式

关于PBE的书写规则 1.零水准法(质子参考水准) 零水准物质的选择 a.溶液中大量存在的 b.参与质子转移反应 质子条件式书写方法 等式左边—得质子后产物 等式右边—失质子后产物 根据质子得失相等原则列出质子条件式 32
32 关于PBE的书写规则 1.零水准法(质子参考水准) ➢ 零水准物质的选择 a.溶液中大量存在的 b.参与质子转移反应 ➢ 质子条件式书写方法 等式左边——得质子后产物 等式右边——失质子后产物 根据质子得失相等原则列出质子条件式

HAc溶液PBE: (1)选择参考物质:选择H2O和HAc作为参考水准 (2)判断哪些物质得质子,哪些物质失质子 (3) 等式左边一得质子后产物 等式右边一失质子后产物 [H]总=[Ac]+[OH] [H]8=[H']Hde+[H]mo Na,S溶液PBE: [OH]点=2[H,S]+[HS]+[H+] 33
33 HAc溶液 PBE : (1)选择参考物质:选择 H2O 和HAc作为参考水准 (2)判断哪些物质得质子,哪些物质失质子 (3)等式左边——得质子后产物 等式右边——失质子后产物 [ H+ ]总= [ Ac- ] + [ OH- ] [ ] 2[ ] [ ] [ ] 2 − − + OH 总 = H S + HS + H Na2S溶液 PBE : H H HAc H H2 O [ ] [ ] [ ] + + + 总 = +

÷NaHCO3溶液 参考物质:HC03,H20 +H" - H2C03← HCO3 C03 +H" - H3O H20 OH 质子条件式: [HC03]+[Ht]=[C032-]+[OH] ①4
34 ❖ NaHCO3溶液 参考物质:HCO3 -,H2O HCO3 - H2 O -H + -H + +H + +H + CO3 2- OH - H2 CO3 H3 O + 质子条件式: [H2CO3]+[H+]=[CO3 2-]+[OH-]
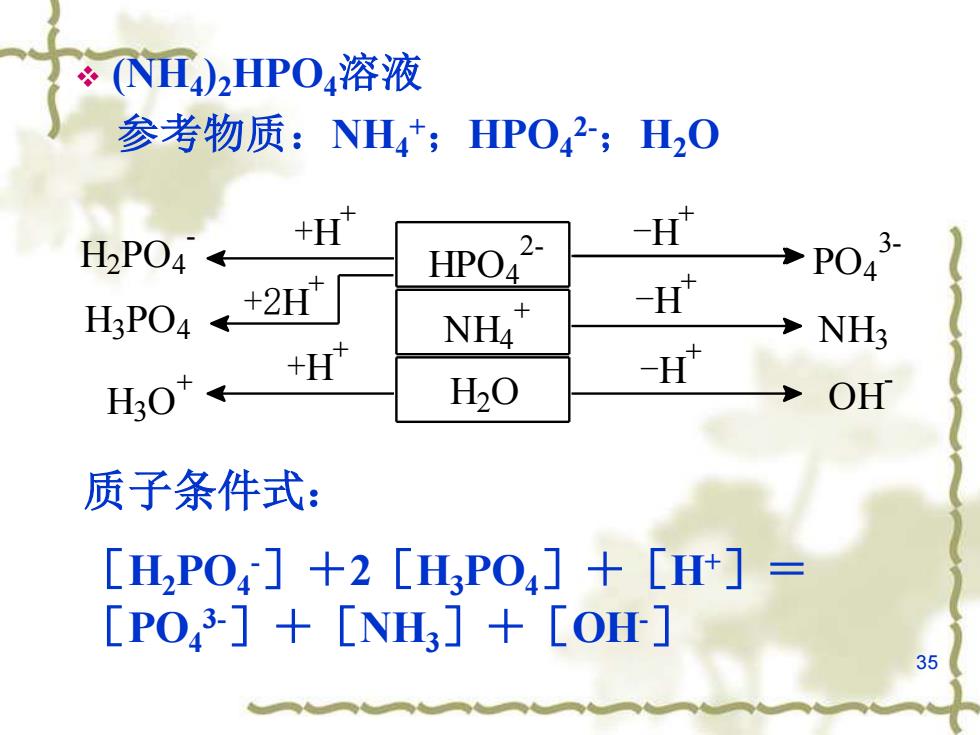
NⅡ)2HPO4溶液 参考物质:NH4+;HPO42;H20 +H" H2P04← 2- H' PO4 - +2H」 HPO H3PO4 NH4 H NH3 +H H20 -H" OH 质子条件式: [H,PO4]+2[HPO4]+[Ht]= [PO,3]+[NH3]+[O] 35
35 ❖ (NH4 )2HPO4溶液 参考物质:NH4 +;HPO4 2-;H2O H2 O -H + -H + +H + +H + OH - H3 O + NH4 + NH3 -H + HPO4 2- PO4 3- H2 PO4 - +2H + H3 PO4 质子条件式: [H2PO4 -]+2[H3PO4]+[H+]= [PO4 3-]+[NH3]+[OH-]