
第五章相平衡 物理化学电子教案 注意几个问题 ① 相律推导中,我们假定在每一相中均含有S 种物质,若某一相中不含某种物质,不影响相律的 形式. ②对浓度限制条件,必须是同一相中存在着某 种关系,才能作为限制条件,不同相不能使用. 如:CaCO3分解反应: CaCO3(s)=CaO(s)+CO2(g) kp=Pco2 组分数:C=3-1=2,为二组分体系 虽Ca0与C02分解的摩尔数相等,但不在同一 相,C02分压与Ca0蒸汽压没有必然联系
① 相律推导中, 我们假定在每一相中均含有S 种物质, 若某一相中不含某种物质, 不影响相律的 形式. ② 对浓度限制条件, 必须是同一相中存在着某 种关系, 才能作为限制条件, 不同相不能使用. 如: CaCO3 分解反应: CaCO3(s) = CaO(s) + CO2(g) 2 p co k p 组分数: C = 3 – 1 = 2, 为二组分体系. 虽CaO与CO2分解的摩尔数相等, 但不在同一 相, CO2分压与CaO 蒸汽压没有必然联系. 注意几个问题
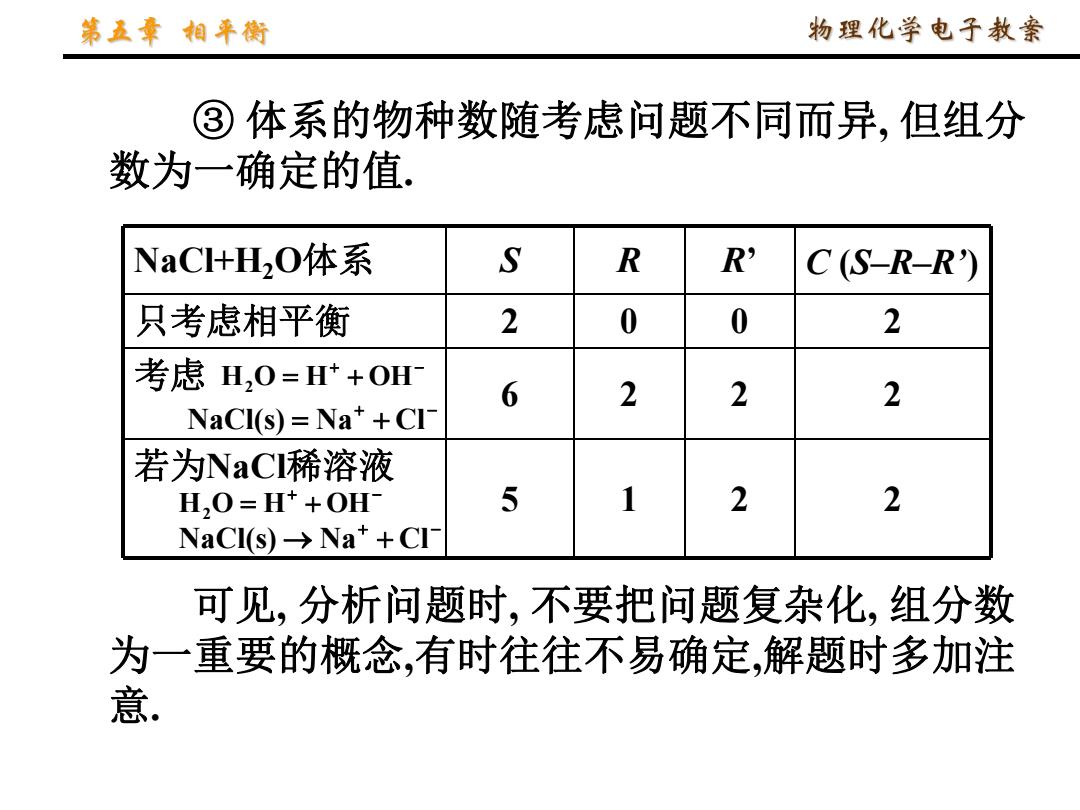
第五章相平衡 物理化学电子教案 ③体系的物种数随考虑问题不同而异,但组分 数为一确定的值, NaC+H2O体系 S R R' C(S-R-R') 只考虑相平衡 2 0 0 2 考虑H,0=H++OH 6 2 2 2 NaCI(s)=Na++CI- 若为NaCI稀溶液 H,O=H*+OH- 5 1 2 2 NaCl(s)→Na++CI 可见,分析问题时,不要把问题复杂化,组分数 为一重要的概念,有时往往不易确定,解题时多加注 意
③ 体系的物种数随考虑问题不同而异, 但组分 数为一确定的值. NaCl+H2O体系 S R R’ C (S–R–R’) 只考虑相平衡 2 0 0 2 考虑 6 2 2 2 若为NaCl稀溶液 5 1 2 2 H2O H OH NaCl(s) Na Cl H2O H OH NaCl(s) Na Cl 可见, 分析问题时, 不要把问题复杂化, 组分数 为一重要的概念,有时往往不易确定,解题时多加注 意

第五章相平衡 物理化学电子教案 相律公式的应用 指导平衡系统的研究和分析相图 ①确定系统的自由度数目. ②确定给定系统允许存在的最大相数目. 例题碳酸钠与水可组成下列几种化合物: Na2C03H20(s)Na2C037H20(s)Na2C0310H20(s) (1)清说明在标准压力下,与碳酸钠水溶液和 冰共存的含水盐最多可以有几种? (2)请说明在30℃时,可与水蒸气平衡共存的 含水盐最多可有几种?
② 确定给定系统允许存在的最大相数目. ① 确定系统的自由度数目. 指导平衡系统的研究和分析相图 例题 碳酸钠与水可组成下列几种化合物: Na2CO3·H2O(s) Na2CO3·7H2O(s) Na2CO3·10H2O(s) (1)请说明在标准压力下, 与碳酸钠水溶液和 冰共存的含水盐最多可以有几种? (2)请说明在30℃时, 可与水蒸气平衡共存的 含水盐最多可有几种? 相律公式的应用

第五章相平衡 物理化学电子教案 解:体系物种数:S=5,化学平衡数:R=3, 独立组分数:C=S-R=5-3=2(Na2C03和H2O) ()指定压力下,相律为 f*=CΦ+1=2Φ+1=3Φ 相数最多为Φ=3(f=0),因此,与Na2C03水 溶液及冰共存的含水盐最多只能有一种. (2)指定30℃时,相律为 f÷=CΦ+1=2Φ+1=3Φ 相数最多也为3.因此,与水蒸气共存的含水 盐最多可有2种
解: 体系物种数: S = 5, 化学平衡数: R = 3, 独立组分数: C = S – R = 5 – 3 = 2(Na2CO3和H2O). (1) 指定压力下, 相律为 f * = C -Φ + 1 = 2 -Φ + 1 = 3-Φ 相数最多为Φ = 3 (f = 0), 因此, 与 Na2CO3水 溶液及冰共存的含水盐最多只能有一种. (2) 指定30℃时, 相律为 相数最多也为 3. 因此, 与水蒸气共存的含水 盐最多可有 2 种. f * = C -Φ + 1 = 2 -Φ + 1 = 3-Φ

第五章相平衡 物理化学电子教案 §5.4 单组分系统的相平衡 本节主要讨论单组分多相系统状态变化时所遵 循的规律. 1.相变特征 相平衡判据 此式意义:表示在恒温、恒压下组分B将自动 从高化学势相转移到低化学势相,直到组分B在两相 的化学势相等达平衡为止
本节主要讨论单组分多相系统状态变化时所遵 循的规律. 1. 相变特征 相平衡判据 B B 此式意义:表示在恒温、恒压下组分B 将自动 从高化学势相转移到低化学势相,直到组分B在两相 的化学势相等达平衡为止. §5.4 单组分系统的相平衡