
(4)间接滴定法 Ca2++H2C204=CaC204↓+2H+ (待测) CaC2O+2H+Ca2+H2C2O 5C2042-+4Ht+2Mn04=2Mn2++10C02+2H20 (标准滴定液)
(4)间接滴定法 Ca2+ + H2C2O4 = CaC2O4 ↓ + 2 H+ (待测) CaC2O4 + 2 H+ = Ca2+ + H2C2O4 5 C2O4 2- + 4 H+ + 2 MnO4- = 2 Mn2+ + 10 CO2 + 2 H2O (标准滴定液)
0.1000mol.L1 4、滴定曲线和滴定突跃 NaOH滴定液 NaOH HCI NaCl H,O NaOH HCI 0.1000mol.L-1 HCI溶液
4、滴定曲线和滴定突跃 NaOH HCl NaOH + HCl = NaCl + H2O 0.1000mol.L–1 NaOH 滴定液 0.1000mol.L–1 HCl 溶液
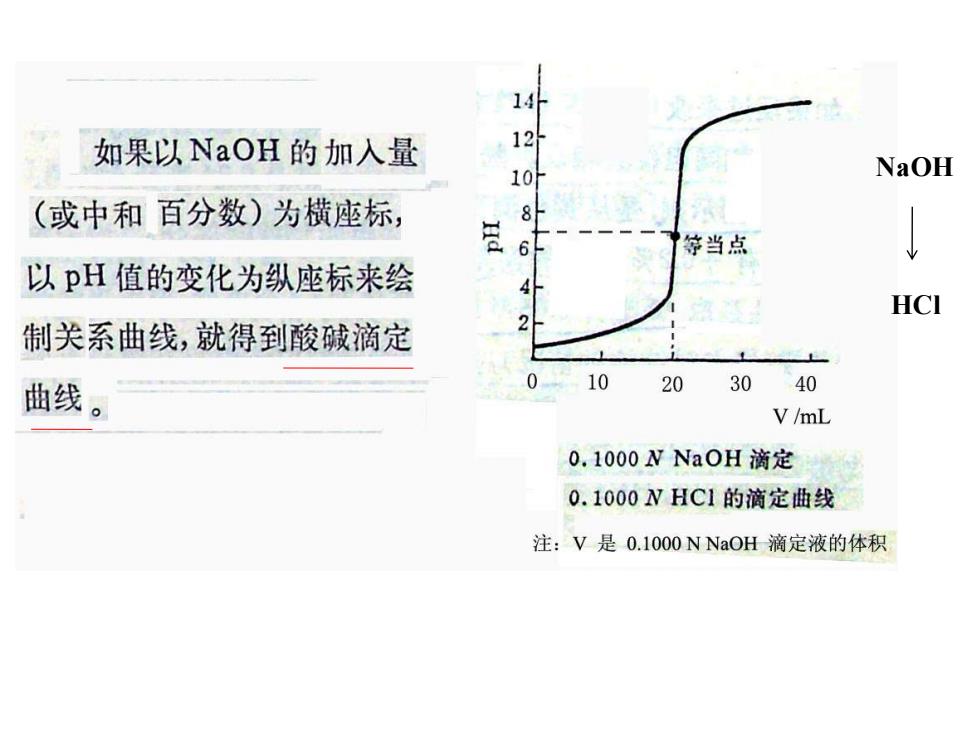
14 如果以NaOH的加入量 12 1 NaOH (或中和百分数)为横座标, 8 6 等当点 以pH值的变化为纵座标来绘 HC 制关系曲线,就得到酸碱滴定 曲线。 0 10 20 30 40 V/mL 0.1000 N NaOH滴定 0.1000NHC1的滴定曲线 注:V是0.1000 N NaOH滴定液的体积
NaOH HCl

从滴定开始到加入19.80 毫升NaOH溶液,溶液的pH 14 12 值只改变2.3个单位。再滴人 10H 0.18毫升(共滴入19.98毫升) 突跃 营6 停当点 NaOH溶液,pH就改变一个 单位,变化速度加快了。再滴 人0.02毫升(约半滴,共滴人 0 10 20 3040 V/mL 20.00毫升),正好是滴定的等当 点,此时pH值迅速达到7.0。再滴入0.02毫升(共滴人20.02毫升), pH值迅速增至9.7。此后过量NaOH溶液所引起的pH值的变化又 愈来愈小。由此可见,在等当点前后,从剩余0.02毫升HC1到过量 0.02毫升NaOH,即Na0H从不足0.02毫升到过量0.02毫升,总共 不过是0.04毫升(约一滴),但溶液的pH值却从4.31增加到9.70, 变化近5,4个单位,形成滴定曲线中的“突跃”部分
突跃

二、误差基本知识 1、误差的分类 (1)绝对误差和相对误差 a、绝对误差: 6=x-4 测定次数 b、相对误差: 6_X-4x100% (2)系统误差和偶然误差 0 误差 误差的正态分布曲线
二、误差基本知识 1、误差的分类 (1)绝对误差和相对误差 = x − (2)系统误差和偶然误差 100% − = x a、绝对误差: b、相对误差: