
进行,如:高温下的水煤气反应:C(S十H2O(g)=CO(g十H(g)的热效应是131.3千焦每摩尔, 也能自发进行,说明热力学第一定律不能判断变化的方向和限度间题,而方向和限度问题; 是在一定条件下,哪些方向的变化可以进行,哪些方向的变化不能进行和进行到什么程度 为至,以及怎样改变条件使反应朝人们所希望的方向进行。 那么究竞什么因素在决定着这些自发过程的方向和限度呢? 从表面上看,似乎各类不同的过程有着不同的决定因素,例如决定热的传导方向和限 度的是温度,决定气体流动的方向和限度的是压力,决定电流的是电势,等等,那么决定 化学反应的方向和限度的因素是什么呢?这有待于找出迭定一切自动变化方向和限度的 共同因素,这个共同因素既能判断上述自发过程的方向和限度,自然也能判断化学反应过 程的方向和限度,这个共同因素就是第二定律要解迭的问题。 §3.1自发变化的共同特征不可逆性 自发过程(自发变化) 南大物化(第五版)的定义(p135):所谓“自发变化”乃指能够自动发生的变化,而 无需外力帮助,任其自然,不去管它而可发生的变化。 Gibs定义:凡是在理论上或实际上能够提供非体积功(体系环境)的过程是自发的。 由环境提供非体积功去使过程发生的则为非自发的。 为了寻找决定一切热力学过程的自发方向及限度的共同因素,首先要弄清楚所有的自 发过程具有什么共同特征。 (一)一切自发过程都具有确定的方向和限度 【例1】气体的真空膨胀:气体总是自发地由压力高的地方流向压力底的地方,直到 体系各处压力均一,就达到了限度: 【例2】高温物体到低温物体的热传递:热总是从高温物体传向低温物体直到温度相 同: 【例3】浓溶液的扩散:溶质总是从高浓度扩散到底浓度,直到浓度相同。 我们周围的自然界所发生的过程都是自发进行的 ·水流高处→低处 h(判据) 功→热 ·电流高压→低压 E 功→热 ·热流热处→冷处 T 高温→低温 ·风流高压→低压 0 功→热 ·人类小孩→老人 不可逆 -6-
- 6 - 进行,如:高温下的水煤气反应:C(S)+H2O(g)=CO(g)+H2(g)的热效应是 131.3 千焦每摩尔, 也能自发进行,说明热力学第一定律不能判断变化的方向和限度问题,而方向和限度问题, 是在一定条件下,哪些方向的变化可以进行,哪些方向的变化不能进行和进行到什么程度 为至,以及怎样改变条件使反应朝人们所希望的方向进行。 那么究竟什么因素在决定着这些自发过程的方向和限度呢? 从表面上看,似乎各类不同的过程有着不同的决定因素,例如决定热的传导方向和限 度的是温度,决定气体流动的方向和限度的是压力,决定电流的是电势,等等,那么决定 化学反应的方向和限度的因素是什么呢?这有待于找出决定一切自动变化方向和限度的 共同因素,这个共同因素既能判断上述自发过程的方向和限度,自然也能判断化学反应过 程的方向和限度,这个共同因素就是第二定律要解决的问题。 §3.1 自发变化的共同特征——不可逆性 自发过程(自发变化) 南大物化(第五版)的定义(p135):所谓“自发变化”乃指能够自动发生的变化,而 无需外力帮助,任其自然,不去管它而可发生的变化。 Gibbs 定义:凡是在理论上或实际上能够提供非体积功(体系环境)的过程是自发的。 由环境提供非体积功去使过程发生的则为非自发的。 为了寻找决定一切热力学过程的自发方向及限度的共同因素,首先要弄清楚所有的自 发过程具有什么共同特征。 (一) 一切自发过程都具有确定的方向和限度 【例 1】气体的真空膨胀;气体总是自发地由压力高的地方流向压力底的地方,直到 体系各处压力均一,就达到了限度; 【例 2】高温物体到低温物体的热传递;热总是从高温物体传向低温物体直到温度相 同; 【例 3】浓溶液的扩散:溶质总是从高浓度扩散到底浓度,直到浓度相同。 我们周围的自然界所发生的过程都是自发进行的 • 水流 高处 → 低处 h(判据) 功 → 热 • 电流 高压 → 低压 E 功 → 热 • 热流 热处 → 冷处 T 高温 → 低温 • 风流 高压 → 低压 p 功 → 热 • 人类 小孩 → 老人 t 不可逆
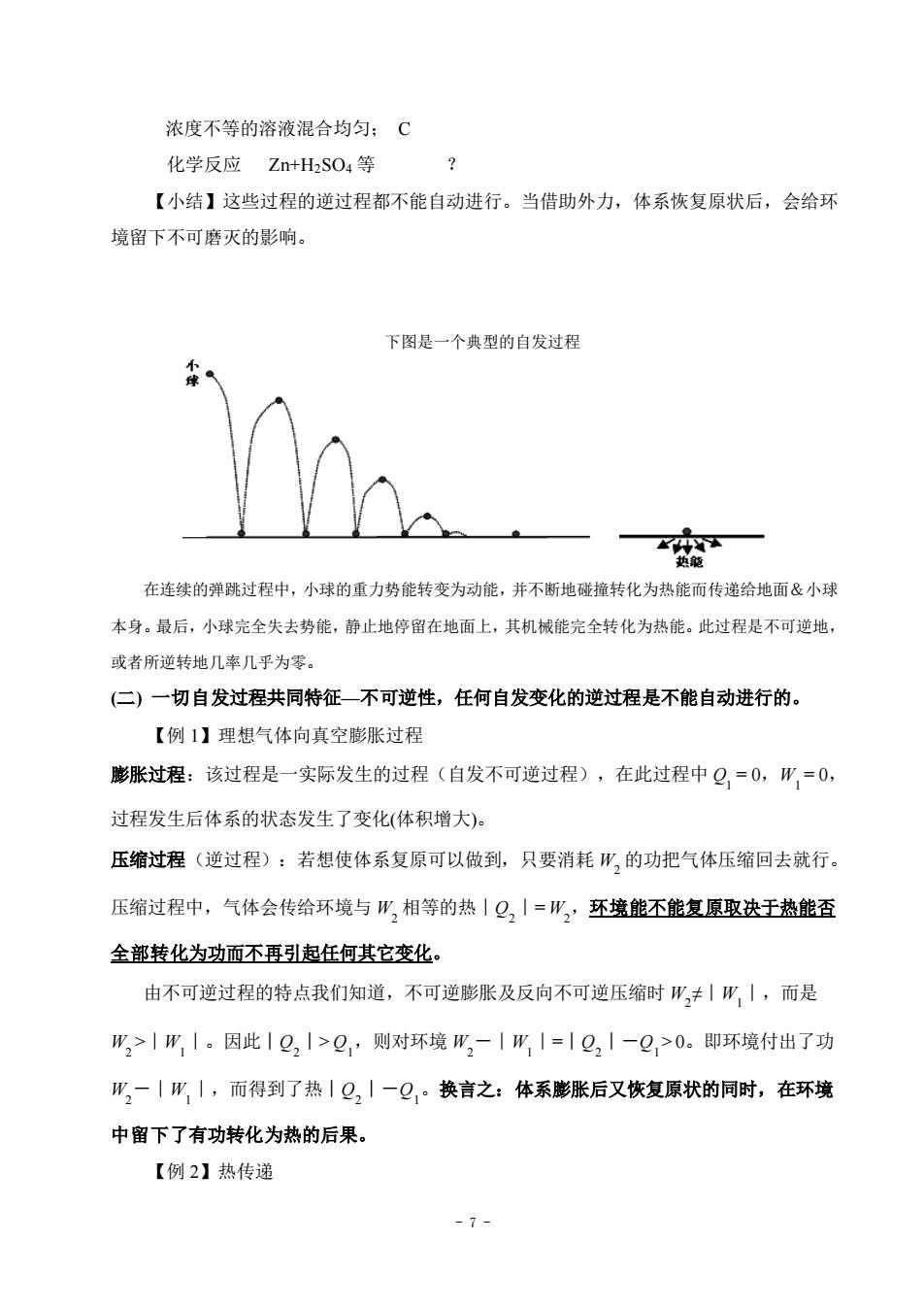
浓度不等的溶液混合均匀:C 化学反应 Zn+H2SO4等 【小结】这些过程的逆过程都不能自动进行。当借助外力,体系恢复原状后,会给环 境留下不可磨灭的影响。 下图是一个典型的自发过程 在连续的弹跳过程中,小球的重力势能转变为动能,并不断地碰撞转化为热能而传递给地面&小球 本身。最后,小球完全失去势能,静止地停留在地面上,其机械能完全转化为热能。此过程是不可逆地, 或者所逆转地几率几乎为零。 (二)一切自发过程共同特征一不可逆性,任何自发变化的逆过程是不能自动进行的。 【例1】理想气体向真空膨胀过程 膨胀过程:该过程是一实际发生的过程(自发不可逆过程),在此过程中Q=0,W=0, 过程发生后体系的状态发生了变化(体积增大)。 压缩过程(逆过程):若想使体系复原可以做到,只要消耗W,的功把气体压缩回去就行。 压缩过程中,气体会传给环境与W,相等的热|Q,丨=W,环境能不能复原取进于热能否 全部转化为功而不再引起任何其它变化 由不可逆过程的特点我们知道,不可逆膨胀及反向不可逆压缩时W,≠|W,丨,而是 W2>|W|。因此|Q2|>Q,则对环境W,-|W|=|Q,1-Q,>0。即环境付出了功 W一|W1,而得到了热|Q,|一Q,。换言之:体系膨胀后又恢复原状的同时,在环境 中留下了有功转化为热的后果。 【例2】热传递 -7-
- 7 - 浓度不等的溶液混合均匀; C 化学反应 Zn+H2SO4 等 ? 【小结】这些过程的逆过程都不能自动进行。当借助外力,体系恢复原状后,会给环 境留下不可磨灭的影响。 下图是一个典型的自发过程 在连续的弹跳过程中,小球的重力势能转变为动能,并不断地碰撞转化为热能而传递给地面&小球 本身。最后,小球完全失去势能,静止地停留在地面上,其机械能完全转化为热能。此过程是不可逆地, 或者所逆转地几率几乎为零。 (二) 一切自发过程共同特征—不可逆性,任何自发变化的逆过程是不能自动进行的。 【例 1】理想气体向真空膨胀过程 膨胀过程:该过程是一实际发生的过程(自发不可逆过程),在此过程中 Q1 = 0,W1 = 0, 过程发生后体系的状态发生了变化(体积增大)。 压缩过程(逆过程):若想使体系复原可以做到,只要消耗 W2 的功把气体压缩回去就行。 压缩过程中,气体会传给环境与 W2 相等的热∣Q2∣= W2,环境能不能复原取决于热能否 全部转化为功而不再引起任何其它变化。 由不可逆过程的特点我们知道,不可逆膨胀及反向不可逆压缩时 W2 ≠∣W1∣,而是 W2 >∣W1∣。因此︱Q2︱> Q1,则对环境 W2-∣W1∣=︱Q2︱-Q1 > 0。即环境付出了功 W2-∣W1∣,而得到了热︱Q2︱-Q1。换言之:体系膨胀后又恢复原状的同时,在环境 中留下了有功转化为热的后果。 【例 2】热传递

两个不同的物体接触,热量自高温物体传到低温物体,使二物体温度均匀,这是一 实际过程。此过程发生时,二物体与环境并无能量交换。要使二物体再恢复温差,只要消 耗外功、开放致冷机就可以迫使热量反向流动恢复二物体温差。但体系复原的同时,环境 消耗了其他电功而换得了等当量的热,因此,传热的实际过程发生后,环境中也留下了功 转化为热的变化。 【例3】电解水 298.15K,101.325kPa:H,(8)+20,(8)→H,00 反应:反应生成1molH,O),则W,=270.9k,Q,=-11.2kJ。 逆反应:要使反应逆转很容易,因H,和O,可以自发生成H,O0),生成1molH,O) 过程中,体积功W,=3.7k,Q,=-285.8k,看出电解水的过程发生后,体系也可恢复原。 但环境付出了W-W,=274.6kJ的功,得到|Q,|-Q,=274.6kJ的热,在环境下也留下了 功变为热的变化 从以上例子看出:一个实际问题发生之后,在使体系恢复原状的同时,一定会在体系 中留下功转化为热的后果 回忆一下前一章所讨论的可逆过程与不可逆过程的定义,将实际过程与之比较就可以 得出一个结论:一切实际过程都是热力学不可逆过程,都具有不可逆性。另外从上面三个 例子中看出,一、二和三不同,前者不依靠外力即不需要消耗环境功,而后者消耗电功。 热力学中的自发过程一在一定条件下不依靠外力(即不需要环境消耗功)就能自动发 过程,如例1、例2情况。 热力学中的非自发过程—消耗外功才能进行的实际过程,如例3过程。 可以看出自发过程、非自发过程都是实际进行的过程,也是不可逆过程,而实际过程 (不可逆过程)不一定都是自发过程。 【小结】所有的自发过程是否能成为热力学可逆过程,最终可归结为:热能香全部转 化为功而不引起任何其他变化的问题,或说能否从单一热源吸热全部转化为功,而不引起 其他变化的问题。 经验证明“热功转化是有方向性的,只有功可以自发的全部转化为热,而热不可能全 部转化变为功而不引起其他任何变化”,所以可以得出结论一“一切自发过程都是不可逆
- 8 - 两个不同的物体接触,热量自高温物体传到低温物体,使二物体温度均匀,这是一 实际过程。此过程发生时,二物体与环境并无能量交换。要使二物体再恢复温差,只要消 耗外功、开放致冷机就可以迫使热量反向流动恢复二物体温差。但体系复原的同时,环境 消耗了其他电功而换得了等当量的热,因此,传热的实际过程发生后,环境中也留下了功 转化为热的变化。 【例 3】电解水 298.15 K,101.325 kPa: 2 2 2 1 ( ) ( ) ( ) 2 H g O g H O l + → 反应:反应生成 1mol 2 H O l( ) ,则 W1 = 270.9 kJ,Q1 = -11.2 kJ。 逆反应:要使反应逆转很容易,因 H2和 O2可以自发生成 H2 O(l),生成 1 mol H2 O(l) 过程中,体积功 W2 = 3.7 kJ,Q2 = −285.8 kJ,看出电解水的过程发生后,体系也可恢复原。 但环境付出了 W1 −W2 = 274.6 kJ 的功,得到︱Q2︱−Q1 = 274.6 kJ 的热,在环境下也留下了 功变为热的变化。 从以上例子看出:一个实际问题发生之后,在使体系恢复原状的同时,一定会在体系 中留下功转化为热的后果。 回忆一下前一章所讨论的可逆过程与不可逆过程的定义,将实际过程与之比较就可以 得出一个结论:一切实际过程都是热力学不可逆过程,都具有不可逆性。另外从上面三个 例子中看出,一、二和三不同,前者不依靠外力即不需要消耗环境功,而后者消耗电功。 热力学中的自发过程——在一定条件下不依靠外力(即不需要环境消耗功)就能自动发 过程,如例1、例2情况。 热力学中的非自发过程——消耗外功才能进行的实际过程,如例3过程。 可以看出自发过程、非自发过程都是实际进行的过程,也是不可逆过程,而实际过程 (不可逆过程)不一定都是自发过程。 【小结】所有的自发过程是否能成为热力学可逆过程,最终可归结为:热能否全部转 化为功而不引起任何其他变化的问题,或说能否从单一热源吸热全部转化为功,而不引起 其他变化的问题。 经验证明 “热功转化是有方向性的,只有功可以自发的全部转化为热,而热不可能全 部转化变为功而不引起其他任何变化”,所以可以得出结论——“一切自发过程都是不可逆

的”或者说任何体系都是自发地倾向平衡的与自发过程方向相反的过程都不能自发进行若 要进行必须借助外力一这就是自发过程的共同特征,也是热力学第二定律的基础: 但是单凭经验来判断过程能否自发进行是不够的有时不易作出判断必须把经验上升 的理论热力学第二定律就是判断自发过程方向和限度的理论。 S3.2热力学第二定律 (The Second Law ofThermodynamics) 在热力学的研究史上,人们是从研究热功转换的不可逆性入手的,即热机工作的不可 逆性入手的。人们从失败中终结出:要想把热全部转化为功而不留下任何其它后果是不可 能的。法国工程师卡诺(Cot)总结出:热机工作时必须有温度不同的至少两个热源。从高 温热源汲取的热,只有一部分变为功,而其余部分的热传给低温热源,想要不损失这部分 热量,热机就不能周而复始循环不己地工作了,因此也就不成其热机了。想利用大海作热 源的热机设计者,终因早不到能和大海同时同地现成存在的低温热源,而使所有的设计者 均以失败而告终。大海存储的热能虽多,但人们只能望洋兴叹”不能利用。人们从大量的 实验经验中终结出了一条规律,它是宏观世界中的一条自然法则,它不能从别的什么原理 中推引出来。 一、热力学第二定律的两种最常用的表述 克劳修斯表述法(1850年):不能把热从低温物体传到高温而不产生任何其它影响。 开尔文表述法(1851年):不可能从单一热源吸收热量而使之完全转化为功,而不引起其 它变化。 开尔文表述法后来被奥斯特瓦德(Ostward)表达为:第二类永动机是不可能造成的。 第二类永动机:就是一种能从单一热源吸收热量,并将所吸收的热全转化为功而无其 它影响的机器。虽不违反能量守恒定律,但永远不可能造成。他们是结合解决具体的Carnot 热机的问题提出来的。 【例如】从海水中吸取热量完全变为功以开动船只等,那么航海和航天就不需要带燃 料了,只带一个第二类永动机就够了,但都以失败告终,说明第二 类永动机是不存在的。 热机 -9- T
- 9 - 的”或者说任何体系都是自发地倾向平衡的与自发过程方向相反的过程都不能自发进行若 要进行必须借助外力——这就是自发过程的共同特征,也是热力学第二定律的基础。 但是单凭经验来判断过程能否自发进行是不够的有时不易作出判断必须把经验上升 的理论热力学第二定律就是判断自发过程方向和限度的理论。 §3.2 热力学第二定律 (The Second Law of Thermodynamics) 在热力学的研究史上,人们是从研究热功转换的不可逆性入手的,即热机工作的不可 逆性入手的。人们从失败中终结出:要想把热全部转化为功而不留下任何其它后果是不可 能的。法国工程师卡诺(Carnot)总结出:热机工作时必须有温度不同的至少两个热源。从高 温热源汲取的热,只有一部分变为功,而其余部分的热传给低温热源,想要不损失这部分 热量,热机就不能周而复始循环不已地工作了,因此也就不成其热机了。想利用大海作热 源的热机设计者,终因早不到能和大海同时同地现成存在的低温热源,而使所有的设计者 均以失败而告终。大海存储的热能虽多,但人们只能“望洋兴叹”不能利用。人们从大量的 实验经验中终结出了一条规律,它是宏观世界中的一条自然法则,它不能从别的什么原理 中推引出来。 一、热力学第二定律的两种最常用的表述 克劳修斯表述法(1850年):不能把热从低温物体传到高温而不产生任何其它影响。 开尔文表述法(1851年):不可能从单一热源吸收热量而使之完全转化为功,而不引起其 它变化。 开尔文表述法后来被奥斯特瓦德(Ostward)表达为:第二类永动机是不可能造成的。 第二类永动机:就是一种能从单一热源吸收热量,并将所吸收的热全转化为功而无其 它影响的机器。虽不违反能量守恒定律,但永远不可能造成。他们是结合解决具体的Carnot 热机的问题提出来的。 【例如】从海水中吸取热量完全变为功以开动船只等,那么航海和航天就不需要带燃 料了,只带一个第二类永动机就够了,但都以失败告终,说明第二 类永动机是不存在的。 T1 T2 Q2 Q1 Q1 热机 W

进一步理解: 1.克劳修斯表述是指热传导的不可逆性,开尔文表述是指摩擦生热过程的不可逆性, 这两种说法实际上完全等效的,证明如下(用反证法证明) 证明:若克氏说法不成立,则开氏说法也不成立 用热力学第二定律证明,采用反证法: 假定克氏说法不成立,则热可以自动地从低温热源传至高温热源,可设计图中装置 ,一热机在高温热源(T2)和低温热源(T)间工作 ·热机从高温热源吸收Q2的热量,其中一部分转变为功W,剩余的热量Q1转递给低温 热源」 ·若克氏说法不成立,可将Q1的热量自动地从低温热源传至高温热源而不引起其它变 化, 将以上两步骤联合起来,则可构成一个循环,其总结果是:热机从高温热源取出Q2 -Q的热量,并将其完全转化为功W,并不引起其它任何变化.于是开氏说法也成立 但这便做成了第二类永动机,这是违反热力学第二定律的,故假定克氏说法不成立是 错误的 2.对开氏说法不能误解为:热不能全部变为功。应注意条件,应是在不引起其它变化 的条件下,热不能完全转化为功。 【例如】理想气体等温膨胀时,△U=0,O=一W,即把从单一热源吸收的热全部变 成了功,但体系的体积变大,压力变小,状态发生了变化。 3.热力学第二定律是人类经验的总结,意思是:功可以全部转化为热而不引起其它任 何其它变化。开氏的说法断定了热和功不是完全等价的,功可以无条件的100%转化为热, 而热则不能无条件的100%的转化为边。说明热和功之间是不可逆的、有方向性的。一切 实际过程都具有不可逆性,而且他们的不可逆性都可归结为热功转换过程的不可逆性。因 此,他们的方向性都可用热功转化过程的不可逆性来表述。 根据判据的共同准则:像热力学第一定律找出U、H热力学函数,由其改变量△U、△H 就可知道过程的能量变化一样。热力学第二定律中也找出了热力学函数,由其改变量判断 过程的方向和限度,要找这样的热力学函数还得从热功转化的关系中找。这就是下面要讲 的主要问题。 §3.3卡诺循环与卡诺定理 -10-
- 10 - 进一步理解: 1. 克劳修斯表述是指热传导的不可逆性,开尔文表述是指摩擦生热过程的不可逆性, 这两种说法实际上完全等效的,证明如下(用反证法证明) 证 明: 若克氏说法不成立,则开氏说法也不成立. 用热力学第二定律证明, 采用反证法: 假定克氏说法不成立, 则 热可以自动地从低温热源传至高温热源, 可设计图中装置. • 一热机在高温热源(T2)和低温热源(T1)间工作. • 热机从高温热源吸收 Q2 的热量, 其中一部分转变为功 W, 剩余的热量 Q1 转递给低温 热源. • 若克氏说法不成立, 可将 Q1 的热量自动地从低温热源传至高温热源而不引起其它变 化. 将以上两步骤联合起来, 则可构成一个循环, 其总结果是: 热机从高温热源取出|Q2| ﹣|Q1|的热量, 并将其完全转化为功 W, 并不引起其它任何变化. 于是开氏说法也成立. 但这便做成了第二类永动机, 这是违反热力学第二定律的, 故假定克氏说法不成立是 错误的. 2. 对开氏说法不能误解为:热不能全部变为功。应注意条件,应是在不引起其它变化 的条件下,热不能完全转化为功。 【例如】 理想气体等温膨胀时,ΔU = 0,Q = −W,即把从单一热源吸收的热全部变 成了功,但体系的体积变大,压力变小,状态发生了变化。 3. 热力学第二定律是人类经验的总结,意思是:功可以全部转化为热而不引起其它任 何其它变化。开氏的说法断定了热和功不是完全等价的,功可以无条件的 100﹪转化为热, 而热则不能无条件的 100﹪的转化为功。说明热和功之间是不可逆的、有方向性的。一切 实际过程都具有不可逆性,而且他们的不可逆性都可归结为热功转换过程的不可逆性。因 此,他们的方向性都可用热功转化过程的不可逆性来表述。 根据判据的共同准则:像热力学第一定律找出 U、H 热力学函数,由其改变量 ΔU、ΔH 就可知道过程的能量变化一样。热力学第二定律中也找出了热力学函数,由其改变量判断 过程的方向和限度,要找这样的热力学函数还得从热功转化的关系中找。这就是下面要讲 的主要问题。 §3.3 卡诺循环与卡诺定理