
第三章 一、滴定曲线的计算及绘制 滴定分析法 二、影响滴定曲线突跃范围 的因素 三、滴定终点的确定方法 第三节 四、终点误差与直接滴定的 滴定分析原理 条件 下页 2024/9/13 帽助 越回
2024/9/13 第三章 滴定分析法 第三节 滴定分析原理 一、滴定曲线的计算及绘制 二、影响滴定曲线突跃范围 的因素 三、滴定终点的确定方法 四、终点误差与直接滴定的 条件
滴定曲线的计算及绘制 滴定曲线的作用: (①)确定滴定终点时,消耗的滴定剂体积; (2)判断滴定突跃大小; (③)确定滴定终点与化学计量点之差。(动画) (4)选择指示剂; 滴定曲线的计算。 上页 下页 返回
一、滴定曲线的计算及绘制 滴定曲线的作用: (1) 确定滴定终点时,消耗的滴定剂体积; (2) 判断滴定突跃大小; (3) 确定滴定终点与化学计量点之差。 (4) 选择指示剂; 滴定曲线的计算。 (动画)
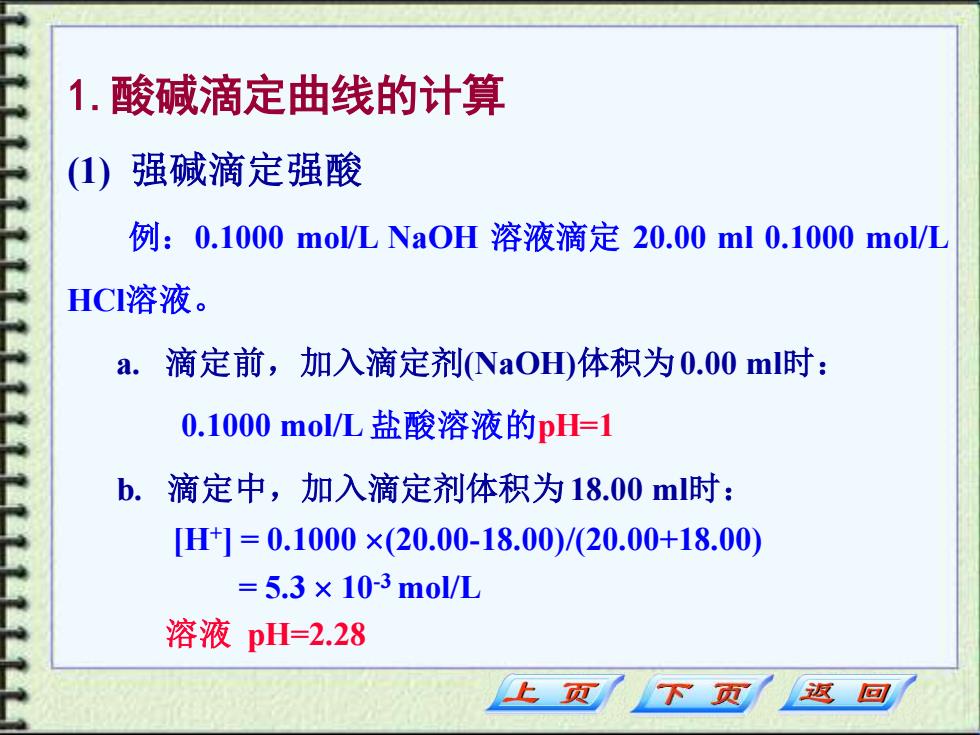
1.酸碱滴定曲线的计算 (1) 强碱滴定强酸 例:0.1000mo/LNa0H溶液滴定20.00ml0.1000mo/L HCl溶液。 a.滴定前,加入滴定剂NaO体积为0.00ml时: 0.1000mol/L盐酸溶液的pH=1 b. 滴定中,加入滴定剂体积为18.00ml时: H1=0.1000×(20.00-18.00)/(20.00+18.00) =5.3×10-3mol/L 溶液pH=2.28 上页 下页 返回
1.酸碱滴定曲线的计算 (1) 强碱滴定强酸 例:0.1000 mol/L NaOH 溶液滴定 20.00 ml 0.1000 mol/L HCl溶液。 a. 滴定前,加入滴定剂(NaOH)体积为0.00 ml时: 0.1000 mol/L 盐酸溶液的pH=1 b. 滴定中,加入滴定剂体积为18.00 ml时: [H+ ] = 0.1000 (20.00-18.00)/(20.00+18.00) = 5.3 10-3 mol/L 溶液 pH=2.28

强碱滴定强酸滴定曲线的计算过程 加入滴定剂体积为19.98ml时: (离化学计量点差约半滴) H]=c×Hc/W =0.1000×(20.00-19.98)/(20.00+19.98) =5.0×10-5mol/L 溶液pH=4.3 c.化学计量点,即加入滴定剂体积为20.00mL 反应完全, [H+]=10-7 mol/L, 溶液pH=7 上页 下页 返回
强碱滴定强酸滴定曲线的计算过程 加入滴定剂体积为19.98 ml时: (离化学计量点差约半滴) [H+ ] = c VHCl/V = 0.1000 (20.00 - 19.98) / (20.00+19.98) = 5.0 10-5 mol/L 溶液pH=4.3 c. 化学计量点,即加入滴定剂体积为 20.00mL 反应完全, [H+ ] = 10-7 mol/L , 溶液 pH=7

强碱滴定强酸滴定曲线的计算过程 d.化学计量点后 加入滴定剂体积为20.02,过量0.02mL(约半滴) [OH]=nNaOH /V =(0.1000×0.02)/(20.00+20.02) =5.0×105m0l/L p0H=4.3, pH=14-4.3=9.7 滴加体积:0一19.98mL;△pH=3.4 滴加体积:19.98一20.02mL;△pH=5.4滴定突跃 上页 下页 返回
强碱滴定强酸滴定曲线的计算过程 d. 化学计量点后 加入滴定剂体积为20.02 ,过量0.02 mL(约半滴) [OH- ] = nNaOH / V = ( 0.1000 0.02 ) / ( 20.00+20.02 ) = 5.0 10-5 mol / L pOH = 4.3 , pH = 14-4.3 = 9.7 滴加体积:0—19.98 mL; pH=3.4 滴加体积:19.98—20.02 mL; pH=5.4 滴定突跃