
第四章 一、直接电位法 电化学分析法 二、电位滴定分析法 第三节 三、电位分析法的应用 电位分析方法 与计算示例 下页 帽动 越回
第四章 电化学分析法 第三节 电位分析方法 一、直接电位法 二、电位滴定分析法 三、电位分析法的应用 与计算示例
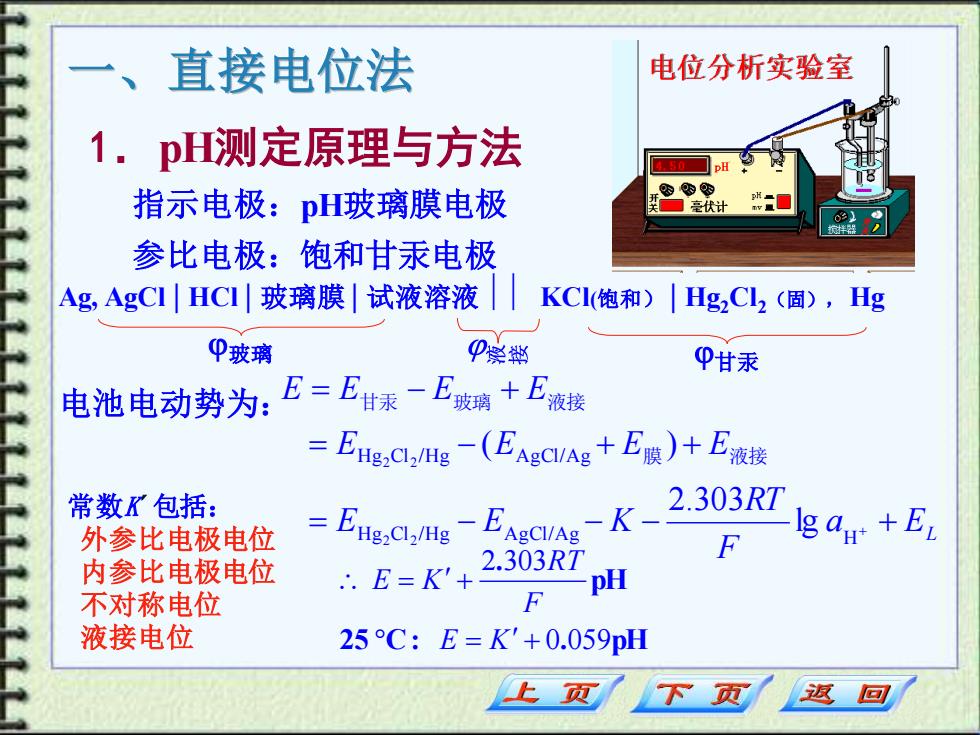
直接电位法 电位分析实验室 1.pH测定原理与方法 0☐H 指示电极:pH玻璃膜电极 ® 关☐毫伏计 参比电极:饱和甘汞电极 Ag,AgCI|HC1川玻璃膜|试液溶液 KC(饱和)|Hg2Cl2(固),Hg P玻璃 P祭微 P甘汞 电池电动势为:E=E甘表E皱璃+E液楼 =EHg,a,Hg-(EASCUA+E膜)+E液接 常数K包括: 外参比电极电位 -EHg:Cla/Hg K-2.303RT d+E 内参比电极电位 E=K'+ 2.303RT pH 不对称电位 液接电位 25C:E=K'+0.059pH 上页 下页 返回
一、直接电位法 1.pH测定原理与方法 指示电极:pH玻璃膜电极 参比电极:饱和甘汞电极 Ag, AgCl | HCl | 玻璃膜 | 试液溶液 KCl(饱和) | Hg2Cl2(固), Hg 玻璃 甘汞 电池电动势为: 常数K´包括: 外参比电极电位 内参比电极电位 不对称电位 液接电位 a EL F RT E E K E E E E E E E E = − − − + = − + + = − + + H g Cl /Hg AgCl/Ag H H g Cl /Hg AgCl/Ag lg 2.303 ( ) 2 2 2 2 膜 液接 甘汞 玻璃 液接 25 C : . pH pH . 0 059 2 303 = + = + E K F RT E K

pH的实用定义(比较法确定待测溶液的pH): 两种溶液:pH已知的标准缓冲溶液s和pH待测的试液x, 测定各自的电动势为: Es=ks+ .303RT F pH、;Ex=K+ 2.303R7 pHx 若测定条件完全一致,则、=、,两式相减得: pH=pH、 Ex-Es 2.303RT/F 式中pH已知,实验测出E,和E后,即可计算出试液的 pH,IUPAC:推荐上式作为pH的实用定义。使用时,尽量使 温度保持恒定并选用与待测溶液pH接近的标准缓冲溶液。 下页 返回
pH的实用定义(比较法确定待测溶液的pH): 两种溶液:pH已知的标准缓冲溶液s和pH待测的试液x , 测定各自的电动势为: 若测定条件完全一致,则K’ s = K’ x , 两式相减得: 式中pHs已知,实验测出Es和Ex后,即可计算出试液的 pHx ,IUPAC推荐上式作为pH的实用定义。使用时,尽量使 温度保持恒定并选用与待测溶液pH接近的标准缓冲溶液。 X ' S ' pH 2.303 pH ; 2.303 F RT E K F RT ES = KS + X = X + RT F EX ES 2.303 / pHX pHS − = +
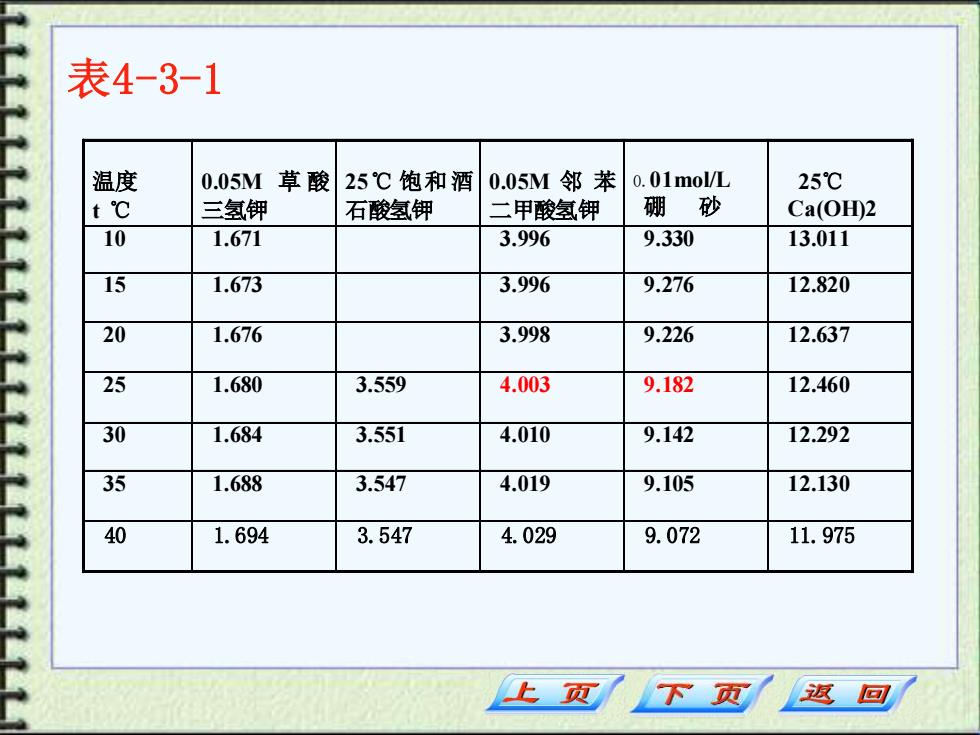
表4-3-1 温度 0.05M草酸 25℃饱和酒 0.05M邻苯 0.01mol/L 25℃ t℃ 三氢钾 石酸氢钾 二甲酸氢钾 硼 砂 Ca(OH)2 10 1.671 3.996 9.330 13.011 15 1.673 3.996 9.276 12.820 20 1.676 3.998 9.226 12.637 25 1.680 3.559 4.003 9.182 12.460 30 1.684 3.551 4.010 9.142 12.292 35 1.688 3.547 4.019 9.105 12.130 40 1.694 3.547 4.029 9.072 11.975 上页 下页 返回
表4-3-1 温度 t ℃ 0.05M 草 酸 三氢钾 2 5℃ 饱和酒 石酸氢钾 0.05M 邻 苯 二甲酸氢钾 0.01mol/L 硼 砂 25℃ Ca(OH)2 10 1.671 3.996 9.330 13.011 15 1.673 3.996 9.276 12.820 20 1.676 3.998 9.226 12.637 25 1.680 3.559 4.003 9.182 12.460 30 1.684 3.551 4.010 9.142 12.292 35 1.688 3.547 4.019 9.105 12.130 40 1.694 3.547 4.029 9.072 11.975

2.离子活度(或浓度)的测定原理与方法 将离子选择性电极(指示电极)和参比电极插入试液可以组成 测定各种离子活度的电池,电池电动势为: E=K'± 2.303RT nF lg a 离子选择性电极作正极时,对阳离子响应的电极,取正号; 对阴离子响应的电极,取负号。 ()标准曲线法: 用测定离子的纯物质配制一系列不同浓度的标准溶液,并用 总离子强度调节缓冲溶液(Totle Ionic Strength Adjustment Buffer 简称TSAB)保持溶液的离子强度相对稳定,分别测定各溶液的 电位值,并绘制 E-gc关系曲线。 注意:离子活度系数保持不变时,膜电位才与0gc呈线性关系。 页 返回
2.离子活度(或浓度)的测定原理与方法 将离子选择性电极(指示电极)和参比电极插入试液可以组成 测定各种离子活度的电池,电池电动势为: 离子选择性电极作正极时,对阳离子响应的电极,取正号; 对 阴离子响应的电极,取负号。 (1)标准曲线法: 用测定离子的纯物质配制一系列不同浓度的标准溶液,并用 总离子强度调节缓冲溶液(Totle Ionic Strength Adjustment Buffer 简称TISAB)保持溶液的离子强度相对稳定,分别测定各溶液的 电位值,并绘制 E - lg ci 关系曲线。 注意:离子活度系数保持不变时,膜电位才与log ci呈线性关系。 ai nF RT E K lg 2.303 =