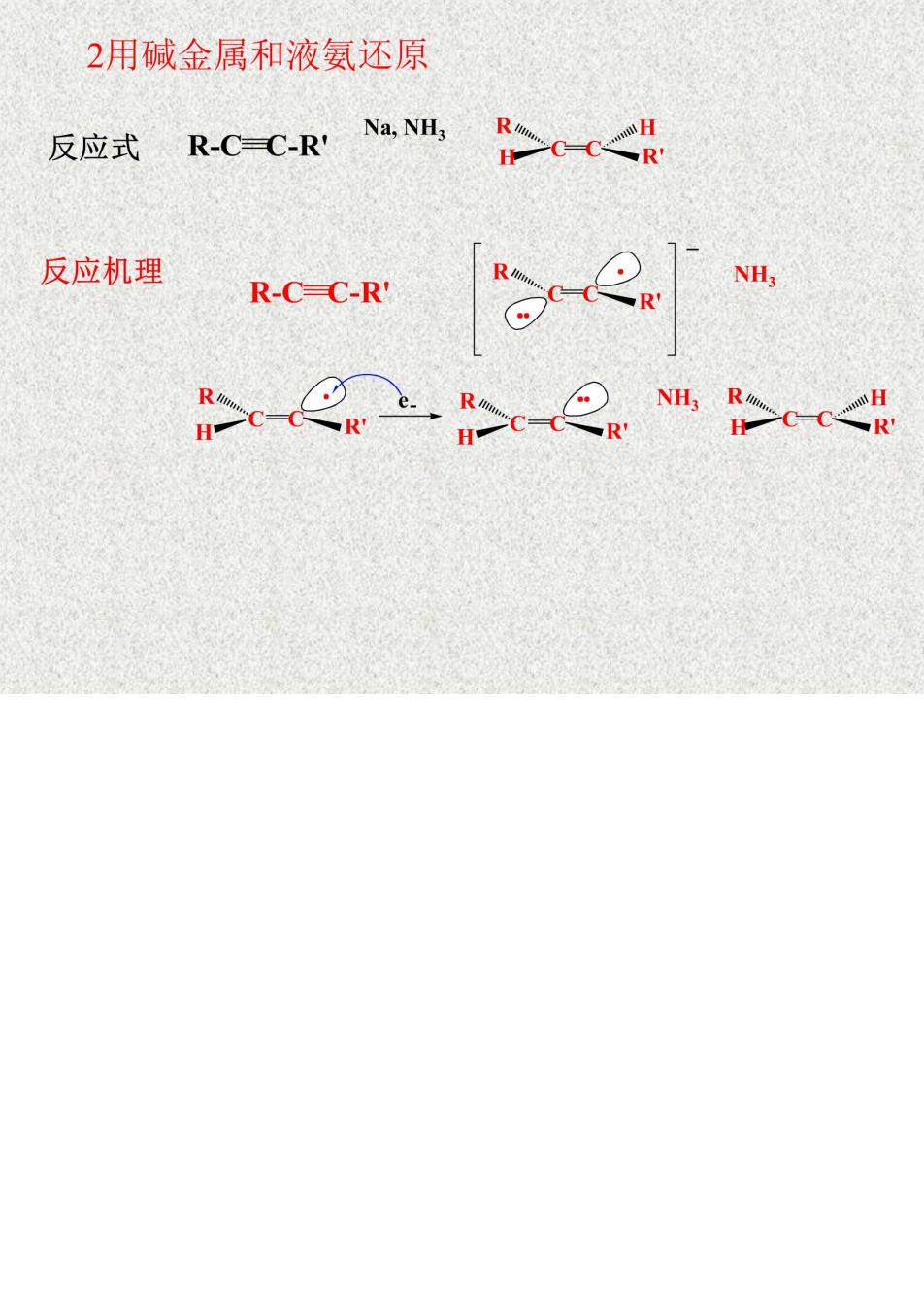
2用碱金属和液氨还原 反应式RCCR4>-< 反应机理 R-C-C-R c-e上c-2.m>cc<

说明 *1钠的液氨溶液的制备 Na+NH,(O低温 Na++eNH)蓝色是溶剂化 电子引起的。 Li,K C2HNH2 蓝色溶液 *2反应体系不能有水,因为钠与水会发生反应。 *3与制NaNH,的区别 Na+NH,(液)Fe NaNH

4.4.3亲电加成(活性:炔烃<烯烃) Br2 CH2=CH-CH,C=CH-2CCCLCH CHCHC=CH BrBr (90%) CH=CH HCI- 150-160C CH2=CHCI HCI HgCl2 →CH3CHC2 HgCh [思考题】为什么亲电加成的活性:炔烃<烯烃? H HC=CH H2O HgSO4 →IH-C-C-H]异构化、CH,CHo H2SO4 乙烯醇OH 互变异构 由分子内活泼氢引起的官能团的迅速互变而达到平衡的现象

02H 烯醇式 酮式 烯醇一般不稳定,易发生异构化,形成稳定的羰基化合物。 CH3(CH)5C三CH+H20- HgSO4 →CH3(CH2)5CCH3 H2S04 (95% ·与硼烷加成 H H202 6R-C三C-H+B2H6 6RCH2CHO 顺加 H 3 OH 反马氏加成 CH3COOH RCH=CH2

R 6R-C=C-R'+BH6→ CH;COOH R R C=C H cis- )B2H6 CH3CH2 CH3 CH3CH2C=C-CH 2)CH3COOH 4.4.4金属炔化物的生成 RC=CH+NaNH,Ig,Nm广RC三CNa+NH, HC=CH 2Ag(NH3)2*>AgC=CAg 鉴别端基炔烃 HC=CH 2Cu(NH3)2*>CuC=CCu