
-118 A作业习题汇总 【答案】2Ca0+Sc203=2Ca8.+50+2Sc+V6 14.请写出LaMnO,中产生的类似于Schottky缺陷的点缺陷方程,其中阳离子空 位只出现在La的格位, 【答案】2La+30×=2y"+3Vg+La203(solid). 15.(1)写出M0掺杂M2O3的缺陷方程,其中掺杂缺陷通过氧空位电荷平衡。 (2)写出在存在水蒸气的情况下,晶体中的氧空位被消除的缺陷方程. (3)写出在存在水蒸气的情况下,MO掺杂M2O3的缺陷方程,其掺杂缺陷通过掺 杂氢的缺陷电荷平衡。同时观察三个缺陷方程间的关系。 【答案】(1)2M0=2M+6+20谷: (2)H20(gas)+V6+Oǒ=20Ho; (3)2M10+H20(gas)=2Mk+20H6+0ǒ: 可见,(1)+(2)=(3). l6.写出CaF2掺杂CaO的缺陷方程,其中F取代O,CaO中的主要的缺陷为 Schottky缺陷 【答案】CaF2=2F。+Ca+V或CaF2+V6=2o+Can l7.推导M2O5晶体形成Schottky和Frenkel缺陷时缺陷浓度与温度的关系 【答案】(1)Schottky缺陷 缺陷方程:0=2Vw"+5V6 平衡常数:Ks=W?[g5 电中性条件:5=2V6 典精与度的关系:时-(停)”=k(器)》 (2)Frenkel缺陷 缺陷方程:M六=VW+M 平衡常数:KE=们M] 电中性条件:[V門=M 缺陷与温度的关系:]=-]=(K)P=K9ep(_△照 2RT 18.在氧化还原气氛下,推导M2O5晶体形成富金属和缺金属氧化物缺陷浓度与氧 分压的关系。 【答案】(①)富金属氧化物 缺陷方程:M货+o6=M+5C+0,(gs: 平衡常数:K'=M]n 电中性条件:n=5印M 缺陷与温度的关系:n=5M]=(5K')/p62 (②)缺金属氧化物 缺陷方程: 0.=05++ 平衡常数:K'=lppo5
− 118 − A 作业习题汇总 【答案】2* P + a+2P3 = 2* × * + 5P× P + 2a+# hB + V •• P. 14.请写出 LaMnO3 中产生的类似于 Schottky 缺陷的点缺陷方程,其中阳离子空 位只出现在 La 的格位. 【答案】2G × G + 3P× P = 2V ### G + 3V •• P + G 2P3(bQHB/). 15.(1)写出 MO 掺杂 M2O3 的缺陷方程,其中掺杂缺陷通过氧空位电荷平衡. (2)写出在存在水蒸气的情况下,晶体中的氧空位被消除的缺陷方程. (3)写出在存在水蒸气的情况下,MO 掺杂 M2O3 的缺陷方程,其掺杂缺陷通过掺 杂氢的缺陷电荷平衡.同时观察三个缺陷方程间的关系. 【答案】(1)2JHP = 2JH# J + V •• P + 2P× P; (2)>2P(; b) + V •• P + P× P = 2P>• P; (3)2JHP + >2P(; b)=2JH# J + 2P>• P + P× P; 可见,(1) + (2) = (3). 16.写出 CaF2 掺杂 CaO 的缺陷方程,其中 F 取代 O,CaO 中的主要的缺陷为 Schottky 缺陷. 【答案】* 62 = 26• P + * × * + V ## * 或 * 62 + V •• P = 26• P + * × * . 17. 推导 M2O5 晶体形成 Schottky 和 Frenkel 缺陷时缺陷浓度与温度的关系. 【答案】(1)Schottky 缺陷 缺陷方程:0=2V ##### J + 5V •• P; 平衡常数:K# S = [V ##### J ] 2[V •• P] 5; 电中性条件:5[V ##### J ] = 2[V •• P]; 缺陷与温度的关系:[V •• P] = 5 2 [V ##### J ] = %25 4 K# S &1/7 = K#% S 2tT % −∆H% S 7RT & . (2)Frenkel 缺陷 缺陷方程:J× J = V ##### J + J••••• i ; 平衡常数:K# F = [V ##### J ][J••••• i ]; 电中性条件:[V ##### J ]=[J••••• i ]; 缺陷与温度的关系:[V ##### J ]=[J••••• i ]=(K# F ) 1/2 = K#% F 2tT % −∆H% S 2RT & . 18. 在氧化还原气氛下,推导 M2O5 晶体形成富金属和缺金属氧化物缺陷浓度与氧 分压的关系. 【答案】(1) 富金属氧化物 缺陷方程:J× J + 2 5 P× P = J••••• i + 5e# + 5 4 P2(; b); 平衡常数:K# = [J••••• i ]n5p 4/5 Pk ; 电中性条件:n = 5[J••••• i ]; 缺陷与温度的关系:n = 5[J••••• i ] = (5K# )1/6p −4/25 Pk . (2) 缺金属氧化物 缺陷方程:5 4 P2(; b) = V ##### J + 2 5 P× P + 5h• +; 平衡常数:K# = [V ##### J ]p5p −4/5 Pk ;

-119- 电中性条件:p=5 缺陷与温度的关系:p=5Y=(5/6p2 19.一种M0晶体,在还原或氧化气氛下,分别可以形成缺氧MO1和缺金属 M1✉0氧化物,计算不同氧分压下的各种缺陷与氧分压的关系,并画图(假设在中间氧 分压区肖特基缺陷为主要缺陷). 【答案】缺陷方程、平衡常数和电中性条件: 06=VG+2+0a(gs)K1=[Volnpo: 0a(gas)=V+2+08K2=[ViMlppo!2 0=+6→Ka=[V6 n+2=p+2[V6. 低氧分压gn=2ax狼Px阳x (2)高氧分压区,p=2xPO ,nxP6,阳xP (3)中间氧分压区,K=阳x,nG 、1 log[D] 1 log Po2→ 图A.4第3题的Brouwer图 20.推导恒定浓度下M20或Mh2O3掺杂M1+0氧化物的缺陷浓度与氧分压的 关系 【答案】缺陷方程:M+08=M+2e+02(gas),K1=Mn2p022. (1)M2O掺杂M1+zO形成M: 低氧分压:n=2MxPO/,M浓度恒定不变 高氧分压:M:=2且浓度恒定不变,nxp6 (2)M,O,掺杂M+.0形成: 低氧分压:n=2MxPO,Mhu浓度恒定不变 高氧分压:n=Md且浓度恒定不变,Mx6 21.推导可以缺氧和缺金属的MO,氧化物的高价(MhO2)掺杂的缺陷浓度与氧 分压的关系图,掺杂缺陷为恒定浓度掺杂,对于电子缺陷(平衡常数K)和Schottky 缺陷(平衡常数K),K:≥K,所产生的缺陷均完全电离
− 119 − 电中性条件:p = 5[V ##### J ]; 缺陷与温度的关系:p = 5[V ##### J ] = (5K# )1/6p 4/25 Pk . 19. 一种 MO 晶体,在还原或氧化气氛下,分别可以形成缺氧 MO1ɢx 和缺金属 M1ɢxO 氧化物,计算不同氧分压下的各种缺陷与氧分压的关系,并画图(假设在中间氧 分压区肖特基缺陷为主要缺陷). 【答案】缺陷方程、平衡常数和电中性条件: P× P = V •• P + 2e# + 1 2 P2(; b) ⇒ K1 = [V •• P]n2 p 1/2 Pk , 1 2 P2(; b) = V ## J + 2h• + P× P ⇒ K2 = [V ## J]p2 p −1/2 Pk , 0 = V ## J + V •• P ⇒ K3 = [V ## J][V •• P], n + 2[V ## J] = p + 2[V •• P]. (1)低氧分压区,n = 2[V •• P] ∝ p −1/6 Pk ,p ∝ p 1/6 Pk ,[V ## J] ∝ p 1/6 Pk ; (2)高氧分压区,p = 2[V ## J] ∝ p −1/6 Pk ,n ∝ p −1/6 Pk ,[V •• P] ∝ p −1/6 Pk ; (3)中间氧分压区,[V ## J]=[V •• P] ∝ p 1/2 Pk ,n ∝ p −1/4 Pk ,p ∝ p 1/4 Pk . 图 A.4 第 3 题的 Brouwer 图 20. 推导恒定浓度下 Ml2O 或 Mh2O3 掺杂 M1+xO 氧化物的缺陷浓度与氧分压的 关系. 【答案】缺陷方程:J× J + P× P = J•• i + 2e# + 1 2P2(; b), K1 = [J•• i ]n2pPk 1/2. (1)Ml2O 掺杂 M1+xO 形成 Ml# J: 低氧分压:n = 2[J•• i ] ∝ p −1/6 Pk ,Ml# J 浓度恒定不变; 高氧分压:Ml# J = 2[J•• i ] 且浓度恒定不变,n ∝ p −1/4 Pk . (2)Mh2O3 掺杂 M1+xO 形成 Mh• J: 低氧分压:n = 2[J•• i ] ∝ p −1/6 Pk ,Mh• J 浓度恒定不变; 高氧分压:n = [J?• J] 且浓度恒定不变,[J•• i ] ∝ p −1/2 Pk . 21. 推导可以缺氧和缺金属的 M2O3 氧化物的高价 (MhO2) 掺杂的缺陷浓度与氧 分压的关系图,掺杂缺陷为恒定浓度掺杂,对于电子缺陷(平衡常数 Ki)和 Schottky 缺陷(平衡常数 Ks),Ki & Ks,所产生的缺陷均完全电离.
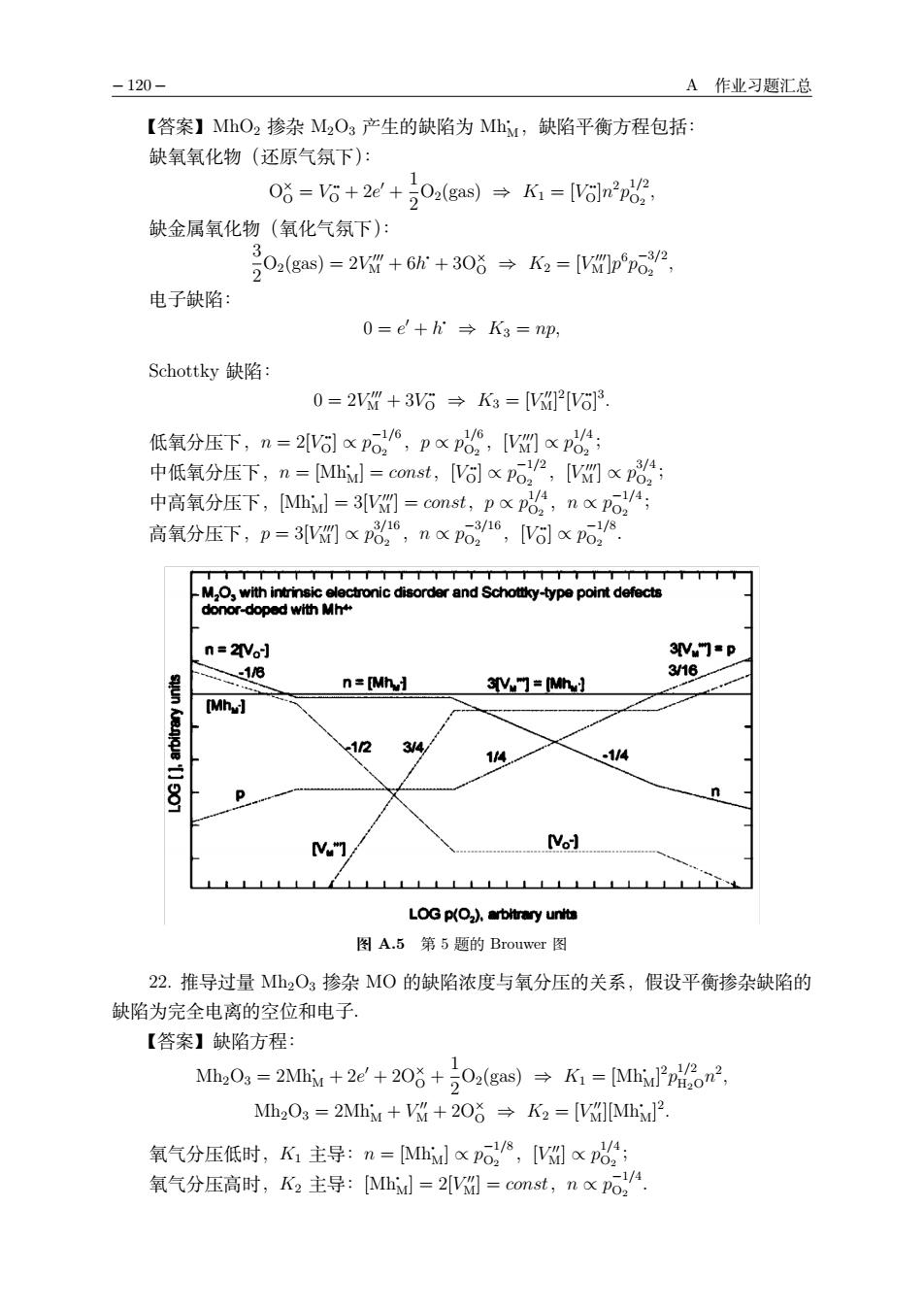
-120 A作业习题汇总 【答案】MhO2掺杂MOg产生的缺陷为MhM,缺陷平衡方程包括: 缺氧氧化物(还原气氛下): 06=6+2W+0,(gas)→K1=6nn 缺金属氧化物(氧化气氛下): 2Oa(gas)=2V+6+308K3=[Vpo2 电子缺陷: 0=e+→Kg=np, Schottky缺陷 0=2VW+3V6→K3=V[V68 低氧分压下,n=2V%lxpo2,nx,[x 中低氧分压下,n=Ml=const,%xP6,x8 附 M.nchoy-yppoint donor-doped wit世Mhm =2V% n=[Mh] 3Y门=MhH [Mh] 12 3/4 14 14 0 [Vol LOG p().arbitrary units 图A.5第5题的Brouwer图 22.推导过量Mh2O3掺杂M0的缺陷浓度与氧分压的关系,假设平衡掺杂缺陷的 缺陷为完全电离的空位和电子 【答案】缺陷方程: M,0=2M+2E+206+202(ga)→K=uP2, Mh2Os=2Mh++2O答→K2=[IMh2 氧气分压低时,K1主导:n=Mhitpo,州x: 氧气分压高时,K,主导:A=2图=const,nxP6
− 120 − A 作业习题汇总 【答案】MhO2 掺杂 M2O3 产生的缺陷为 Mh• J,缺陷平衡方程包括: 缺氧氧化物(还原气氛下): P× P = V •• P + 2e# + 1 2 P2(; b) ⇒ K1 = [V •• P]n2 p 1/2 Pk , 缺金属氧化物(氧化气氛下): 3 2 P2(; b)=2V ### J + 6h• + 3P× P ⇒ K2 = [V ### J ]p6 p −3/2 Pk , 电子缺陷: 0 = e# + h• ⇒ K3 = np, Schottky 缺陷: 0=2V ### J + 3V •• P ⇒ K3 = [V ## J] 2 [V •• P] 3 . 低氧分压下,n = 2[V •• P] ∝ p −1/6 Pk ,p ∝ p 1/6 Pk ,[V ### J ] ∝ p 1/4 Pk ; 中低氧分压下,n = [J?• J] = const,[V •• P] ∝ p −1/2 Pk ,[V ### J ] ∝ p 3/4 Pk ; 中高氧分压下,[J?• J] = 3[V ### J ] = const,p ∝ p 1/4 Pk ,n ∝ p −1/4 Pk ; 高氧分压下,p = 3[V ### J ] ∝ p 3/16 Pk ,n ∝ p −3/16 Pk ,[V •• P] ∝ p −1/8 Pk . 图 A.5 第 5 题的 Brouwer 图 22. 推导过量 Mh2O3 掺杂 MO 的缺陷浓度与氧分压的关系,假设平衡掺杂缺陷的 缺陷为完全电离的空位和电子. 【答案】缺陷方程: J?2P3 = 2J?• J + 2e# + 2P× P + 1 2 P2(; b) ⇒ K1 = [J?• J] 2 p 1/2 >kPn2 , J?2P3 = 2J?• J + V ## J + 2P× P ⇒ K2 = [V ## J][J?• J] 2 . 氧气分压低时,K1 主导:n = [J?• J] ∝ p −1/8 Pk ,[V ## J] ∝ p 1/4 Pk ; 氧气分压高时,K2 主导:[J?• J] = 2[V ## J] = const,n ∝ p −1/4 Pk .

-121 23.推导氢掺杂对缺氧化合物MO1z的缺陷浓度与水蒸气分压的关系 【答案】缺陷方程: Oǒ=6+2E+0(gas→K1=Ign2p0, H2O(gas)+206=20Ho +2e+02(gas)K2 [OHoln2poPio 低水装气分压下:n=2V哈xp66,OHx 高水蒸气分压:n=[Olx,glxp6 24.根据Bond Valence理论计算NaO晶体的其晶胞参数, 【答案】由S=(R/R)N=1/4,得R=2.24,因此dy=Rg-bns=2.75A.Na 原子在1/8晶胞的体心,因此a=6.36A. 25.借助剑桥大学关于Ellingham图的网站,回答下列问题 (1)The Ellingham diagram shows values of which thermodynamic quantity as a function of temperature? a.Standard electrode voltage; b.Standard free energy change of reaction; c.Partial pressure of gas; d.Enthalpy change of reaction. (2)For a closed system at equilibrium at a temperature T,which of the following statements are true? a.△G=0: b.△G9=0: C.AH =TAS d.△S=0. (3)Why are the slopes of many of the lines on the Ellingham diagram almost identical? a.Most reactions involve the elimination of one mole of gas,so there is a similar standard enthalpy change of reaction. b.Most reactions involve the elimination of one mole of gas,so there is a similar standard entropy change of reaction. c.The activity of most of the metals is the same d.The partial pressure of the reacting gas is the same for all reactions. (4)What thermodynamic quantity does the intercept at T=0K for any standard free energy vs T line signify? a.The approximate value of the standard entropy change; b.The approximate value of the standard enthalpy change c.The equilibrium constant for the oxidation reaction; d.Heat capacity of the oxide
− 121 − 23. 推导氢掺杂对缺氧化合物 MO1ɢx 的缺陷浓度与水蒸气分压的关系. 【答案】缺陷方程: P× P = V •• P + 2e# + 1 2 P2(; b) ⇒ K1 = [V •• P]n2 p 1/2 Pk , >2P(; b)+2P× P = 2P>• P + 2e# + 1 2 P2(; b) ⇒ K2 = [P>• P] 2 n2 p 1/2 Pk p−1 >kP 低水蒸气分压下:n = 2[V •• P] ∝ p −1/6 Pk ,[P>• P] ∝ p 1/2 Pk ; 高水蒸气分压:n = [P>• P] ∝ p 1/4 Pk ,[V •• P] ∝ p −1/2 Pk . 24. 根据 Bond Valence 理论计算 Na2O 晶体的其晶胞参数. 【答案】由 sij = (R0/R)N = 1/4,得 R = 2.24,因此 dij = Rij −bHMsij = 2.75Å.Na 原子在 1/8 晶胞的体心,因此 a = 6.36Å. 25. 借助剑桥大学关于 Ellingham 图的网站,回答下列问题: (1) The Ellingham diagram shows values of which thermodynamic quantity as a function of temperature? a. Standard electrode voltage; b. Standard free energy change of reaction; c. Partial pressure of gas; d. Enthalpy change of reaction. (2) For a closed system at equilibrium at a temperature T, which of the following statements are true? a. ∆G = 0; b. ∆G% = 0; c. ∆H = T ∆S; d. ∆S = 0. (3) Why are the slopes of many of the lines on the Ellingham diagram almost identical? a. Most reactions involve the elimination of one mole of gas, so there is a similar standard enthalpy change of reaction. b. Most reactions involve the elimination of one mole of gas, so there is a similar standard entropy change of reaction. c. The activity of most of the metals is the same. d. The partial pressure of the reacting gas is the same for all reactions. (4) What thermodynamic quantity does the intercept at T=0 K for any standard free energy vs T line signify? a. The approximate value of the standard entropy change; b. The approximate value of the standard enthalpy change; c. The equilibrium constant for the oxidation reaction; d. Heat capacity of the oxide