
(1)同周期,1B~IA,ⅡB~ⅢA的比较: 性质 IB、ⅡB IA、IIA 价电子构型 (n-1)dions1-2 ns1-2 次外层电子构型 18e Se (n-1)s2(n-1)p(n-1)d0 (n-1)s2(n-1)p Z* 小 原子半径 小 < 大 有效离子势中* 大 > 小 金属活泼性 化合物键型 明显共价性 主要是离子键 形成配合物倾向
性质 I B、II B I A、II A 价电子构型 (n-1)d10ns1~2 ns1~2 次外层电子构型 18e 8e (n-1) s2 (n-1) p6(n-1)d10 (n-1)s2(n-1)p6 Z* 大 > 小 原子半径r 小 < 大 有效离子势I* 大 > 小 金属活泼性 < 化合物键型 明显共价性 主要是离子键 形成配合物倾向 > (1) 同周期,I B ~ I A,II B ~ II A的比较: 6

(2)同周期IB族元素与A族元素的比较 IA IB 性质 比较 (K,Rb,Cs) (Cu,Ag,Au) 价电子构型 nsl (n-1)donsi B(n-1)d0 密度、熔点、 较B低, 较LA高, IB>IA 沸点及金属键 金属键较弱 金属键较强 导电导热及延展性 不如IB 很好 IB>IA 第一电离能、 较IB低 较IA高 IB>IA 升华热、水合能 第二、三电离能 较IB高 较IA低 IB<IA
(2) 同周期IB族元素与IA族元素的比较 性 质 IA (K, Rb, Cs) IB (Cu, Ag, Au) 比较 价电子构型 ns1 (n-1)d10ns1 IB (n-1)d10 密度、熔点、 沸点及金属键 较IB低, 金属键较弱 较IA高, 金属键较强 IB > IA 导电导热及延展性 不如IB 很好 IB > IA 第一电离能、 升华热、水合能 较IB低 较IA高 IB > IA 第二、三电离能 较IB高 较IA低 IB < IA 7
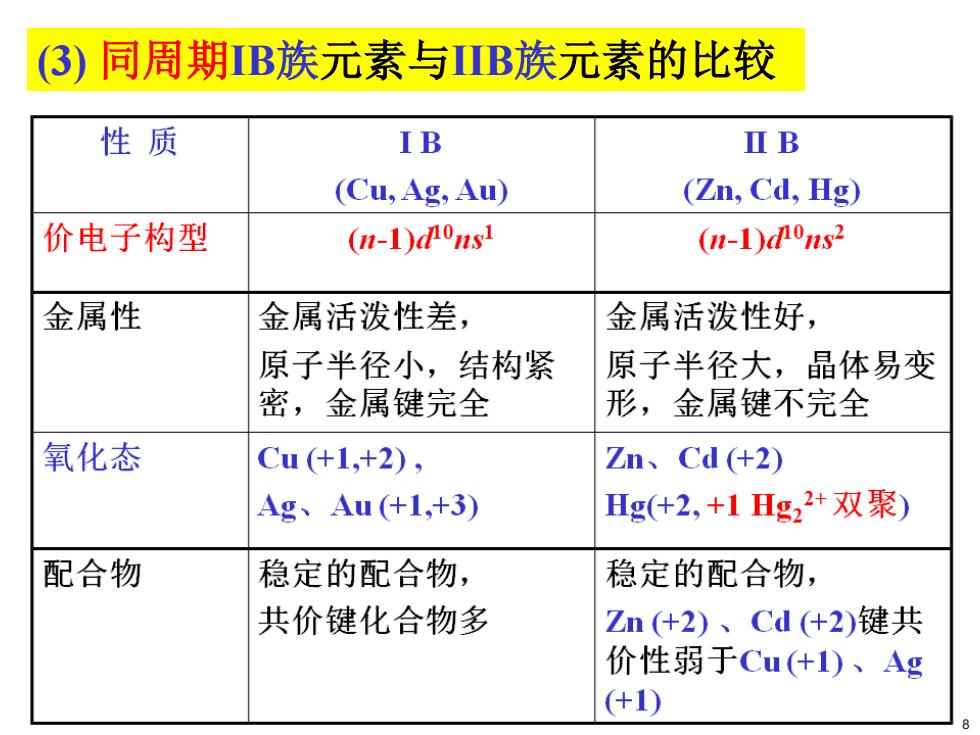
(3)同周期IB族元素与IB族元素的比较 性质 IB ⅡB (Cu,Ag,Au) (Zn,Cd,Hg) 价电子构型 (n-1)0s1 (n-1)0ns2 金属性 金属活泼性差, 金属活泼性好, 原子半径小,结构紧 原子半径大,晶体易变 密,金属键完全 形,金属键不完全 氧化态 Cu(+1,+2), Zn、Cd(+2) Ag、Au+1,+3) Hg(+2,+1Hg22+双聚) 配合物 稳定的配合物, 稳定的配合物, 共价键化合物多 Zn(+2)、Cd(+2)键共 价性弱于Cu(什I)、Ag (+1)
(3) 同周期IB族元素与IIB族元素的比较 8

>不同氧化态物种的氧化-还原性质比较 M Mn+ Cu+/Cu +0.522 Zn2+/Zn -0.76 还 氧 Ag/Ag +0.80 Cd2+/Cd -0.40 原 化 Au/Au +1.68 Hg2*/Hg +0.85 性 性 (Cu2+/Cu +0.34) (Hg,2+/Hg +0.789) 降升 M还原性↑,M+氧化性↓
Cu+/Cu +0.522 Zn2+/Zn -0.76 Ag+/Ag +0.80 Cd2+/Cd -0.40 Au+/Au +1.68 Hg2+/Hg +0.85 (Cu2+/Cu +0.34) (Hg2 2+/Hg +0.789) M 还原性↑ ,Mn+氧化性↓ M Mn+ 还 氧 原 化 性 性 降 升 ¾ 不同氧化态物种的氧化-还原性质比较 9

(4)B和B同族比较: (Z*与r互相竞争) IVB VIⅢ IB IIB IIIA Al Z显著,主导 Ti Cu Zn Ga r,次要 Zr Ag Cd In ∴.金属性渐弱 Hf Au Hg TI (周期性) >副族(IVB~VI山和IA主族(铝分族)金属性由上到 下依次减弱(.'Z*因素占主导地位); >其它主族和B族(Sc,Y,镧系,锕系)(.'r因素占 主导地位)→规律相反! 10
IVB . VIII IB IIB IIIA Al Z* 显著↗,主导 Ti Cu Zn Ga r ↗,次要 Zr Ag Cd In ∴金属性渐弱 Hf Au Hg Tl (周期性) (4) IB和IIB同族比较:(Z*与r互相竞争) ¾ 副族(IVB ~ VIII)和IIIA主族(铝分族)金属性由上到 下依次减弱(∵ Z*因素占主导地位); ¾其它主族和IIIB族(Sc, Y,镧系, 锕系)( ∵ r因素占 主导地位) 规律相反! 10