
反应分子数:在基元反应中,同时直接参加反应的粒子 (分子、原子、离子)数目 反应的分子数:从微观上用来说明各反应物分子经碰撞而 发生的过程中所包含的分子数,所以反应分子数仅对基 元反应而言。按反应物的分子数,基元反应可分为三类: ①单分子反应:分解反应或异构化反应N,O,→2NO, ②双分子反应:多数反应2N0,→2N0+O2 ③三分子反应:少数反应21+H2→2HI 三个质点同时碰撞的几率很小 反应分子数是为了说明反应机理而提出的概念,仅适用 于基元反应,它是通过实验确定的,不能认为反应方程 式中反应物的计量系数之和就是反应的分子数
反应分子数:在基元反应中,同时直接参加反应的粒子 (分子、原子、离子)数目 反应的分子数:从微观上用来说明各反应物分子经碰撞而 发生的过程中所包含的分子数,所以反应分子数仅对基 元反应而言。按反应物的分子数,基元反应可分为三类: ① 单分子反应:分解反应或异构化反应 ② 双分子反应:多数反应 ③ 三分子反应:少数反应 三个质点同时碰撞的几率很小 反应分子数是为了说明反应机理而提出的概念,仅适用 于基元反应,它是通过实验确定的,不能认为反应方程 式中反应物的计量系数之和就是反应的分子数。 2 4 2 N O 2NO 2 2 2NO 2NO O 2I H 2HI 2

第三节化学反应速率理论简介 、 碰撞理论与活化能 1. 有效碰撞与弹性碰撞 有效碰撞(effective collision): 能发生反应的碰撞。 弹性碰撞(elastic collision): 不发生反应的碰撞
第三节 化学反应速率理论简介 一、碰撞理论与活化能 1. 有效碰撞与弹性碰撞 v 有效碰撞(effective collision): 能发生反应的碰撞。 v 弹性碰撞(elastic collision): 不发生反应的碰撞

第三节化学反应速率理论简介 有效碰撞理论要点: 只有有效碰撞才能使反应物转化为产物。 发生有效碰撞两个条件: (1)需有足够的能量; (2)碰撞时要有合适的方向; 例 C0(g)+H2O(g)=CO2(g)+H2(g)
第三节 化学反应速率理论简介 有效碰撞理论要点: v 只有有效碰撞才能使反应物转化为产物。 v 发生有效碰撞两个条件: (1)需有足够的能量; (2)碰撞时要有合适的方向; 例 CO(g)+H2O(g) CO2 (g)+H2 (g)
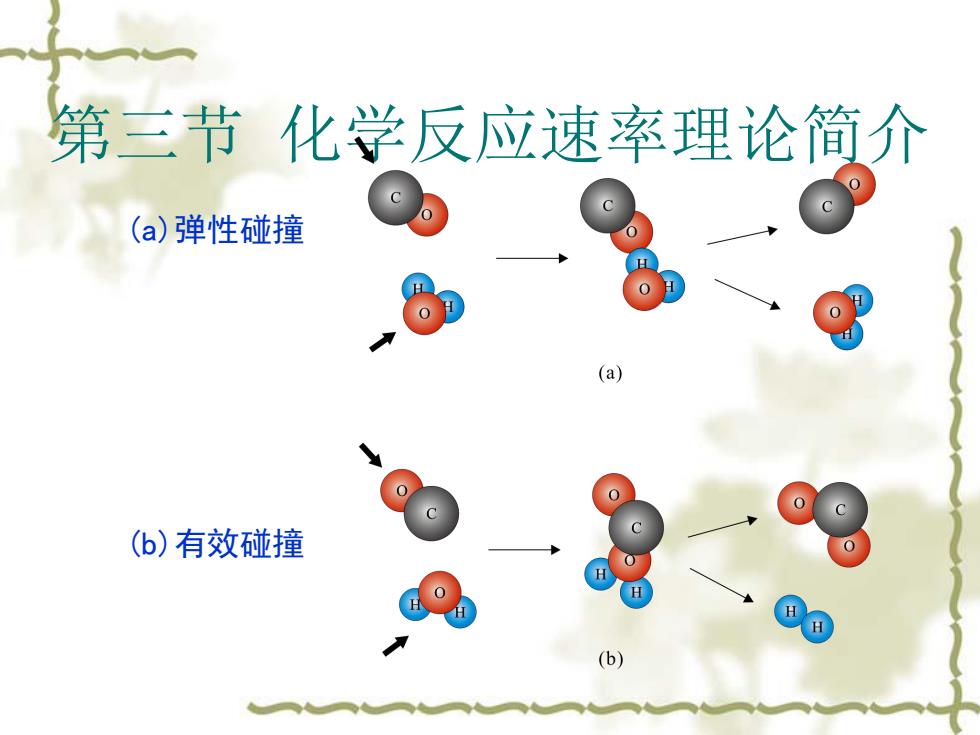
第三节化学反应速率理论简介 (a)弹性碰撞 (a) c (b)有效碰撞 0 (b)
第三节 化学反应速率理论简介 (a)弹性碰撞 (b)有效碰撞
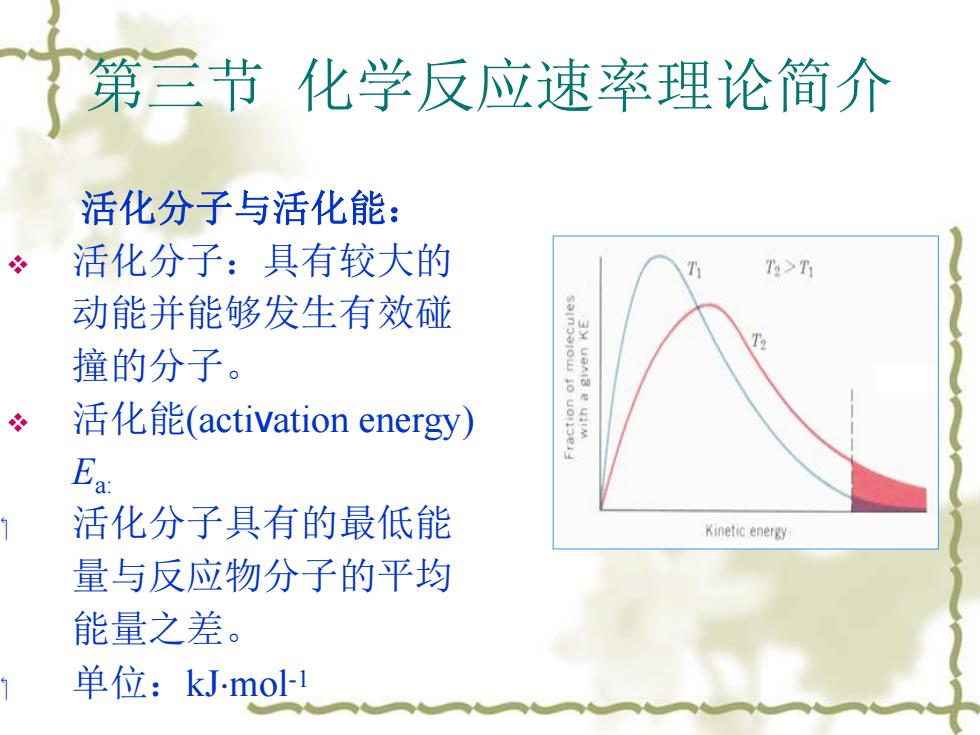
第三节化学反应速率理论简介 活化分子与活化能: 活化分子:具有较大的 T>T 动能并能够发生有效碰 撞的分子。 冬 活化能(activation energy) Ea 活化分子具有的最低能 Kinetic energy 量与反应物分子的平均 能量之差。 单位:kJ-mol-1
第三节 化学反应速率理论简介 活化分子与活化能: v 活化分子:具有较大的 动能并能够发生有效碰 撞的分子。 v 活化能(activation energy) Ea: 活化分子具有的最低能 量与反应物分子的平均 能量之差。 单位:kJmol -1