
第一章溶液 教学目的与要求 ·了解溶液的概念 ■掌握溶液浓度的各种表示法,并能熟练地进 行有关浓度的计算 ■ 掌握稀溶液的依数性及其应用 理解离子的活度 理解溶液离子强度的计算及其与活度的关系 重点:稀溶液的依数性及其应用 难点:依数性、离子的活度
第一章 溶 液 教学目的与要求 ◼ 了解溶液的概念 ◼ 掌握溶液浓度的各种表示法,并能熟练地进 行有关浓度的计算 ◼ 掌握稀溶液的依数性及其应用 ◼ 理解离子的活度 ◼ 理解溶液离子强度的计算及其与活度的关系 重点:稀溶液的依数性及其应用 难点:依数性、离子的活度

第一章溶液 第一节溶解 第二节 溶液的浓度 第三节 溶液的依数性 第四节 电解质溶液
第一章 溶 液 第一节 溶解 第二节 溶液的浓度 第三节 溶液的依数性 第四节 电解质溶液

分散系:粗分散系、胶体分散系、分子分散系(气、液、固) 分散相、分散介质 溶液(solution):一种物质以分子、原子或离子状态分 散于另一种物质中所构成的均匀而又 稳定的分散体系(分子分散系)。 溶剂(solvent):在液态溶液中的液体组分 溶质(solute):溶解在液体中的气体或固体 浓度(concentration):溶液中溶剂和溶质的相对含量
分散系:粗分散系、胶体分散系、分子分散系(气、液、固) 分散相、分散介质 溶液(solution):一种物质以分子、原子或离子状态分 散于另一种物质中所构成的均匀而又 稳定的分散体系(分子分散系)。 溶剂(solvent):在液态溶液中的液体组分 溶质(solute):溶解在液体中的气体或固体 浓度(concentration):溶液中溶剂和溶质的相对含量

第一节溶解 溶解不只是简单的物理过程。常伴随能量、体 积的变化,有时也有颜色改变。 一、溶解和水合作用 分子溶液,离子溶液 NaCI(s)+H2O(1)=Na(aq)+Cl(aq) 水合作用hydration):正负离子吸引水分子中的 氧和氢原子,每个离子都被水分子包围的现象。 溶解实际包括两个过程:一是溶质被分散,吸热、体 积增大;二是溶剂化(solvation),放热、体积减小
第一节 溶 解 溶解不只是简单的物理过程。常伴随能量、体 积的变化,有时也有颜色改变。 一、溶解和水合作用 分子溶液,离子溶液 NaCl(s) + H2O(l) = Na+ (aq) + Cl- (aq) 水合作用(hydration):正负离子吸引水分子中的 氧和氢原子,每个离子都被水分子包围的现象。 溶解实际包括两个过程:一是溶质被分散,吸热、体 积增大;二是溶剂化(solvation),放热、体积减小
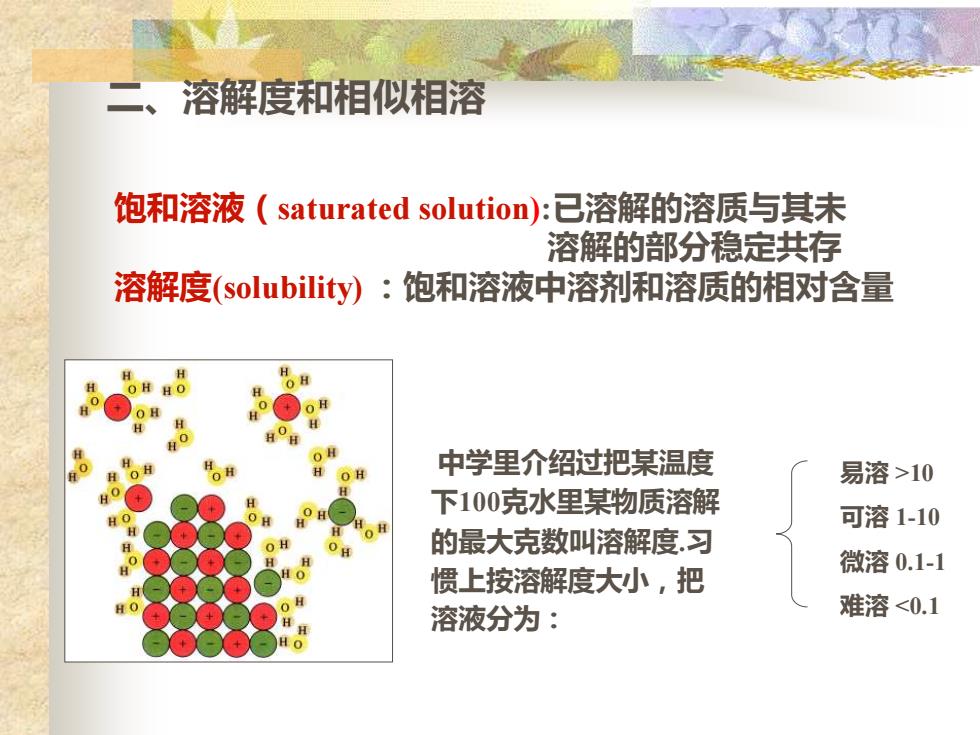
二、溶解度和相似相溶 饱和溶液(saturated solution):已溶解的溶质与其未 溶解的部分稳定共存 溶解度(solubility):饱和溶液中溶剂和溶质的相对含量 中学里介绍过把某温度 易溶>10 下100克水里某物质溶解 0 可溶1-10 的最大克数叫溶解度.习 微溶0.1-1 惯上按溶解度大小,把 溶液分为: 难溶<0.1
二、溶解度和相似相溶 饱和溶液(saturated solution):已溶解的溶质与其未 溶解的部分稳定共存 溶解度(solubility) :饱和溶液中溶剂和溶质的相对含量 中学里介绍过把某温度 下100克水里某物质溶解 的最大克数叫溶解度.习 惯上按溶解度大小,把 溶液分为: 易溶 >10 可溶 1-10 微溶 0.1-1 难溶 <0.1