
相似相溶原理 the principle of similitude between solute and solvent “相似相溶”原理,即非极性物质可以溶解在非极性溶剂中 (例如碘溶于四氯化碳中),极性物质和离子型晶体易溶于极性 溶剂(如水)中。主要表现在: a.溶质分子于溶剂分子的结构越相似,相互溶解越容易; .溶质分子的分子间作用力与溶剂分子间作用力越相似,越易 互溶
相似相溶原理 (the principle of similitude between solute and solvent) “相似相溶”原理,即非极性物质可以溶解在非极性溶剂中 (例如碘溶于四氯化碳中),极性物质和离子型晶体易溶于极性 溶剂(如水)中。主要表现在: a. 溶质分子于溶剂分子的结构越相似,相互溶解越容易; b.溶质分子的分子间作用力与溶剂分子间作用力越相似,越易 互溶

第二节溶液的浓度 (The concentration of solution) >广义的浓度定义是溶液中的溶质和溶剂的相对含量
第二节 溶液的浓度 (The concentration of solution) ➢ 广义的浓度定义是溶液中的溶质和溶剂的相对含量
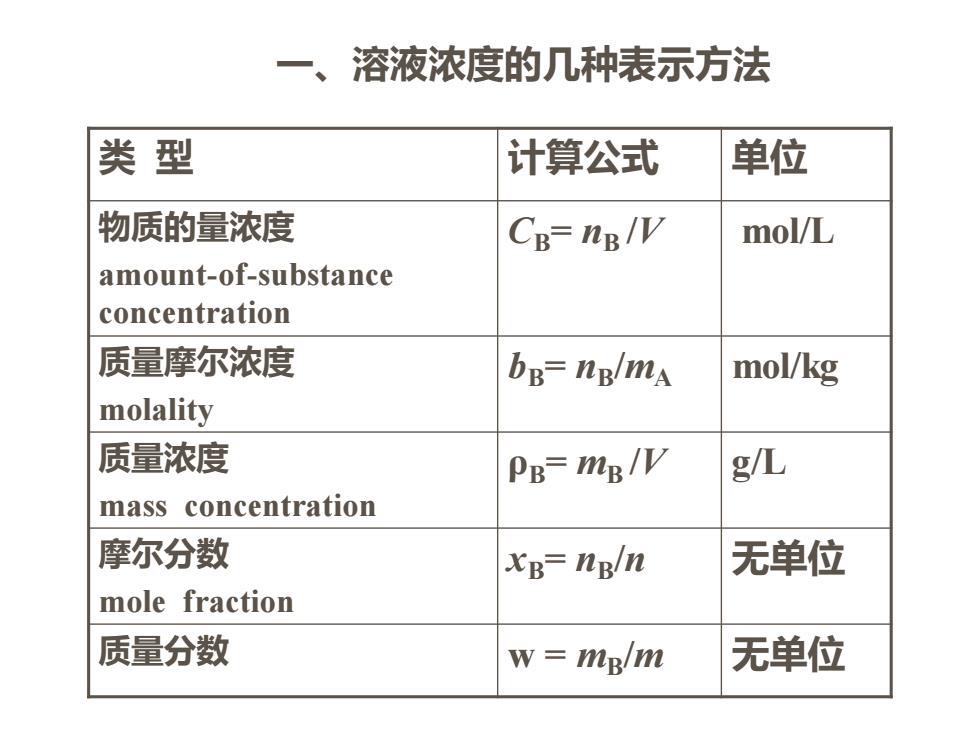
一、溶液浓度的几种表示方法 类型 计算公式 单位 物质的量浓度 CB=nB/V mol/L amount-of-substance concentration 质量摩尔浓度 bB-ng/mA mol/kg molality 质量浓度 PB=mg/V g/L mass concentration 摩尔分数 xB=ng/n 无单位 mole fraction 质量分数 w=mglm 无单位
类 型 计算公式 单位 物质的量浓度 amount-of-substance concentration CB= nB /V mol/L 质量摩尔浓度 molality bB= nB/mA mol/kg 质量浓度 mass concentration ρB= mB /V g/L 摩尔分数 mole fraction xB= nB/n 无单位 质量分数 w = mB/m 无单位 一、溶液浓度的几种表示方法

注意事项 1。质量浓度与溶液的比重(密度)。 2。质量分数与质量百分浓度((98%的疏酸)》 3。体积百分浓度(体积分数)。 4。质量-体积百分浓度 二.各种浓度之间的换算。如p7表1-1
注意事项 1。质量浓度与溶液的比重(密度)。 2。质量分数与质量百分浓度(98%的硫酸) 3。体积百分浓度(体积分数)。 4。质量-体积百分浓度 二. 各种浓度之间的换算。如:p7表1-1

例 将7.00g结晶草酸H2C20,2H0)溶30g永币, 求草酸的质量摩尔浓度和摩尔分数x(H2C2O4)。 解 MH2C2042H2O)=126gmo1,而MH2C204)= 90.0gmo1,故7.00g结晶草酸中草酸的质量为 (H2C204)= 7.00g×90.0gmol =5.00g 溶液中水的质量为126g·mo m(H20)=93.0g+(7.00-5.00)g=95.0g b(H,C,O4)= 5.00g 1000g 90.0gmo'×95.0g1kg =0.585mol-kg x(H,C,04)= 5.00g/90.0g·mo1 =0.0104 5.00g/90.0gmor)+(95.0g/18.0gmo1) 例2. P8 习题1(20)
例 将7.00g结晶草酸(H2C2O4·2H2O)溶于93.0g水中, 求草酸的质量摩尔浓度和摩尔分数x(H2C2O4 )。 解 M(H2C2O4·2H2O)= 126g·mol-1 ,而M(H2C2O4 )= 90.0 g·mol-1 , 故7.00g结晶草酸中草酸的质量为 5.00g 126g mol 7.00g 90.0g mol (H C O ) -1 -1 2 2 4 = m = 溶液中水的质量为 m (H2O)=93.0g+(7.00 -5.00)g=95.0g 0.0104 ) ( ( ) ( ) 0.585 = + = = = (5.00g/90.0g mol 95.0g/18.0g mol ) 5.00g/90.0g mol x H C O mol k g 1kg 1000g 90.0g mol 95.0g 5.00g b H C O -1 -1 -1 2 2 4 -1 2 2 4 -1 例2. P8 习题1(20)