
第二章蛋白质化学 第一节蛋白质概述 一、蛋白质的功能 重要的食不论是动物、植物,不是简单的细随、病等都有或白帆存在它细胞一 ,英文名称叫做Protein,是“最原初的”、“第 不论是动 蛋白质的重要 就被1 1 这3 主要成分与核酸 星球上生命则是不可能存在的,因此, 1生物催化功能:蛋白质的一个最重要的生物学功能是作为有机体新陈代谢的催化剂 酶。几乎所有的酶都是蛋白质。生物体内的各种化学反应几乎都是在相应的酶参与下 进行的。 2结构蛋白:蛋白质另一个主要的生物学功能是作为有机体的结构成分。在高等动物 里,胶原纤维是主要的细胞外结构蛋白,参与结缔组织和骨骼作为身体的支架。细胞里的 片层结构,如细胞膜、线粒体、叶绿体和内质网等都是由不溶性蛋白质与脂质组成的。 3运输功能。脊椎动物的血红蛋白和无脊椎动物中的血蓝蛋白,某些色素蛋白如细胞色 素c等起传递电子的作用。 4收缩功能:某些蛋白质与生物的运动有关,如肌球蛋白(myosin)和肌动蛋白(actin)是肌 肉收缩系统的必要成分。细菌的鞭毛或纤毛蛋白也能产生类似的活动。近年来发现,在非 肌肉的运动系统中普遍存在着运动蛋白。 有些蛋白质具有贮藏氨基酸的功能,作为有机体及其胚胎或幼体生长发育的原料,如 蛋类中的卵清蛋白(ovalbumin)、乳类中的酪蛋白(casein)、小麦种子中的麦醇溶蛋白等。 5还有一些蛋白质具有激素的功能,对生物体内的新陈代谢起调节作用。如胰岛素参与 血糖的调节,能降低血液中葡萄糖的含量。 6免疫保护功能:生物体防御体系中的抗体(antibody)也是蛋白质。它能识别病毒、 细菌以及其它机体的细胞,并与之相结合而排除外来物质对有机体的干扰,起到保护机体 的作用。 近代分子生物学的研究还表明,蛋白质在遗传信息的控制、细胞膜的通透性,以及高 等动物的记忆、识别机构等方面都起到重要作用。 二、蛋白质的元素组成 蛋白质是含氮的有机化合物,其含氮量占生物组织中一切含氮物质的绝大部分。氮元 素是蛋白质区别于糖和脂肪的特征性元素,根据对大多数蛋白质的氮元素分析,其氮元素 的含量都相当接近,一般在15%~17%,平均为16%,即100g蛋白质中含有16g氮。这是 凯氏(Kjedahl)定氮法测定蛋白质含量的计算基础。 蛋白质含量=蛋白氮×625
32 第二章 蛋白质化学 第一节 蛋白质概述• 一、蛋白质的功能 蛋白质是生物体内最重要的物质之一,英文名称叫做 Protein,是“最原初的”、“第一 重要的”意思,不论是动物、植物,还是简单的细菌、病毒等都有蛋白质存在。它是细胞 原生质的主要成分,与核酸一起共同构成了生命的物质基础。蛋白质的重要性很早就被认 识,1838年,当 G. J. Mulder 提出蛋白质这个名词时,他就明确指出:在植物和动物中存 在这样一种物质,毫不怀疑它是生物体中已知的最重要的物质,如果没有它,在我们这个 星球上生命则是不可能存在的。因此,蛋白质有着极其重要的生物学意义。 1 生物催化功能: 蛋白质的一个最重要的生物学功能是作为有机体新陈代谢的催化剂 ——酶。几乎所有的酶都是蛋白质。生物体内的各种化学反应几乎都是在相应的酶参与下 进行的。 2 结构蛋白: 蛋白质另一个主要的生物学功能是作为有机体的结构成分。在高等动物 里,胶原纤维是主要的细胞外结构蛋白,参与结缔组织和骨骼作为身体的支架。细胞里的 片层结构,如细胞膜、线粒体、叶绿体和内质网等都是由不溶性蛋白质与脂质组成的。 3 运输功能。脊椎动物的血红蛋白和无脊椎动物中的血蓝蛋白,某些色素蛋白如细胞色 素 c 等起传递电子的作用。 4 收缩功能:某些蛋白质与生物的运动有关,如肌球蛋白(myosin)和肌动蛋白(actin)是肌 肉收缩系统的必要成分。细菌的鞭毛或纤毛蛋白也能产生类似的活动。近年来发现,在非 肌肉的运动系统中普遍存在着运动蛋白。 有些蛋白质具有贮藏氨基酸的功能,作为有机体及其胚胎或幼体生长发育的原料,如 蛋类中的卵清蛋白(ovalbumin)、乳类中的酪蛋白(casein)、小麦种子中的麦醇溶蛋白等。 5 还有一些蛋白质具有激素的功能,对生物体内的新陈代谢起调节作用。如胰岛素参与 血糖的调节,能降低血液中葡萄糖的含量。 6免疫保护功能: 生物体防御体系中的抗体(antibody)也是蛋白质。它能识别病毒、 细菌以及其它机体的细胞,并与之相结合而排除外来物质对有机体的干扰,起到保护机体 的作用。 近代分子生物学的研究还表明,蛋白质在遗传信息的控制、细胞膜的通透性,以及高 等动物的记忆、识别机构等方面都起到重要作用。 二、蛋白质的元素组成 蛋白质是含氮的有机化合物,其含氮量占生物组织中一切含氮物质的绝大部分。氮元 素是蛋白质区别于糖和脂肪的特征性元素,根据对大多数蛋白质的氮元素分析,其氮元素 的含量都相当接近,一般在 15%~17%,平均为 16%,即 100g蛋白质中含有 16g 氮。这是 凯氏(Kjedahl)定氮法测定蛋白质含量的计算基础。 蛋白质含量=蛋白氮×6 .25

式中:6.25一16%的倒数,每测定1g氮相当于6.25g的蛋白质。 蛋白质除含有氮元素外,含有下述几种主要元素:C:50%:H:7%:0:23%: S:0%3%。有些蛋白质含有少量的磷,还有些蛋白质含有微量的金属元素,例如铁、铜、 锰、锌等。 三、蛋白质的分类 蛋白质可以按不同的方法分类。作为分类的依据主要有:分子的形状或空间构象:分 子的溶解性:分子的组成情况:功能。 1组成成分:单纯蛋白质一单纯蛋白不含有非蛋白质部分。这类蛋白质水解后的最终 产物只有氨基酸。单纯蛋白质按其溶解性质的不同可分 为白蛋白(或清蛋白)、球蛋白、谷蛋白、醇溶蛋白、精 蛋白、组蛋白以及硬蛋白等。 结合蛋白质一结合蛋白是指由单纯蛋白和非蛋白成分结合而成的蛋白质, 包括核蛋白、色蛋白、磷蛋白、糖蛋白等。 2按照分子的形状或空间构象:可将蛋白质分为纤维状蛋白和球状蛋白两大类。 纤维状蛋白分子很不对称,形状类似纤维。有的纤维状蛋白能溶于水,如肌肉的结构蛋白 和血纤维蛋白原:有的纤维状蛋白不溶于水,如角蛋白、丝心蛋白以及胶原蛋白等。 球状蛋白质分子的形状接近球形,空间构象比纤维状蛋白复杂。球状蛋白质的溶解性较好 能结晶,生物体内的蛋白质大多数属于这一类。 3按照蛋白质的功能,则可划分为酶蛋白、结合蛋白、运输蛋白、受体蛋白、调节蛋白、 防御蛋白、贮存蛋白、毒蛋白等。 上述蛋白质的分类并不是绝对的,彼此间是有联系的。例如,组蛋白属于单纯蛋白,若 它和DNA结合在一起时,则把它们合称为核蛋白,就属于结合蛋白类。 第二节氨基酸 蛋白质是一类含氮的生物大分子,结构复杂,功能多样。经酸、碱或蛋白酶处理,使 蛋白质彻底水解可以得到各种氨基酸。现在已证明氨基酸是蛋白质的基本组成单位,组成 蛋白质的氨基酸共有20种。组成蛋白质的囪基酸称为蛋白质氨基酸。 目前从各种生物体中发现的氨基酸己有180多种,除去组成蛋白质的20种氨基酸外, 其余氨基酸被称为非蛋白质氨基酸。 一、蛋白质氨基酸的一般结构特点及其分类 氨基酸是含有氨基及羧基的有机化合物。从蛋白质水解产物中分离出来的常见的20 种氨基酸除脯氨酸外,其余19种氨基酸在结构上的共同特点是与羧基相邻的α-碳原子上都 有一个氨基,因而称为-氨基酸。结构通式如下:
33 式中:6 .25—16%的倒数,每测定1g 氮相当于6 .25g 的蛋白质。 蛋白质除含有氮元素外,含有下述几种主要元素:C:50%; H:7%;O:23% ; S:0%~3%。有些蛋白质含有少量的磷,还有些蛋白质含有微量的金属元素,例如铁、铜、 锰、锌等。 三、蛋白质的分类 蛋白质可以按不同的方法分类。作为分类的依据主要有:分子的形状或空间构象;分 子的溶解性;分子的组成情况;功能。 1 组成成分:单纯蛋白质-单纯蛋白不含有非蛋白质部分。这类蛋白质水解后的最终 产物只有氨基酸。单纯蛋白质按其溶解性质的不同可分 为白蛋白(或清蛋白)、球蛋白、谷蛋白、醇溶蛋白、精 蛋白、组蛋白以及硬蛋白等。 结合蛋白质-结合蛋白是指由单纯蛋白和非蛋白成分结合而成的蛋白质, 包括核蛋白、色蛋白、磷蛋白、糖蛋白等。 2 按照分子的形状或空间构象:可将蛋白质分为纤维状蛋白和球状蛋白两大类。 纤维状蛋白分子很不对称,形状类似纤维。有的纤维状蛋白能溶于水,如肌肉的结构蛋白 和血纤维蛋白原;有的纤维状蛋白不溶于水,如角蛋白、丝心蛋白以及胶原蛋白等。 球状蛋白质分子的形状接近球形,空间构象比纤维状蛋白复杂。球状蛋白质的溶解性较好, 能结晶,生物体内的蛋白质大多数属于这一类。 3 按照蛋白质的功能,则可划分为酶蛋白、结合蛋白、运输蛋白、受体蛋白、调节蛋白、 防御蛋白、贮存蛋白、毒蛋白等。 上述蛋白质的分类并不是绝对的,彼此间是有联系的。例如,组蛋白属于单纯蛋白,若 它和 DNA 结合在一起时,则把它们合称为核蛋白,就属于结合蛋白类。 第二节 氨基酸 蛋白质是一类含氮的生物大分子,结构复杂,功能多样。经酸、碱或蛋白酶处理,使 蛋白质彻底水解可以得到各种氨基酸。现在已证明氨基酸是蛋白质的基本组成单位,组成 蛋白质的氨基酸共有 20 种。组成蛋白质的氨基酸称为蛋白质氨基酸。 目前从各种生物体中发现的氨基酸已有 180 多种,除去组成蛋白质的20 种氨基酸外, 其余氨基酸被称为非蛋白质氨基酸。 一、蛋白质氨基酸的一般结构特点及其分类 氨基酸是含有氨基及羧基的有机化合物。从蛋白质水解产物中分离出来的常见的 20 种氨基酸除脯氨酸外,其余 19 种氨基酸在结构上的共同特点是与羧基相邻的-碳原子上都 有一个氨基,因而称为-氨基酸。结构通式如下:

R -C00H R 000 NH: 非解离形式 两性离子形式 从结构上看,除甘氨酸外,所有a-氨基酸的a-碳原子都是不对称碳原子(asymmetri carbon)或称手性中心,因此都具有旋光性,都能使偏振光平面向左或向右旋转,左旋通 常用(一)表示,右旋通常用(十)表示。其次每种氨基酸都有D和L型两种立体异构体, 这是与甘油醛相比较确定的。书写时将酸基写在-碳原子的上瑞,则怎基在左边的为L-型, 氢基在右边的为D型(如图31)。从蛋白质水解得到的-氨基酸都属于L型的,所以 习惯上书写氨基酸都不标明构型和旋光方向。 从α氨基酸的结构通式可以知道,各种α氨基酸的区别就在于侧链R基团的不同,即 是说,不同的氨基酸有不同的R基团。这样,组成蛋白质的0种常见氢基酸可以按照R 基的化学结构或极性大小进行分类。在这里,我们将按照各种氨基酸侧链R基团的极性差 别进行分类。这对于认识蛋白质的性质、结构与功能更为有利。按照这种分类方法可将氨 基豫分为四大类: 1即非极性或疏水性的侧链R基氨基酸:这一组中共有8种氨基酸。4种带有脂肪烃侧链 的氨基酸,即因氨酸(Ala)鳜氨酸(al人亮氨酸(Lu) 和异亮氨酸le:2种含芳香环氨基酸:苯丙氨酸Phe) 和色氨酸Tp1种含硫氨基酸即甲疏氨酸(Mt):1种亚氨基酸:脯氨酸Po) 。这组氨基酸在水中的溶解度比极性R基氨基酸小。其中以丙氨酸的R基疏水性最小 2极性但不带电荷的R基氨基酸:这一组中有7种氨基酸。这组氨基酸比非极性R基 氨基酸易溶于水。它们的侧链中含有不解离的极性基,能与水形成氢键。丝氨酸S 、苏氨酸Th和酪氨酸工y中侧链的极性是由于它们的羟基造成的:天冬酰胺Asn和谷氨 酰胺G血R基极性是它们的酰胺基引起的:半胱氨酸Cs则是由于含有巯基的像故。甘氢 酸G业的侧链介于极性与非极性之间,有时也把它归入非极性类,但是它的R基只不过是 个氢原子,对极性强的-氨基和-酸景影响极小。这一组氨基酸中半胱氨酸和略氨酸的 R基极性最强。半胱氨酸中的巯基和酪氨酸中的酚羟基,虽然在pH7时电离很弱,但与 这组氨基酸中的其他氨基酸侧链相比失去质子的领向大得多。 3带正电荷的R基氨基酸:这一类的是两种酸性氨基酸天冬氨酸A5p和谷氨酸GC山,它们 都含有两个羧基,并且第二个羧基在H值6~7范围内也完全解离,因此分子带负电荷。 4带负电荷的R基氢基酸:这一类氨基酸在pH7时携带净正电荷,又叫碱性氨基酸。熟 氨酸Lys除a-氨基外,在脂肪链的位置上还有一个氨基:精氨酸Ag含有一个带正电荷 的胍基:组氨酸His有一个咪唑基在pH-6.0时,组氨酸分子50%以上质子化,但在pH=7.0 时,质子化的分子不到10%。组氨酸是R基的pK值在7附近的唯一种氨基酸。 注意,这些氨基酸的解离条件是指在细胞生理H值范围内
34 C COOH H NH2 R COO NH3 C H R + 非解离形式 两性离子形式 从结构上看,除甘氨酸外,所有-氨基酸的-碳原子都是不对称碳原子(asymmetric carbon)或称手性中心,因此都具有旋光性,都能使偏振光平面向左或向右旋转,左旋通 常用(-)表示,右旋通常用(+)表示。其次每种氨基酸都有 D-和 L-型两种立体异构体, 这是与甘油醛相比较确定的。书写时将羧基写在-碳原子的上端,则氨基在左边的为 L-型, 氨基在右边的为 D-型(如图 3-1)。从蛋白质水解得到的 - 氨基酸都属于 L-型的,所以 习惯上书写氨基酸都不标明构型和旋光方向。 从-氨基酸的结构通式可以知道,各种-氨基酸的区别就在于侧链 R 基团的不同,即 是说,不同的氨基酸有不同的 R 基团。这样,组成蛋白质的 20 种常见氨基酸可以按照 R 基的化学结构或极性大小进行分类。在这里,我们将按照各种氨基酸侧链 R 基团的极性差 别进行分类。这对于认识蛋白质的性质、结构与功能更为有利。按照这种分类方法可将氨 基酸分为四大类: 1 即非极性或疏水性的侧链 R 基氨基酸; 这一组中共有 8 种氨基酸。4 种带有脂肪烃侧链 的氨基酸,即丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu) 和异亮氨酸(Ile);2 种含芳香环氨基酸:苯丙氨酸(Phe) 和色氨酸(Trp);1 种含硫氨基酸即甲硫氨酸(Met);1 种亚氨基酸:脯氨酸(Pro) 。这组氨基酸在水中的溶解度比极性 R 基氨基酸小。其中以丙氨酸的 R 基疏水性最小 2 极性但不带电荷的 R基氨基酸;这一组中有 7 种氨基酸。这组氨基酸比非极性 R 基 氨基酸易溶于水。它们的侧链中含有不解离的极性基,能与水形成氢键。丝氨酸 Ser 、苏氨酸 Thr和酪氨酸 Tyr 中侧链的极性是由于它们的羟基造成的;天冬酰胺 Asn和谷氨 酰胺 Gln R 基极性是它们的酰胺基引起的;半胱氨酸 Cys 则是由于含有巯基的缘故。甘氨 酸 Gly 的侧链介于极性与非极性之间,有时也把它归入非极性类,但是它的 R 基只不过是 一个氢原子,对极性强的-氨基和-羧基影响极小。这一组氨基酸中半胱氨酸和酪氨酸的 R 基极性最强。半胱氨酸中的巯基和酪氨酸中的酚羟基,虽然在 pH=7 时电离很弱,但与 这组氨基酸中的其他氨基酸侧链相比失去质子的倾向大得多。 3 带正电荷的 R基氨基酸;这一类的是两种酸性氨基酸天冬氨酸 Asp和谷氨酸 Glu,它们 都含有两个羧基,并且第二个羧基在 pH 值 6~7 范围内也完全解离,因此分子带负电荷。 4 带负电荷的 R 基氨基酸:这一类氨基酸在 pH=7 时携带净正电荷,又叫碱性氨基酸。赖 氨酸 Lys 除-氨基外,在脂肪链的 位置上还有一个氨基;精氨酸 Arg含有一个带正电荷 的胍基;组氨酸 His有一个咪唑基。在pH=6.0时,组氨酸分子 50%以上质子化,但在pH=7.0 时,质子化的分子不到 10%。组氨酸是 R 基的 pK 值在 7 附近的唯一种氨基酸。 注意,这些氨基酸的解离条件是指在细胞生理 pH 值范围内
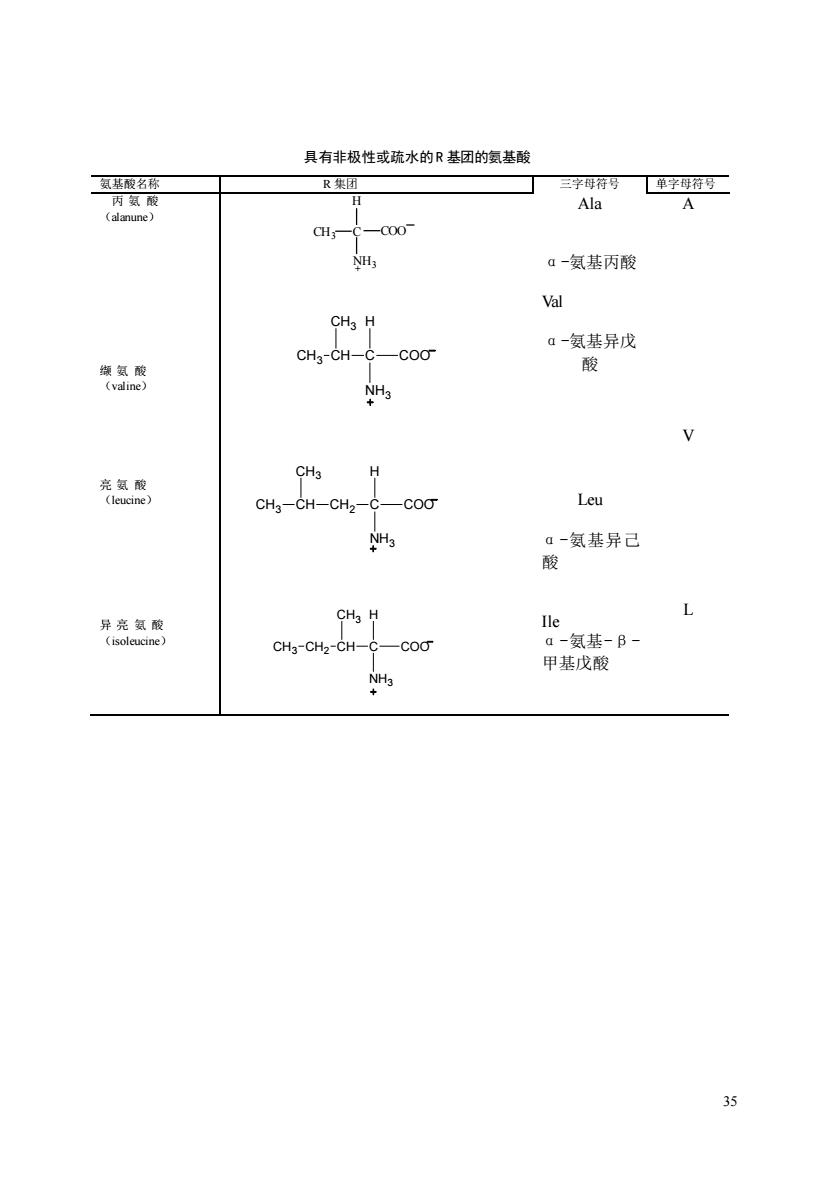
具有非极性或疏水的R基团的氨基酸 氨基酸名称 R集团 三字母行号单字母狩号 H Ala A CH;-C-C00- a-氨基丙酸 Val CHs H CH-CH-C- a一氨基异戊 光氢 酸 CHa-CH-CHz-( Leu H 酸复套异己 L CH3-CHz-CH a-氨基-B- 甲基戊酸
35 具有非极性或疏水的R 基团的氨基酸 氨基酸名称 R 集团 三字母符号 单字母符号 丙 氨 酸 (alanune) 缬 氨 酸 (valine) 亮 氨 酸 (leucine) 异 亮 氨 酸 (isoleucine) COO NH3 CH3 C H + Ala α-氨基丙酸 Val α-氨基异戊 酸 Leu α-氨基异己 酸 Ile α-氨基-β- 甲基戊酸 A V L C H COO NH3 CH CH3 CH3 CH CH3 CH3 CH2 C H COO NH3 C H COO NH3 CH CH3 CH3 CH2
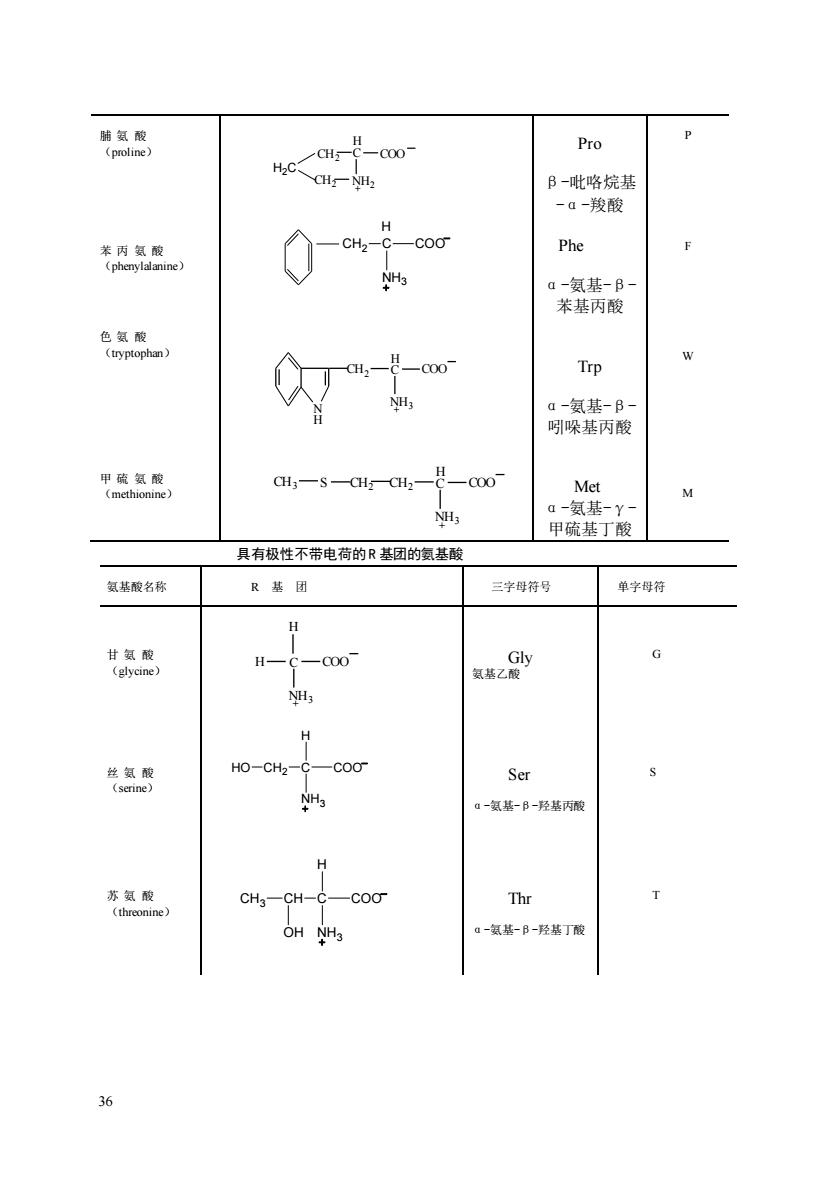
转氯隐 Pro P B-吡咯烷基 -ā-段酸 表良 09 Phe a-氨基-B 苯基丙酸 Trp a-氨基-B 吲哚基丙酸 CH3-S-CH Met a-氨基-Y 甲硫基丁酸 具有极性不带电荷的R基团的氨基酸 氨基酸名称 R燕团 三学母符号 单学母符 G NH 光氢丽 Ho-CH2-CCoO Ser NH3 一氨基-B-羟基丙酸 H Thr a-氢基-B-羟格丁酸 哈
36 脯 氨 酸 (proline) 苯 丙 氨 酸 (phenylalanine) 色 氨 酸 (tryptophan) 甲 硫 氨 酸 (methionine) C H COO NH2 CH2 CH2 H2C + N + H CH2 C H NH3 COO + CH2 C H NH3 CH3 S CH2 COO Pro β-吡咯烷基 -α-羧酸 Phe α-氨基-β- 苯基丙酸 Trp α-氨基-β- 吲哚基丙酸 Met α-氨基-γ- 甲硫基丁酸 P F W M 具有极性不带电荷的R 基团的氨基酸 氨基酸名称 R 基 团 三字母符号 单字母符 甘 氨 酸 (glycine) + C H NH3 H COO Gly 氨基乙酸 G 丝 氨 酸 (serine) Ser α-氨基-β-羟基丙酸 S 苏 氨 酸 (threonine) Thr α-氨基-β-羟基丁酸 T C H COO NH3 HO CH2 C H COO NH3 CH OH CH3 C COO NH3 CH2 H