
第十章蛋白质的酶促降解和氨基酸代谢 第一节蛋白质的酶促降解 生物体内的蛋白质是经常处于动态的变化之中,一方面在不断地合成,另一方面又在 不断地分解。例如,当种子萌发时,蛋白质发生强烈的水解,将胚乳或子叶中的储藏蛋白 质分解,形成氨基酸和其他简单含氮化合物,供幼苗形成组织时用。在植物衰老时,蛋白 质的分解亦很强烈,将营养器官的蛋白质分解成含氮化合物,转移到繁殖器官中,供幼胚 及种子的形成之所需。 蛋白质的分解对机体生命代谢的意义并不亚于蛋白质的合成。植物体为了进行正常的 生长和发育,为了适应外界条件的变化,必经常不断地形成具有不同结构与功能的各种 蛋白质。因此,早期合成的蛋白质在完成其功能之后不可避免地要分解,其分解产物将作 为合成新性质蛋白质的原料。 蛋白质的分解是在蛋白(水解)酶催化下进行的,蛋白水解酶存在于植物所有的细胞 与组织中。大量蛋白酶已被人们从植物种子、果实的生长器官中分离出来并进行了研究, 如番木瓜汁液中的木瓜蛋白酶,菠萝茎和果实中的菠萝蛋白酶,花生种子中的花生仁蛋白 酶,豌豆种子中的豌豆蛋白酶,小麦、大麦、燕麦籽粒中的相应蛋白酶。其中许多酶已制 成结品。 蛋白水解酶可分为内肽酶(肽链内切酶)和端肽酶(肽链端解酶)两大类。 (1)蛋白酶的种类和专一性蛋白酶即内肽酶(endopeptidase),水解蛋白质和多 链内部的肽键,形成各种短肽。蛋白酶具有底物专一性,不能水解所有肽键,只能对特定 氨肽静 (芳、疏) 羧肽酶 n R碱) R, 胃蛋白所餐露蛋白续 图9.1几种蛋白薛的专一性 的肽键发生作用。如木瓜蛋白酶只能作用于由碱性氨基酸以及含脂肪侧链和芳香侧链的氨 基酸所形成的肽键。几种蛋白水解酶的专一性见图91、表91。 表91几种蛋白酶作用的专一性 对R基团的要求 作用部位 点
229 第十章 蛋白质的酶促降解和氨基酸代谢 第一节 蛋白质的酶促降解 生物体内的蛋白质是经常处于动态的变化之中,一方面在不断地合成,另一方面又在 不断地分解。例如,当种子萌发时,蛋白质发生强烈的水解,将胚乳或子叶中的储藏蛋白 质分解,形成氨基酸和其他简单含氮化合物,供幼苗形成组织时用。在植物衰老时,蛋白 质的分解亦很强烈,将营养器官的蛋白质分解成含氮化合物,转移到繁殖器官中,供幼胚 及种子的形成之所需。 蛋白质的分解对机体生命代谢的意义并不亚于蛋白质的合成。植物体为了进行正常的 生长和发育,为了适应外界条件的变化,必须经常不断地形成具有不同结构与功能的各种 蛋白质。因此,早期合成的蛋白质在完成其功能之后不可避免地要分解,其分解产物将作 为合成新性质蛋白质的原料。 蛋白质的分解是在蛋白(水解)酶催化下进行的,蛋白水解酶存在于植物所有的细胞 与组织中。大量蛋白酶已被人们从植物种子、果实的生长器官中分离出来并进行了研究, 如番木瓜汁液中的木瓜蛋白酶,菠萝茎和果实中的菠萝蛋白酶,花生种子中的花生仁蛋白 酶,豌豆种子中的豌豆蛋白酶,小麦、大麦、燕麦籽粒中的相应蛋白酶。其中许多酶已制 成结晶。 蛋白水解酶可分为内肽酶(肽链内切酶)和端肽酶(肽链端解酶)两大类。 (1)蛋白酶的种类和专一性 蛋白酶即内肽酶(endopeptidase),水解蛋白质和多肽 链内部的肽键,形成各种短肽。蛋白酶具有底物专一性,不能水解所有肽键,只能对特定 H2N CH Rn C O N H CH C O N R1 R1 ' CH C O N H CH R2 C O N CH C O N H CH H H R R3 C O N Rm CH COOH H ③ ④ ⑥ ① ⑤ ② 氨肽酶 (芳、疏) 羧肽酶 胃蛋白酶 胰凝乳 蛋白酶 胰蛋白酶 枯草杆菌 蛋白酶 (碱) (疏) 图 9-1 几种蛋白酶的专一性 的肽键发生作用。如木瓜蛋白酶只能作用于由碱性氨基酸以及含脂肪侧链和芳香侧链的氨 基酸所形成的肽键。几种蛋白水解酶的专一性见图 9-1、表 9-1。 表 9-1 几种蛋白酶作用的专一性 酶 对 R 基团的要求 作用部位
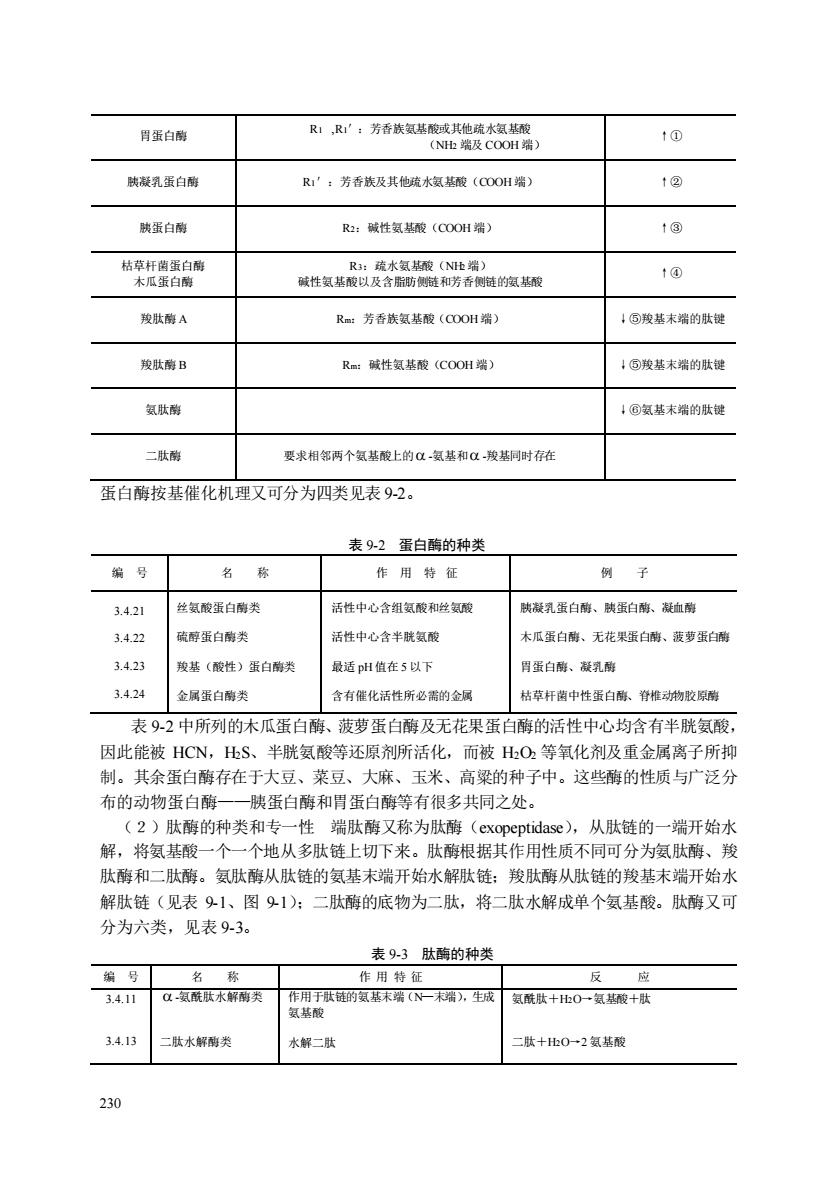
胃蛋白酵 R1,R1”:芳香族氨基酸或其他疏水氨酸 1① (N出及COOH端 胰凝乳蛋白酶 R':芳香长及其他水氨基酸(COO端) 1② 胰蛋白酶 Ra:碱性氨基酸(C0OH端) 1@ 枯来盛香胸 1④ 骏肽酶A Ra:芳香族氨基酸(COO州端) :⑤骏基术端的肽键 R=碱性氨酸(COOH端) !⑤骏基末端的肽键 氨肽酵 !©氨基末端的肤健 要求相邻两个氨基酸上的α氨基和α我基同时存在 蛋白酶按基催化机理又可分为四类见表92。 表92蛋白酶的种类 编号 名称 作用特征 例子 3.4.21 丝氨酸蛋白酶类 活性中心含组氨酸和丝氨酸 肤凝乳蛋白南、碳蛋白南、凝血南 3.42 硫醇蛋白南类 活性中心含半胱氨酸 木瓜蛋白酶、无花果蛋白带、蔽萝蛋白端 342 羧基(酸性)蛋白酶类 最适pH值在5以下 胃蛋白酶、凝乳群 3.424 金属蛋白南类 含有催化活性所必需的金属 枯草杆齿中性蛋白酶、脊椎动物胶原脑 表9-2中所列的木瓜蛋白酶、菠萝蛋白酶及无花果蛋白酶的活性中心均含有半胱氨酸, 因此能被HCN,出S、半胱氨酸等还原剂所活化,而被HO2等氧化剂及重金属离子所抑 制。其余蛋白酶存在于大豆、菜豆、大麻、玉米、高粱的种子中。这些酶的性质与广泛分 布的动物蛋白酶一一胰蛋白酶和胃蛋白酶等有很多共同之处。 (2)肽酶的种类和专一性端肽酶又称为肽酶(exopeptidase),从肽链的一端开始水 解,将氨基酸一个一个地从多肽链上切下来。肽酶根据其作用性质不同可分为氨肽酶、羧 肽酶和二肽酶。氨肽酶从肽链的氨基末端开始水解肚链:羧肽酶从肽链的羧基末端开始水 解肽链(见表91、图91):二肽酶的底物为二肽,将二肽水解成单个氨基酸。肽酶又可 分为六类,见表9-3。 表93肽酶的种类 编号 作用特 应 3.4.11 -氨酰肽水解南类 氨酰肽十O→氨华酸+肽 34.13 肽水解酶类 水解二肽 :肽十比0一2氨基酸 230
230 胃蛋白酶 R1 ,R1′:芳香族氨基酸或其他疏水氨基酸 (NH2 端及 COOH 端) ↑① 胰凝乳蛋白酶 R1′:芳香族及其他疏水氨基酸(COOH 端) ↑② 胰蛋白酶 R2:碱性氨基酸(COOH 端) ↑③ 枯草杆菌蛋白酶 木瓜蛋白酶 R3:疏水氨基酸(NH2端) 碱性氨基酸以及含脂肪侧链和芳香侧链的氨基酸 ↑④ 羧肽酶 A Rm:芳香族氨基酸(COOH 端) ↓⑤羧基末端的肽键 羧肽酶 B Rm:碱性氨基酸(COOH 端) ↓⑤羧基末端的肽键 氨肽酶 ↓⑥氨基末端的肽键 二肽酶 要求相邻两个氨基酸上的 -氨基和 -羧基同时存在 蛋白酶按基催化机理又可分为四类见表 9-2。 表 9-2 蛋白酶的种类 编 号 名 称 作 用 特 征 例 子 3.4.21 3.4.22 3.4.23 3.4.24 丝氨酸蛋白酶类 硫醇蛋白酶类 羧基(酸性)蛋白酶类 金属蛋白酶类 活性中心含组氨酸和丝氨酸 活性中心含半胱氨酸 最适 pH 值在 5 以下 含有催化活性所必需的金属 胰凝乳蛋白酶、胰蛋白酶、凝血酶 木瓜蛋白酶、无花果蛋白酶、菠萝蛋白酶 胃蛋白酶、凝乳酶 枯草杆菌中性蛋白酶、脊椎动物胶原酶 表 9-2 中所列的木瓜蛋白酶、菠萝蛋白酶及无花果蛋白酶的活性中心均含有半胱氨酸, 因此能被 HCN,H2S、半胱氨酸等还原剂所活化,而被 H2O2 等氧化剂及重金属离子所抑 制。其余蛋白酶存在于大豆、菜豆、大麻、玉米、高粱的种子中。这些酶的性质与广泛分 布的动物蛋白酶——胰蛋白酶和胃蛋白酶等有很多共同之处。 (2)肽酶的种类和专一性 端肽酶又称为肽酶(exopeptidase),从肽链的一端开始水 解,将氨基酸一个一个地从多肽链上切下来。肽酶根据其作用性质不同可分为氨肽酶、羧 肽酶和二肽酶。氨肽酶从肽链的氨基末端开始水解肽链;羧肽酶从肽链的羧基末端开始水 解肽链(见表 9-1、图 9-1);二肽酶的底物为二肽,将二肽水解成单个氨基酸。肽酶又可 分为六类,见表 9-3。 表 9-3 肽酶的种类 编 号 名 称 作 用 特 征 反 应 3.4.11 3.4.13 -氨酰肽水解酶类 二肽水解酶类 作用于肽链的氨基末端(N—末端),生成 氨基酸 水解二肽 氨酰肽+H2O→氨基酸+肽 二肽+H2O→2 氨基酸

34.14 二肽基肽水解南类 作用于多肽髓的氨基末端《末端),生 二肽基多肽十比0一二肽+多肤 成二肽 34.15 肽基二肽水解酶类 多肽基二肽十O→多肽十二肚 3.4.1 丝氨酸羧肽傅类 作用于多肽链的骏基末生成氨 胜基L氨基酸+HO→肚+L氨基酸 34.1万 作用于多肽链的我基末装生成氨基酸 肽基L氨基酸+0→肽L-氨基酸 3,蛋白质的酶促降解在内肽酶、羧肽酶、氨肽酶与二肽酶的共同作用下,蛋白质 水解成蛋白际、胨、多肽,最后完全分解成氨基酸,即 蛋白质内→际、陈、内→多肤 荣肤而→氨基酸 这些氨基酸可以转移到蛋白质合成的地方用作合成新蛋白质的原料,也可以经脱氨作 用形成氨和有机酸,或参加其他反应。 第二节氨基酸的分解与转化 氨基酸的分解反应包括脱氨基作用、脱羧作用与羟基化作用等。 一、脱氨基作用 高等植物的脱氨基作用在发芽的种子、幼龄植物及正发育的组织中最为强烈。脱氨基 作用是氨基酸分解的最重要的一步,包括氧化脱氨基、非氧化脱氨基、转氨基、联合脱氨 基、脱酰胺基等作用。 (1)氧化脱氨基(oxidative deamination)氧化脱氨基是高等植物最基本的脱氨基方 式,氨基酸脱去α-氨基后转变成相应的酮酸: R—CH-COOH -C00H +1/202→ +NH3 NH 禾本科、豆科作物幼苗及马铃薯块茎中,主要是二羧基氨基酸(天冬氨酸和谷氨酸) 的氧化脱氨。如谷氨酸在谷氨酸脱氢酶的催化下,氧化脱氨生成α-酮戊二酸: 231
231 3.4.14 3.4.15 3.4.16 3.4.17 二肽基肽水解酶类 肽基二肽水解酶类 丝氨酸羧肽酶类 金属羧肽酶类 作用于多肽链的氨基末端(N-末端),生 成二肽 作用于多肽链的羧基末端(C-末端),生 成二肽 作用于多肽链的羧基末端生成氨基酸 作用于多肽链的羧基末端生成氨基酸 二肽基多肽+H2O→二肽+多肽 多肽基二肽+H2O→多肽+二肽 肽基-L-氨基酸+H2O→肽+L-氨基酸 肽基-L-氨基酸+H2O→肽+L-氨基酸 3.蛋白质的酶促降解 在内肽酶、羧肽酶、氨肽酶与二肽酶的共同作用下,蛋白质 水解成蛋白眎、胨、多肽,最后完全分解成氨基酸,即 蛋白质 ⎯内肽酶 ⎯⎯→ 眎、胨、 ⎯内肽酶 ⎯⎯→ 多肽 ⎯端肽酶 ⎯⎯→ 氨基酸 这些氨基酸可以转移到蛋白质合成的地方用作合成新蛋白质的原料,也可以经脱氨作 用形成氨和有机酸,或参加其他反应。 第二节 氨基酸的分解与转化 氨基酸的分解反应包括脱氨基作用、脱羧作用与羟基化作用等。 一、脱氨基作用 高等植物的脱氨基作用在发芽的种子、幼龄植物及正发育的组织中最为强烈。脱氨基 作用是氨基酸分解的最重要的一步,包括氧化脱氨基、非氧化脱氨基、转氨基、联合脱氨 基、脱酰胺基等作用。 (1)氧化脱氨基(oxidative deamination) 氧化脱氨基是高等植物最基本的脱氨基方 式,氨基酸脱去 -氨基后转变成相应的酮酸: 禾本科、豆科作物幼苗及马铃薯块茎中,主要是二羧基氨基酸(天冬氨酸和谷氨酸) 的氧化脱氨。如谷氨酸在谷氨酸脱氢酶的催化下,氧化脱氨生成 -酮戊二酸: CH COOH NH2 R C COOH O R +1/2O2 + NH3
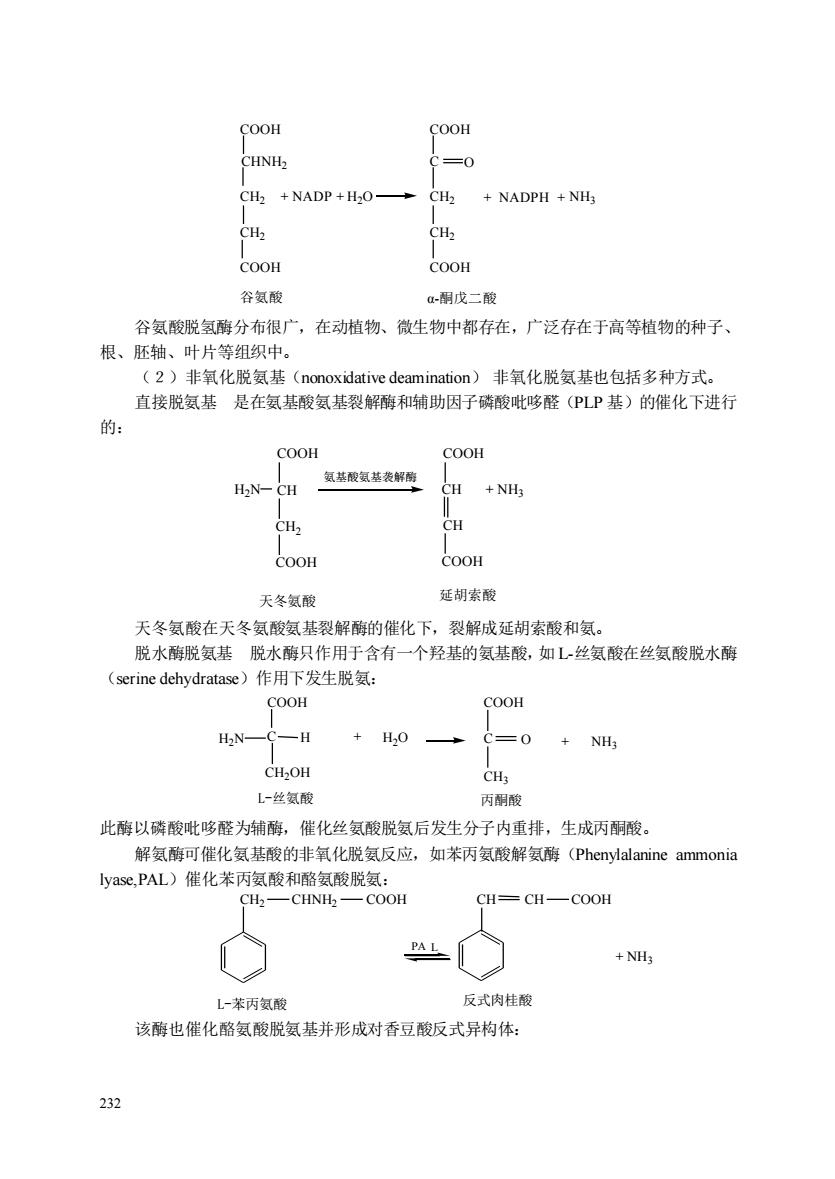
COOH COOH C=0 CH2 +NADP+H2O- CH2 NADPH+NH CHz COOH COOH 谷氨酸 a-丽戊二酸 谷氨酸脱氢酶分布很广,在动植物、微生物中都存在,广泛存在于高等植物的种子、 根、胚轴、叶片等组织中。 (2)非氧化脱氨基(nonoxidative deamination)非氧化脱氨基也包括多种方式。 直接脱氨基是在氨基酸氨基裂解酶和辅助因子磷酸吡哆醛(PLP基)的催化下进行 的: OOH COOH 氨基酸氨基袭解酯 CH CH +NH3 H CH COOH COOH 天冬氨酸 延胡索酸 天冬氨酸在天冬氨酸氨基裂解酶的催化下,裂解成延胡索酸和氨。 脱水酶脱氨基脱水爵只作用于含有一个羟基的氨基酸,如L丝氨酸在丝氨酸脱水酶 (serine dehydratase)作用下发生脱氨: COOH COOH HN— C一H +H0 =0 CH2OH L-丝氨酸 丙酮酸 此酶以磷酸吡哆醛为辅酶,催化丝氨酸脱氨后发生分子内重排,生成丙酮酸。 解氨酶可催化氨基酸的非氧化脱氨反应,如苯丙氨酸解氨酶(Phenylalanine ammonia yasC,PAL)催化苯丙氨酸和酪氨酸脱氨: CH2一CHNH一COOH CH=CH-COOH PAL L一苯丙氨 反式肉桂酸 该酶也催化酪氨酸脱氨基并形成对香豆酸反式异构体: 232
232 COOH CHNH2 CH2 CH2 + NADP + COOH C O CH2 CH2 COOH + NADPH + COOH 谷氨酸 α-酮戊二酸 H2O NH3 谷氨酸脱氢酶分布很广,在动植物、微生物中都存在,广泛存在于高等植物的种子、 根、胚轴、叶片等组织中。 (2)非氧化脱氨基(nonoxidative deamination) 非氧化脱氨基也包括多种方式。 直接脱氨基 是在氨基酸氨基裂解酶和辅助因子磷酸吡哆醛(PLP 基)的催化下进行 的: COOH CH2 COOH CH CH COOH + NH3 COOH H2N CH 氨基酸氨基袭解酶 天冬氨酸 延胡索酸 天冬氨酸在天冬氨酸氨基裂解酶的催化下,裂解成延胡索酸和氨。 脱水酶脱氨基 脱水酶只作用于含有一个羟基的氨基酸,如 L-丝氨酸在丝氨酸脱水酶 (serine dehydratase)作用下发生脱氨: COOH COOH H2N C H CH2OH C NH3 CH3 L-丝氨酸 丙酮酸 + H2O O + 此酶以磷酸吡哆醛为辅酶,催化丝氨酸脱氨后发生分子内重排,生成丙酮酸。 解氨酶可催化氨基酸的非氧化脱氨反应,如苯丙氨酸解氨酶(Phenylalanine ammonia lyase,PAL)催化苯丙氨酸和酪氨酸脱氨: CH2 CHNH2 COOH CH CH COOH + NH3 L-苯丙氨酸 反式肉桂酸 PA L 该酶也催化酪氨酸脱氨基并形成对香豆酸反式异构体:
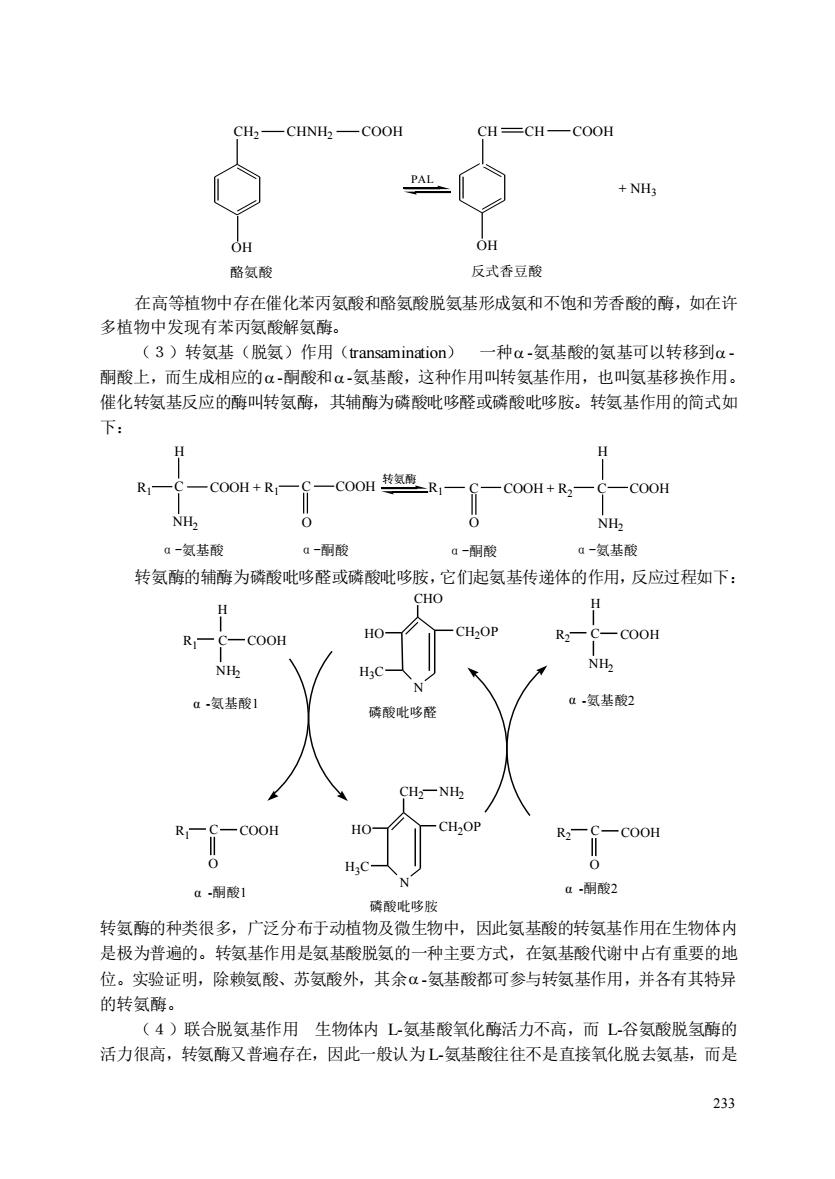
-CHNH-COOH CH=CH-COOH OH OH 酪氨酸 反式香豆酸 在高等植物中存在催化苯丙氨酸和酪氨酸脱氨基形成氨和不饱和芳香酸的酶,如在许 多植物中发现有苯丙氨酸解氨酶。 (3)转氨基(脱氨)作用(transamination)一种a-氨基酸的氨基可以转移到a- 酮酸上,而生成相应的α-酮酸和α-氨基酸,这种作用叫转氨基作用,也叫氨基移换作用。 催化转氨基反应的酶叫转氨酶,其辅酶为磷酸吡哆醛或磷酸吡哆胺。转氨基作用的简式如 下: H COOH+R- NH NH, 0一氨基酸 a-酸 a-酮酸 a一氨基酸 转氨酶的辅酶为磷酸吡哆醛或磷酸吡哆胺,它们起氨基传递体的作用,反应过程如下 H CH-O COOH NH 氨基酸 氨基酸 磷酸吡 -COOH g酮酸1 a酮酸2 磺酸吡哆胺 转氨酶的种类很多,广泛分布于动植物及微生物中,因此氨基酸的转氨基作用在生物体内 是极为普遍的。转氨基作用是氨基酸脱氨的一种主要方式,在氨基酸代谢中占有重要的地 位。实验证明,除赖氨酸、苏氨酸外,其余α氨基酸都可参与转氨基作用,并各有其特异 的转氨酶。 (4)联合脱氨基作用生物体内L氨基酸氧化酶活力不高,而L谷氨酸脱氢酶的 活力很高,转氨酶又普遍存在,因此一般认为L氨基酸往往不是直接氧化脱去氨基,而是 233
233 CH2 CHNH2 COOH CH CH COOH + NH3 OH OH 酪氨酸 反式香豆酸 PAL 在高等植物中存在催化苯丙氨酸和酪氨酸脱氨基形成氨和不饱和芳香酸的酶,如在许 多植物中发现有苯丙氨酸解氨酶。 (3)转氨基(脱氨)作用(transamination) 一种 -氨基酸的氨基可以转移到 - 酮酸上,而生成相应的 -酮酸和 -氨基酸,这种作用叫转氨基作用,也叫氨基移换作用。 催化转氨基反应的酶叫转氨酶,其辅酶为磷酸吡哆醛或磷酸吡哆胺。转氨基作用的简式如 下: H R1 C COOH + R1 C COOH R1 C COOH + R2 C COOH H NH2 O O NH2 转氨酶 α-氨基酸 α-酮酸 α-酮酸 α-氨基酸 转氨酶的辅酶为磷酸吡哆醛或磷酸吡哆胺,它们起氨基传递体的作用,反应过程如下: R1 C H NH2 COOH R C 1 COOH O N CHO HO CH2OP H3C N CH2 HO CH2OP H3C NH2 R2 C H NH2 COOH R C 2 COOH O α -氨基酸1 α α -氨基酸2 -酮酸1 -酮酸2 磷酸吡哆胺 磷酸吡哆醛 α 转氨酶的种类很多,广泛分布于动植物及微生物中,因此氨基酸的转氨基作用在生物体内 是极为普遍的。转氨基作用是氨基酸脱氨的一种主要方式,在氨基酸代谢中占有重要的地 位。实验证明,除赖氨酸、苏氨酸外,其余 -氨基酸都可参与转氨基作用,并各有其特异 的转氨酶。 (4)联合脱氨基作用 生物体内 L-氨基酸氧化酶活力不高,而 L-谷氨酸脱氢酶的 活力很高,转氨酶又普遍存在,因此一般认为 L-氨基酸往往不是直接氧化脱去氨基,而是