
水对强酸起不到区分作用,水能够同等程 度地将HCIO4,HC1,HNO3等强酸的质子全部 夺取过来。 选取比水的碱性弱的碱,如冰醋酸为溶剂 对水中的强酸可体现出区分效应。例如上述强 酸在冰醋酸中不完全解离,酸性强度依次为: HI>HCIO>HCI>H2SO>HNO3
水对强酸起不到区分作用,水能够同等程 度地将HClO4,HCl,HNO3等强酸的质子全部 夺取过来。 选取比水的碱性弱的碱,如冰醋酸为溶剂 对水中的强酸可体现出区分效应。例如上述强 酸在冰醋酸中不完全解离,酸性强度依次为: HI>HClO4>HCl>H2SO4>HNO3

酸越强,其共轭碱越弱; 碱越强,其共轭酸越弱。 酸性:HCIO4>H,SO4>H3PO4> HAc H,CO3>NH>H2O 碱性:CIO4<HSO4<H,PO4< Ac<HCO;<NH3 <OH
酸越强,其共轭碱越弱; 碱越强,其共轭酸越弱。 HAc H CO NH H O HClO H SO H PO 2 3 4 2 4 2 4 3 4 + 酸性: - - - - - - Ac HCO NH OH ClO HSO H PO 3 3 碱性: 4 4 2 4
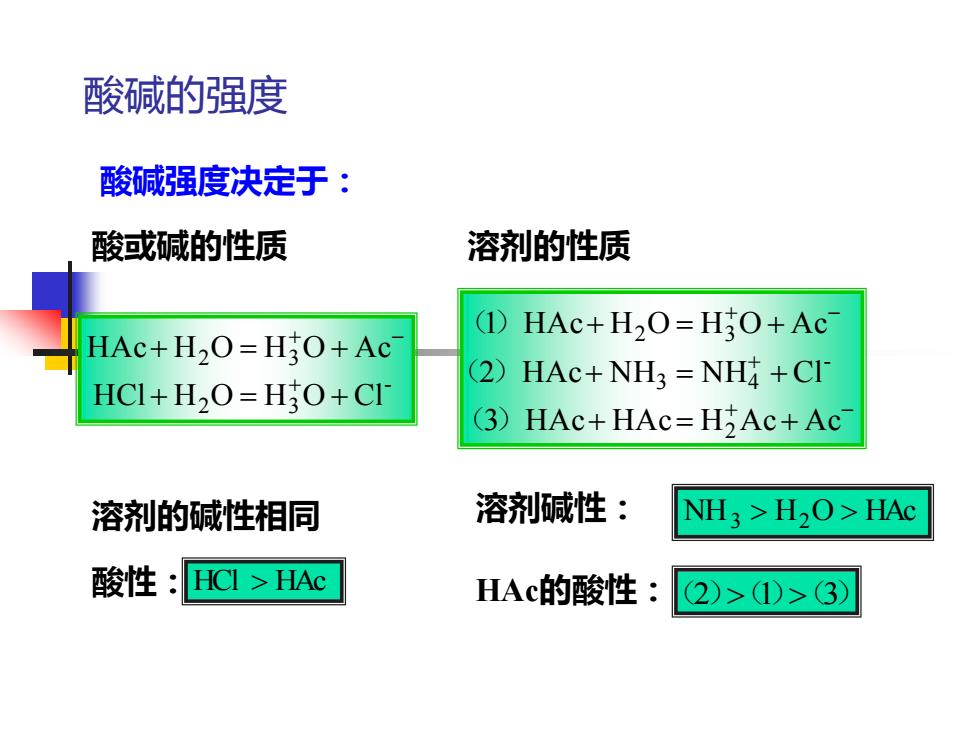
酸碱的强度 酸碱强度决定于: 酸或碱的性质 溶剂的性质 (1)HAc+H2O=HO+Ac HAc+H2O=HO+Ac (2)HAc+NH3 NH +CI HCI+H2O=H3O+CI (3)HAc+HAc=HAc+Ac 溶剂的碱性相同 溶剂碱性: NH >H2O>HAc 酸性:HCI>HAc HAc的酸性: 2)>1)>3)
酸碱的强度 酸碱强度决定于: 酸或碱的性质 溶剂的性质 - 2 3 2 3 HCl H O H O Cl HAc H O H O Ac + = + + = + + + - + - + + - + = + + = + + = + 3 HAc HAc H Ac Ac 2 HAc NH NH Cl 1 HAc H O H O Ac 2 - 3 4 2 3 ( ) ( ) () 酸性: HCl HAc 溶剂碱性: NH H O HAc 3 2 HAc的酸性: (2)(1)(3) 溶剂的碱性相同

酸碱的强度 拉平效应 区分效应 H2S04+H20=H0+S042 HCIO+HAc H;Ac+CIO HCI+H2O=H3O+CI HCI+HAc H;Ac+CI HNO3+H2O=HO+NO HNO+HAc =H,Ac+NO: 酸性: 酸性: H2SO4,HCL HNO3 均为强酸 HCIO>HCI>HNO
酸碱的强度 - 3 2 3 3 - 2 3 2 2 4 2 3 4 HNO H O H O NO HCl H O H O Cl H SO H O H O SO + = + + = + + = + + + + - 酸性: H2 SO4 ,HCl, HNO 3 均为强酸 - 3 2 3 - 2 4 2 4 HNO HAc H Ac NO HCl HAc H Ac Cl HClO HAc H Ac ClO + = + + = + + = + + + + - 酸性: HClO 4 HCl HNO3 拉平效应 区分效应

一般以水作为溶剂来比较各种酸和碱释放和接受 质子的能力。 HAc(aq)+H2O(1)=H3O(aq)+Ac(aq) △rGm-369.53-273.19-273.19-369.4 △rGm=-RTIn Ka0 Ka9=[H,O][Ac]/HAc]=1.76×10-5 Ka为弱酸HAc的标准平衡常数,酸度常数(acidity constant)
一般以水作为溶剂来比较各种酸和碱释放和接受 质子的能力。 HAc(aq)+H2O(l)=H3O+ (aq)+Ac- (aq) rGm -369.53 -273.19 -273.19 -369.4 rGm = - RTln Ka Ka =[H3O+ ][Ac- ]/[HAc]=1.76×10-5 Ka 为弱酸HAc的标准平衡常数,酸度常数(acidity constant)