
④非水溶液中的酸碱反应,也是离子酸碱 的质子转移反应。例如NH4C的生成: H+ HCI 十 NH,- NH 十 CI 酸(1) 碱(2) 酸(2) 碱(1) 液氨中的酸碱中和反应: H+ NH,CI+NaNH, 2NH,NaCl 酸(1) 碱(2) 酸(2) 碱1)
④ 非水溶液中的酸碱反应,也是离子酸碱 的质子转移反应。例如NH4Cl的生成: H+ 液氨中的酸碱中和反应: H+ + - HCl + N H N H + Cl 3 4 NH Cl NaNH 2NH NaCl 4 + 2 3 + 酸(1) 碱(2) 酸(2) 碱(1) 酸(1) 碱(2) 酸(2) 碱(1)

质子理论扩大了酸碱的范围,包括了许多盐类 可以是分子型也可以是离子型的. 酸碱质子理论认为酸和碱是通过给出和接 受质子的共轭关系相互依存和相互转化的,每一 个酸碱)要表现出它的酸(碱)性必须有另外一 个碱(酸)同时存在才行。 有酸才有碱,有碱才有酸, 酸中有碱,碱可变酸
质子理论扩大了酸碱的范围,包括了许多盐类, 可以是分子型也可以是离子型的. 酸碱质子理论认为酸和碱是通过给出和接 受质子的共轭关系相互依存和相互转化的,每一 个酸(碱)要表现出它的酸(碱)性必须有另外一 个碱(酸)同时存在才行。 有酸才有碱,有碱才有酸, 酸中有碱,碱可变酸
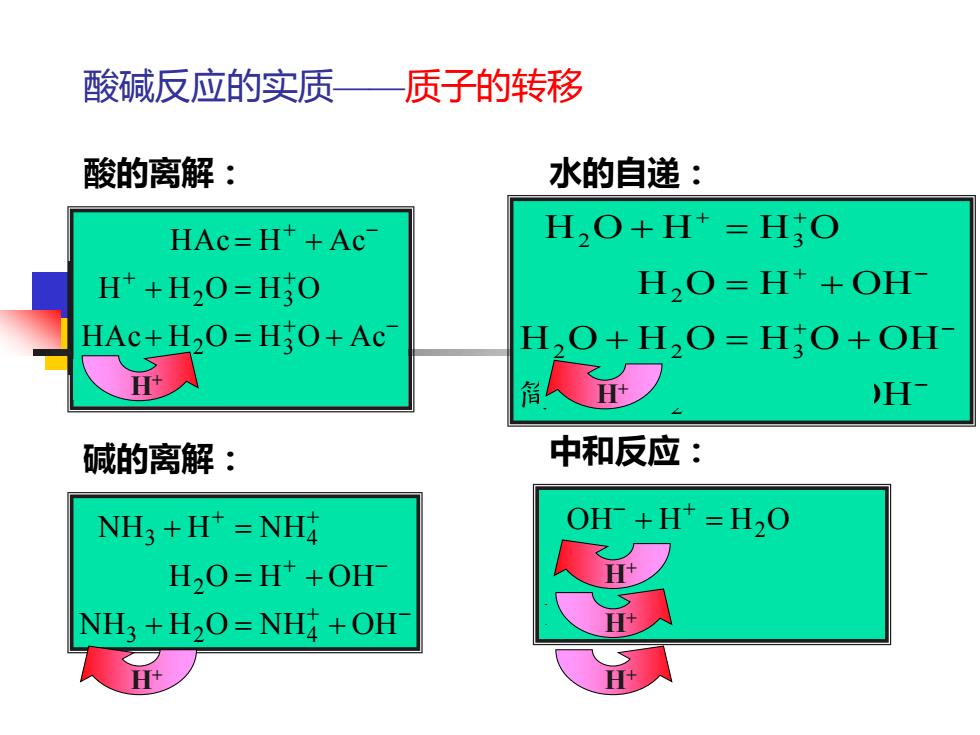
酸碱反应的实质—质子的转移 酸的离解: 水的自递: HAc=H*+Ac H,O+H=H:O H*+H2O=H3O H,O=H+OH HAc+H2O=H3O+Ac H2O+H,O=H;O+OH- H 碱的离解: 中和反应: NH3+H=NH OH+H*=H,O H,O=H*+OH NH3+H2O=NH4+OH H+
酸碱反应的实质——质子的转移 酸的离解: + - + - + + + - = + + = + + = = + HAc H Ac HAc H O H O Ac H H O H O HAc H Ac 2 3 2 3 简化: 碱的离解: + - + - + + + = + = + + = NH H O NH OH H O H OH NH H NH 3 2 4 2 3 4 水的自递: + - + - + - + + = + + = + = + + = H O H OH H O H O H O OH H O H OH H O H H O 2 2 2 3 2 2 3 简化: 中和反应: NH OH NH H O H Ac HAc OH H H O 4 3 2 2 + = + + = + = + - + - - + H+ H+ H+ H+ H+ H+

二、 酸的相对强度和碱的相对强度 酸和碱的强度是指酸碱给出和接受质子的能 力,同时和溶剂接受和给出质子的能力有关。 HAc HCN 1.76×10-5 5.8×10-10 k:-eJ
酸和碱的强度是指酸碱给出和接受质子的能 力,同时和溶剂接受和给出质子的能力有关。 二、酸的相对强度和碱的相对强度 HAc HCN 1.76×10 K -5 a 5.8×10-10 [ ][ ] [HAc] H O Ac K θ 3 a + - =

Ka标准电离平衡常数-△G=2.303 RTlgK, 简称酸度常数;弱碱的标准电离平衡常数 K,简称碱度常数。 区分效应:用一个溶剂能把酸或碱的相对强 弱区分开来,称为溶剂的“区分效应”。 例如:H2O可以区分HAc,HCN酸性的强弱。 拉平效应:溶剂将酸或碱的强度拉平的作用, 称为溶剂的“拉平效应
拉平效应:溶剂将酸或碱的强度拉平的作用, 称为溶剂的“拉平效应”。 区分效应:用一个溶剂能把酸或碱的相对强 弱区分开来,称为溶剂的“区分效应”。 例如:H2O可以区分HAc,HCN酸性的强弱。 Ka标准电离平衡常数 -ㅿG=2.303RTlgKa 简称酸度常数;弱碱的标准电离平衡常数 Kb ,简称碱度常数