
3、结晶醇 低级醇可以和一些无机盐(MgCl2,CaCl2,CuSO,等)形成晶体 状的分子化合物,称为结晶醇或醇合物。 例如:MgC2·6CH3OH,CaCL2·4CH,OH, CuS04·4C2HL0H等。 因此不能用无水CaCL,来除去醇中所含的水份。 工业上,乙谜中含少量的乙醇就是用这种方法除去。 结晶醇不溶于有机溶剂而溶于水。实验室中利用这一性质 从反应混合物中除去醇,或是将醇和其它的有机溶剂分开
3、结晶醇 低级醇可以和一些无机盐(MgCl2, CaCl2, CuSO4等)形成晶体 状的分子化合物,称为结晶醇或醇合物。 例如:MgCl2 ·6CH3OH, CaCl2 ·4CH3OH, CuSO4 ·4C2H5OH等。 因此不能用无水CaCl2来除去醇中所含的水份。 工业上,乙醚中含少量的乙醇就是用这种方法除去。 结晶醇不溶于有机溶剂而溶于水。实验室中利用这一性质 从反应混合物中除去醇,或是将醇和其它的有机溶剂分开。 11

4、光谱性质:R-0H游离v.o 13500-3650cm-1 缔合3200-3400cm-1(分子间) 3000-3500cm1(分子内) R-O-H vc-o 1000-1200cm-1 1ROH 1050-1085cm1 2ROH 1085-1125cm-1 3ROH 1125-1200cm-1 H-NMR R-O-H 1δ=1~5.5(其值取决于浓度、温度、溶剂) -CH-0Hδ=3.4~4
4、光谱性质:IR -OH 游离 υ-OH 3500-3650 cm-1 缔合 3200-3400cm-1(分子间) 3000-3500cm-1(分子内) R-O-H υC-O 1000-1200 cm-1 10ROH 1050-1085 cm-1 20ROH 1085-1125 cm-1 30ROH 1125-1200 cm-1 1H-NMR R-O-H δ= 1 ~ 5.5 (其值取决于浓度、温度、溶剂) -CH-OH δ= 3.4 ~ 4 12
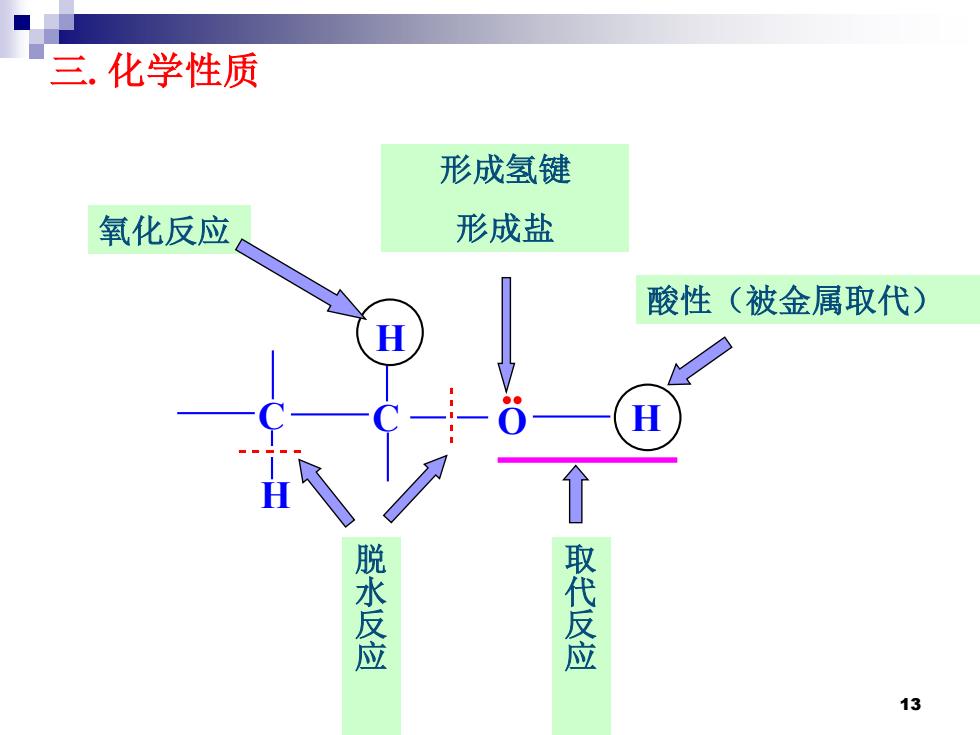
三.化学性质 形成氢键 氧化反应 形成盐 酸性(被金属取代) 脱水反应 取代反应 13
三. 化学性质 C C O H H H 氧化反应 脱水反应 取代反应 酸性(被金属取代) 形成氢键 形成盐 13
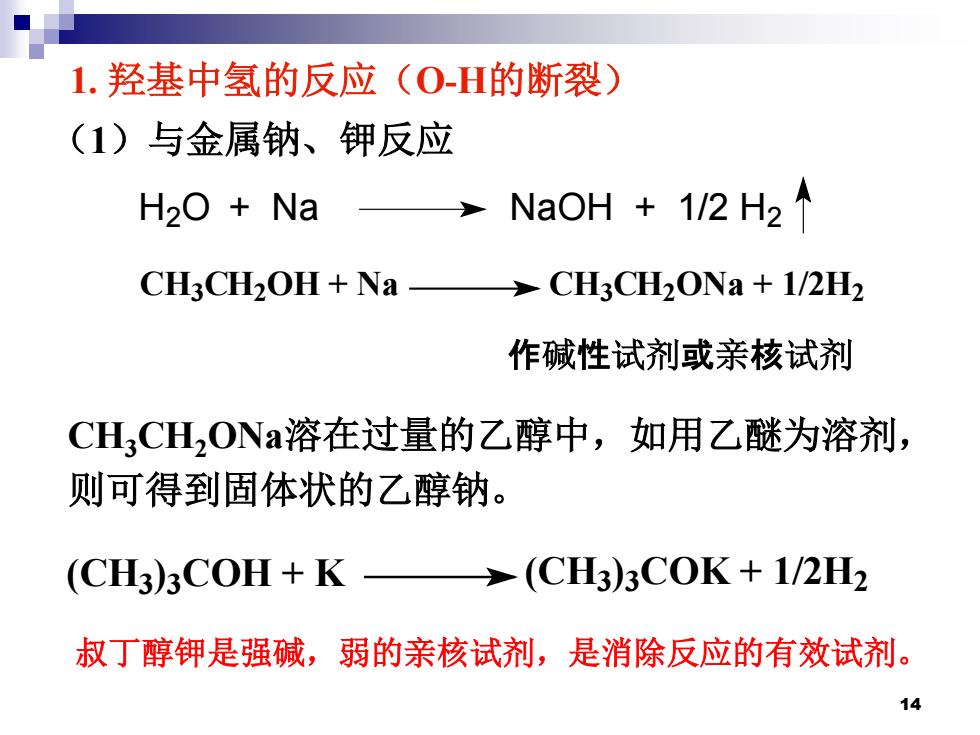
1.羟基中氢的反应(O-H的断裂) (1)与金属钠、钾反应 H2O Na NaOH 1/2 H2 CH3CH2OH+Na >CH3CH2ONa +1/2H2 作碱性试剂或亲核试剂 CHL3CH2ONa溶在过量的乙醇中,如用乙醚为溶剂, 则可得到固体状的乙醇钠。 (CH3)3COH+K >(CH3)3COK+1/2H2 叔丁醇钾是强碱,弱的亲核试剂,是消除反应的有效试剂。 14
CH3CH2ONa溶在过量的乙醇中,如用乙醚为溶剂, 则可得到固体状的乙醇钠。 1. 羟基中氢的反应(O-H的断裂) (1)与金属钠、钾反应 H2O + Na NaOH + 1/2 H2 CH3CH2OH + Na CH3CH2ONa + 1/2H2 作碱性试剂或亲核试剂 叔丁醇钾是强碱,弱的亲核试剂,是消除反应的有效试剂。 (CH3)3COH + K (CH3)3COK + 1/2H2 14

(2) 醇的酸性 水与Na反应非常剧烈,往往会引起爆炸; 醇与Na反应比较缓和,表明醇的酸性比水弱。 酸性 ROH<H,O 碱性RONa>NaOH 根据酸碱理论NaOR+H,O NaOH+ROH 较强碱 较强酸 弱碱 弱酸 该平衡反应主要移向右方,即向生成ROH和NaOH的方向进行, 平衡混合物中RONa的含量很少,如欲从NaOH和ROH制备 RONa,必须设法将体系中的水不断除去,使平衡左移。 15
(2)醇的酸性 水与Na反应非常剧烈,往往会引起爆炸; 醇与Na反应比较缓和,表明醇的酸性比水弱。 酸性 ROH < H2O 碱性 RONa > NaOH 根据酸碱理论 NaOR + H2O → NaOH + ROH 较强碱 较强酸 弱碱 弱酸 该平衡反应主要移向右方,即向生成ROH和NaOH的方向进行, 平衡混合物中RONa的含量很少,如欲从NaOH和ROH制备 RONa,必须设法将体系中的水不断除去,使平衡左移。 15